辣椒各组分含量测定
- 格式:doc
- 大小:62.50 KB
- 文档页数:10


高效液相色谱法测定辣椒及辣椒制品中辣椒素类物质
1.范围:
用高效液相色谱法测定辣椒及辣椒制品中辣椒素类物质的方法及辣度表示方法。
本方法的检出限:辣椒素、二氢辣椒素均为1mg/Kg,线性范围为
1mg/L-150mg/L。
2.试样提取:
在样品中加入甲醇—四氢呋喃混合溶剂25ml,用保鲜膜封口,用针扎几个小孔,然后在60℃浴条件下,使用超声波清洗器提取30min。
用滤纸过滤,收集滤液,然后将滤渣连同滤纸重新加甲醇—四氢呋喃混合溶剂25ml,使用超声波清洗器提取10min,重复两次,将三次过滤收集的滤液合并,用氮吹仪在70℃温度下浓缩至10ml—20ml,然后用甲醇—四氢呋喃混合溶剂定容至50ml,经过滤器(0.45µm微孔过滤膜)过滤后进行色谱分析。
根据样品中辣椒素类物质总量和检测器的灵敏度,必要时可以适当调整稀释倍数。
3.色谱参考条件:
色谱柱:Kromasil C-18 (4.6mm*250mm 5um)
流动相:甲醇:水=65:35
进样量:10 µl
流速:1.0 ml/min
紫外检测波长:280nm
柱温箱温度:30℃
4.结果:
按照色谱条件,进行HPLC分析,用标准物质色谱峰的保留时间定性;根据辣椒素、二氢辣椒素标准曲线及试样中的峰面积定量。

辣椒色素单体组分的分离及其热稳定性研究丁筑红;韩江雪;谭书明;吴梓轩;吴华贵【摘要】热稳定性是评估辣椒质量的一个重要指标.为了研究辣椒色素单体组分的热稳定特性,采用薄层层析、硅胶柱层析分离辣椒色素中单体组分,并在35℃、55℃和75℃条件下动态检测各色素组分的吸光度,探讨单体组分的热稳定性差异对辣椒红色素呈色的影响.结果表明,经分离鉴定的色素组分分别为辣椒红素二酯、辣椒玉红素、玉米黄质二酯和β-胡萝卜素,各单体组分对温度均较为敏感,随着加热温度和时间的增加辣椒色素损失加快,且加热温度对各色素的稳定性均有极显著影响(P<0.01).色素中红色系较黄色系的热稳定性高,红色系中辣椒玉红素较辣椒红素二酯的热稳定性高,黄色系中玉米黄质二酯较β-胡萝卜素的热稳定性强.【期刊名称】《贵州农业科学》【年(卷),期】2010(038)004【总页数】4页(P187-190)【关键词】辣椒色素组分;分离;热稳定性【作者】丁筑红;韩江雪;谭书明;吴梓轩;吴华贵【作者单位】贵州大学,生命科学学院,贵州,贵阳,550025;贵州大学,生命科学学院,贵州,贵阳,550025;贵州大学,生命科学学院,贵州,贵阳,550025;贵州大学,生命科学学院,贵州,贵阳,550025;贵州遵义县贵山红辣椒系列食品厂,贵州,遵义,563000【正文语种】中文【中图分类】TS264.4辣椒色素(Paprika pigment),是从成熟红辣椒果实中提取的一种天然色素,结构为共轭多烯烃,属类胡萝卜色素。
辣椒色素色泽鲜艳,色价高,着色力强,保色效果好,不仅广泛应用于水产品、肉类、糕点、色拉、罐头、饮料等各类食品的着色,还可以有效地延长仿真食品的货架期[1]。
近年来,随着合成色素毒性的不断发现,世界各国使用合成色素日趋减少,辣椒色素安全性高,无毒副作用,被联合国粮农组织和世界卫生组织列为A类食用色素[2]。
其作为绿色环保产品在多领域有着十分广泛的应用[1]。
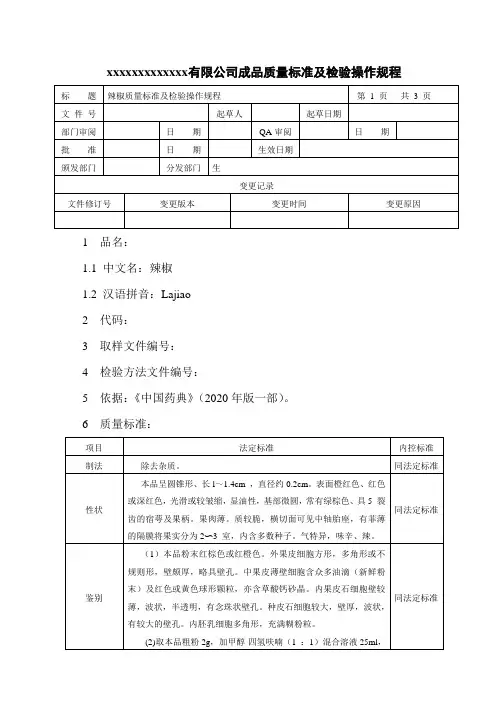
xxxxxxxxxxxxx有限公司成品质量标准及检验操作规程1 品名:1.1 中文名:辣椒1.2 汉语拼音:Lajiao2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:甲醇、四氢呋喃、辣椒素对照品、石油醚(60~90℃)、乙酸乙酯、二氯甲烷、浓氨试液、0.5%2,6-二苯醌-4-氯亚胺甲醇溶液(临用配制)、氨、水、二氢辣椒素对照品、盐酸、氢氧化钠滴定液、甲基红乙醇溶液指示剂。
7.2 仪器与用具:电子天平、显微镜、离心机、硅胶G板、超声波清洗器、高效液相色谱仪、二氧化硫测定仪。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1 取本品制片置10×10显微镜下做显微观察。
7.4.2 取本品粗粉2g,加甲醇-四氢呋喃(1:1)混合溶液25ml,超声处理30分钟,滤过,滤液蒸干,残渣加乙醇2ml使溶解,离心,取上清液作为供试品溶液。
另取辣椒素对照品,加甲醇制成每lml含0. 5mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取供试品溶液2~10µl 、对照品溶液5µl ,分别点于同一硅胶G薄层板上,以石油醚(60~90℃)-乙酸乙酯-二氯甲烷-浓氨试液(10 :10 :5 :0.05)为展开剂,展开,取出,晾干,喷以0.5%2,6-二氯醌-4-氯亚胺甲醇溶液(临用配制),用氨蒸气熏至斑点显色清晰。
供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。
7.5检查:二氧化硫残留量照二氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6 含量测定:照高效液相色谱法(附录8)测定。
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-水(50 :50)为流动相;检测波长为280nm,柱温40℃。
理论板数按辣椒素峰计算应不低于3000。

不同朝天椒种质资源VC含量的测定朝天椒是中国四川省的特色辣椒品种,以其辣味独特、风味鲜美而闻名。
而VC是维生素C的化学名,它是人体所需的一种营养物质,具有抗氧化、促进铁吸收、增强免疫力等多种作用。
对朝天椒的VC含量进行测定,可以对其营养价值进行评估,并对其种质资源进行优胜劣汰。
朝天椒种质资源的VC含量测定可以采用多种方法,下面我们介绍一种常用的测定方法。
一、实验器材和试剂准备:1. 朝天椒样品:选取不同种质资源的朝天椒果实作为样品。
2. 维生素C标准品:纯度为99%以上的维生素C标准品。
3. 硫酸溶液:浓度为5%的硫酸溶液。
4. 磷酸二氢钾溶液:浓度为10%的磷酸二氢钾溶液。
5. 还原溶液:由L-抗坏血酸还原酶、葡萄糖和磷酸二氢钾组成的还原溶液,通常由生物试剂公司提供。
二、样品处理和测定步骤:1. 样品处理:将朝天椒样品洗净,去除果梗,切碎成小片,并称取适量的样品,保持样品的新鲜度。
2. 提取液制备:将10g朝天椒样品加入100ml的5%硫酸溶液中,封闭容器,放入水浴中加热30分钟,使样品完全提取。
3. 过滤:用滤纸过滤提取后的液体,得到澄清的提取液。
4. 还原反应:将2ml提取液加入50ml还原溶液中,封闭容器,放入水浴中加热30分钟,将维生素C氧化成脱氢抗坏血酸。
5. 酶法测定:将样品放在波特曼夫球磨仪中进行大范围的研磨,然后取适量样品置于离心管中,用离心机离心。
将澄清的液体加入预先配制好的还原溶液中,布朗管放入冷却水中短暂均匀振荡,温和平静数分钟,再和适量葡萄糖磷酸二氢钾溶液混合均匀,用离心技术沉淀,将上清液倒入1cm筛选分光光度计中进行检测。
三、数据处理和结果判断:1. 制作维生素C标准曲线:称取不同浓度的维生素C标准品,依次加入提取液和还原溶液,按照上述测定步骤进行处理和测定,在分光光度计上测定吸光度值。
2. 测定朝天椒样品:将提取液和还原溶液依次加入朝天椒样品中,按照上述测定步骤进行处理和测定,在分光光度计上测定吸光度值。


图1 辣椒素标准曲线及线性相关系数
1.5 辣椒素类物质的计算及表示
辣椒素类物质总含量的计算、S H U的计算公式、辣度与S H U的换算关系均参照文献[7]。
1.6 辣度的感官评价
图2 二氢辣椒素标准曲线及线性相关系数
图3 辣椒素与二氢辣椒素标准工作液图谱
椒素的方法检出限为0.5m g/k g、二氢辣椒素的方法检出限为0.8m g/k g。
2.3 流动相的选择
根据辣椒素及二氢辣椒素的化学性质,同时考虑到有机试剂毒性的高低,首先选取甲醇、乙腈作为流动相。
通过考察甲醇、乙腈与水之间的不同比例组成,结合检测效率与成本,最终确定流速为1.0m L/m i n,以甲醇+水=65+35等度洗脱作为。

辣椒素测定及辣度表示方法(湖南省地方标准)辣椒素测定及辣度表示方法Determination of total2006-01-15 发布2006-03-15 实施湖南省质量技术监督局目次前言 (1)1 范围 (2)2 规范性引用文件 (2)3 术语和定义 (2)3.1 辣椒制品 (2)3.2 Scoville Heat Units(SHU) (2)4 原理 (2)5 试剂 (3)6 仪器和设备 (3)7 测定方法 (4)7.1 试样提取 (4)7.2 测定 (4)8 测定结果计算 (5)8.1 辣椒素总量计算 (5)8.2 测定结果的允许偏差 (6)8.3 Scoville Heat Units(SHU)换算 (6)9 辣度级别与Scoville Heat Units(SHU) 指数换算 (6)DB43/T275-2006前言——本标准中测定原理、部分操作过程和要求、部分技术参数(如检测波长、提取溶剂)参考了ISO75 43-2,Chillies and chilli oleoresins—Determination of total capsaicinoid content—Part 2: Method usi ng high-performance liquid chromatography(1993 年英文第一版) 。
辣椒中的辣椒素主要有5种,分别为:辣椒素(Capsaicin)、二氢辣椒素( Dihydrocapsaicin )、降二氢辣椒素(Nordihydrocapsaicin)、高辣椒素(Homocapsaicin)、高二氢辣椒素(Homodihydrocapsaicin),其中辣椒素(Capsaicin)、二氢辣椒素(Dihydrocapsaicin)是影响辣度最主要的成分(约为90%),本标准只规定了辣椒素(Capsaicin) 、二氢辣椒素( Dihydrocapsaicin) 的检测方法。

辣椒素测定标准方法辣椒素是一种天然生物碱,具有强烈的刺激性和辣味,常存在于辣椒属植物中。
为了测定辣椒样品中辣椒素的含量,以下是标准的测定方法,包含以下七个方面:1.样品处理采集具有代表性的新鲜辣椒样品,避免杂质和其他植物部分的混入。
将样品切成小段,并迅速冷冻保存,以保持其营养成分和化学成分的稳定性。
在测定前,将样品置于干燥器中,干燥至恒重。
2.提取步骤将干燥后的样品用粉碎机粉碎,过筛。
选用适宜的溶剂(如乙醇、丙酮等)进行浸泡或搅拌提取。
控制提取温度和时间,一般为室温下24小时,以保证提取完全。
通过过滤和离心分离,收集提取液,残渣再次用溶剂提取,合并两次提取液。
3.分离纯化首先,对提取液进行预处理,如脱色、去味等。
选用适宜的吸附剂(如硅胶、C18等)进行分离纯化。
根据辣椒素的结构特点,选用适当的洗脱剂进行洗脱,收集洗脱组分。
通过柱层析或薄层色谱法进行进一步的纯化。
期间需要注意无菌操作和溶液的稳定性。
4.检测方法常用的辣椒素检测方法有高效液相色谱法(HPLC)、气相色谱-质谱联用法(GC-MS)等。
根据实验室条件和样品特性选择合适的检测方法。
在HPLC或GC-MS检测前,还需对样品进行衍生化处理,以提高检测灵敏度和分离效果。
5.数据分析采用Excel或其他数据处理软件进行数据分析。
对测定得到的峰面积或质量进行归一化处理,得到辣椒素在样品中的含量。
使用SPSS 等统计分析工具,进行数据分析与图表制作,比较不同品种、产地等之间的差异。
6.重复性为保证实验结果的可靠性,需对测定方法进行重复性验证。
选取不同实验室、不同操作人员、不同批次样品进行测定,计算方法的重复性标准差和RSD值(相对标准偏差),以评估方法的精密度和可靠性。
7.精度和误差实验过程中可能存在精度误差和偶然误差。
精度误差主要由仪器设备的精度、试剂的质量等因素引起。
偶然误差则主要由环境温度、湿度、操作人员等因素导致。
为了减小误差,需要注意实验细节和操作规范化。

辣椒质量标准及检验操作规程XXXXXXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中⽂名:辣椒1.2 汉语拼⾳:Lajiao2 代码:3 取样⽂件编号:4 检验⽅法⽂件编号:5 依据:《中国药典》(2020年版⼀部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:甲醇、四氢呋喃、辣椒素对照品、⽯油醚(60~90℃)、⼄酸⼄酯、⼆氯甲烷、浓氨试液、0.5%2,6-⼆苯醌-4-氯亚胺甲醇溶液(临⽤配制)、氨、⽔、⼆氢辣椒素对照品。
7.2 仪器与⽤具:电⼦天平、显微镜、离⼼机、硅胶G板、超声波清洗器、⾼效液相⾊谱仪、⼆氧化硫测定仪。
7.3 性状:取本品适量,⾃然光下⽬测⾊泽,嗅闻⽓味。
7.4 鉴别:7.4.1 取本品制⽚置10×10显微镜下做显微观察。
7.4.2 取本品粗粉2g,加甲醇-四氢呋喃(1:1)混合溶液25ml,超声处理30分钟,滤过,滤液蒸⼲,残渣加⼄醇2ml使溶解,离⼼,取上清液作为供试品溶液。
另取辣椒素对照品,加甲醇制成每lml含0. 5mg的溶液,作为对照品溶液。
照薄层⾊谱法(附录7)试验,吸取供试品溶液2~10µl 、对照品溶液5µl ,分别点于同⼀硅胶G薄层板上,以⽯油醚(60~90℃)-⼄酸⼄酯-⼆氯甲垸-浓氨试液(10 :10 :5 :0.05)为展开剂,展开,取出,晾⼲,喷以0.5%2,6-⼆氯醌-4-氯亚胺甲醇溶液(临⽤配制),⽤氨蒸⽓熏⾄斑点显⾊清晰。
供试品⾊谱中,在与对照品⾊谱相应的位置上,显相同颜⾊的斑点。
7.5检查:⼆氧化硫残留量照⼆氧化硫残留量测定法(附录58)测定,不得过150mg/kg。
7.6含量测定:照⾼效液相⾊谱法(附录8)测定。
⾊谱条件与系统适⽤性试验以⼗⼋烷基硅烷键合硅胶为填充剂;以甲醇-⽔(50 :50)为流动相;检测波长为280nm,柱温40℃。
理论板数按辣椒素峰计算应不低于3000。
对照品溶液的制备辣椒素对照品、⼆氢辣椒素对照品适量,精密称定,加甲醇制成每lml含辣椒素50µg、⼆氢辣椒素20µg的混合溶液,即得。

丘北辣椒香气物质组分分析屈用函;李云;王绍祥;袁恩平;张雪廷;赵水灵【摘要】丘北辣椒是云南省特有的地方品种,种植历史已有300多年,因其色泽红亮、香而辣、辣而不烈的品质,深受消费者喜爱.为进一步开发丘北辣椒独特风味,探索丘北辣椒特异品质形成机理,研究在杂交育种过程中如何保持其特殊品质,本试验利用气相色谱-质谱联用技术(GC-MS)分析其主要的香气物质,利用液相色谱法测定辣椒素、辣椒色素的含量.结果显示:5个丘北辣椒品种的辣椒样品中主要的香味物质是2-甲基丁酸、己酸、紫罗兰酮、二氢猕猴桃内酯、反式-橙花叔醇、4-[2,2,6-三甲基-7-氧杂二环[4.1.0]庚-1-基]-3-丁烯-2-酮;辣椒素含量平均为6.2万SHU,辣椒红素色价平均为11.11.丘北辣椒育种过程中要注意这几种物质的保持和积累.【期刊名称】《辣椒杂志》【年(卷),期】2018(016)002【总页数】6页(P9-14)【关键词】丘北辣椒;香气物质;辣椒素;辣椒红素【作者】屈用函;李云;王绍祥;袁恩平;张雪廷;赵水灵【作者单位】云南省文山州农业科学院辣椒研究所, 云南文山 663000;云南省文山州农业科学院辣椒研究所, 云南文山 663000;云南省文山州农业科学院辣椒研究所, 云南文山 663000;云南省文山州农业科学院辣椒研究所, 云南文山 663000;云南省文山州农业科学院辣椒研究所, 云南文山 663000;云南省文山州农业科学院辣椒研究所, 云南文山 663000【正文语种】中文丘北辣椒(云南小椒)为云南文山的一个地方品种,种植历史可以追溯到明末清初,至今已有300多年。
丘北辣椒果形细长,干不皱缩,光滑而色泽红亮、香而辣、辣而不烈,深受消费者喜爱,已销往我国的广东、贵州、四川、湖南等省市以及美国、日本、韩国、墨西哥、阿根廷等20多个国家和地区。
作为云南省高原特色农作物,2017年文山州辣椒种植面积达12.33万hm2,成为了边疆少数民族必不可少的一个农耕项目,也是他们的重要经济来源。
辣椒精辣度检测方法美国药典中记载的辣椒碱资料辣椒碱(辣椒素)分子结构式:C18H27NO3,分子量:305.41,化学名:(反)-N-[(4-N-羟基-3-甲氧基苯基)-甲基]-8-甲基-6-壬烯基酰胺以干燥提取物计算,辣椒碱含辣椒二萜类化合物总量为标示量的90%-100%,其中辣椒素的含量达到50%以上,辣椒素和二氢辣椒素总量超过75%,其它辣椒素类化合物总量不足15%。
注意事项:小心处置辣椒碱,谨防吸入辣椒碱微粒,勿使身体接触辣椒碱。
包装贮藏:密封包装,置避光,阴凉处保存。
标示量:以辣椒二萜类化合物总百分含量表示。
美国药典参考标准:美国药典辣椒素标准规范,美国药典二氢辣椒素标准规范。
鉴别:配制1.0mg/ml辣椒碱甲醇溶液,配制符合美国药典标准的辣椒碱1.0mg/ml甲醇溶液作为对照液,分别点样于0.25mm厚硅胶、凝胶混合薄层板上,点样量为10L,将薄层板放于乙醚-甲醇(19:1)展开剂中展开,待展开剂前沿至薄层板3/4处时将薄层板取出,晾干,用0.5% 2,6-二溴苯醌-氯化亚胺甲醇溶液喷雾显色,放于氨气中片刻,取出,鉴别色谱图:供试液主要斑点颜色(兰色)及R值与对照液主要斑点颜色(兰色)及R值一致。
熔点〈741〉: 57°-66°, 一般熔融起始温度至结束温度温差不超过5°。
干燥失重〈731〉: 置40°P2O5真空干燥器中干燥5小时,失重不超过1.0%。
灼烧残渣:≤1.0%。
辣椒素,二氢辣椒素及其它辣椒二萜类化合物含量测定:流动相:磷酸水溶液(l :1000,V/V):乙腈(600:400)混匀,0.5m 微孔滤膜滤过,脱气。
流动相视色谱行为可作适当调整。
辣椒素对照液:精密称取美国药典标准的辣椒碱适量溶于甲醇中,配制约0.1 mg/mL的辣椒甲醇溶液。
二氢辣椒素对照液:精密称取美国药典标准的辣椒碱适量溶于甲醇中,配制约0.025mg/mL的辣椒甲醇溶液。
辣椒各组分含量测定一、辣椒中可溶性糖的测定----蒽铜比色法1.原理:糖与硫酸反应脱水生成羟甲基呋喃甲醛,生产物再与蒽铜缩合成兰色化合物,其颜色深浅与溶液中糖的浓度成正比,可比色定量。
2.试剂(1)硫酸锌溶液:溶解500g化学纯硫酸锌于500ml水中(2)亚铁氰化钾溶液:溶解10.6g化学纯亚铁氰化钾于100ml水中(3) 0.2%蒽铜试剂:溶解蒽铜0.2g于100ml95%硫酸中,置棕色瓶中冷暗处保存(4) 0.1%葡萄糖液:准确称干燥葡萄糖0.1000g 定容100ml3.操作方法(1)标准曲线绘制(2) 100ml容量瓶编号沸水浴加热6分钟,取出冷却→用1cm比色杯→610nm测定吸光度→作出以吸光度为横坐标,糖液浓度为纵坐标的准曲线(3)样品测定称10g样品→于100ml热水加入500ml容量瓶中-加硫酸锌5ml→沸水浴5分钟→取出再摇动下加亚铁氰化钾5ml,→冷却→定容500ml→过滤→吸滤液25ml→于250ml容量瓶→定容250ml→取稀释液1ml,于比色管中→加10ml蒽铜试剂→摇匀→水浴加热6分钟→冷却→比色试验注意1,样液必须清澈透明,加热后不应有蛋白质沉淀2,样品颜色较深时,可用活性炭脱色后再进行测定3,此法与所用的硫酸浓度和加热时间有关4,所取糖液浓度在1-2.5mg/100ml之间(一)菲林试剂1、试剂费林试剂:甲液:称取15g硫酸铜(CuSO4·5H2O)及0.05g亚甲基蓝,溶于蒸馏水中并稀释到1000mL。
乙液:称取50g酒石酸钾钠及75g NaOH,溶于蒸馏水中,再加入4g亚铁氰化钾[K4Fe(CN)6],完全溶解后,用蒸馏水稀释到1000mL,贮存于具橡皮塞玻璃瓶中。
0.1%葡萄糖标准溶液:准确称取1.000g经98~100℃干燥至恒重的无水葡萄糖,加蒸馏水溶解后移入 1000mL容量瓶中,加入5mL浓HC l(防止微生物生长),用蒸馏水稀释到1000mL。
6mol/L HCl:取250mL浓HCl(35%~38%)用蒸馏水稀释到500mL。
碘-碘化钾溶液:称取5g碘,10g碘化钾溶于100mL蒸馏水中。
6mol/L NaOH:称取120gNaOH溶于500mL蒸馏水中。
0.1%酚酞指示剂。
2、材料辣椒,淀粉。
3、器材试管3.0×20cm(×1);移液管5mL(×2);烧杯100mL(×1); 250mL 锥形瓶; 调温电炉; 滴定管25mL(×1)。
(二)样品中还原糖的提取准确称取1g辣椒粉,放在100mL烧杯中,先以少量蒸馏水调成糊状,然后加入约40mL蒸馏水,混匀,于50℃恒温水浴中保温20min,不时搅拌,使还原糖浸出混。
过滤,将滤液全部收集在50mL的容量瓶中,用蒸馏水定容至刻度,即为还原糖提取液。
(三)样品中总糖的水解及提取准确称取1g淀粉,放在大试管中,加入6mol/L HCl 10mL,蒸馏水15 mL,在沸水浴中加热0.5h,取出1~2滴置于白瓷板上,加1滴I-KI溶液检查水解是否完全。
如已水解完全,则不呈现蓝色。
水解毕。
冷却至室温后加入1滴酚酞指示剂,以6mol/L NaOH溶液中和至溶液呈微红色,并定容到100mL,过滤取滤液10mL于100mL容量瓶中,定容至刻度,混匀,即为稀释1000倍的总糖水解液,用于总糖测定。
(四)空白滴定准确吸取费林试剂甲液和乙液各5.00mL,置于250mL锥形瓶中,加蒸馏水10mL。
从滴定管滴加约9mL葡萄糖标准溶液,加热使其在2min内沸腾,准确沸腾30s,趁热以每2s 1滴的速度继续滴加葡萄糖标准溶液,直至溶液蓝色刚好褪去为终点。
记录消耗葡萄糖标准溶液的总体积。
平行操作3次,取其平均值,按下式计算:式中:F──10mL费林试剂(甲液和乙液各5.00mL)相当于葡萄糖的量,mg;C──葡萄糖标准溶液的浓度,mg/mL;V──标定时消耗葡萄糖标准溶液的总体积,mL。
(五)样品糖的定量测定(1) 样品溶液预测定:吸取费林试剂甲液及乙液各5.00mL,置于250 mL锥形瓶中,加蒸馏水10mL,加热使其在2min内沸腾,准确沸腾30 s,趁热以先快后慢的速度从滴定管中滴加样品溶液,滴定时要保持溶液呈沸腾状态。
待溶液由蓝色变浅时,以每2s 1滴的速度滴定,直至溶液的蓝色刚好褪去为终点。
记录样品溶液消耗的体积。
(2) 样品溶液测定:吸取费林试剂甲液及乙液各5.00mL,置于锥形瓶中,加蒸馏水10mL,加玻璃珠3粒,从滴定管中加入比与测试样品溶液消耗的总体积少 1mL的样品溶液,加热使其在2min内沸腾,准确沸腾30s,趁热以每2s 1滴的速度继续滴加样液,直至蓝色刚好褪去为终点。
记录消耗样品溶液的总体积。
平行操作3次,取其平均值。
(六)结果处理其中:m──样品重量,g;式中:F──10mL费林试剂(甲液和乙液各5.00mL)相当于葡萄糖的量,mg;V──标定时平均消耗还原糖或总糖样品溶液的总体积,mL;V1──还原糖或总糖样品溶液的总体积,mL;1000──mg换算成g的系数。
注意事项(1)费林试剂甲液和乙液应分别贮存,用时才混合,否则酒石酸钾钠铜络合物长期在碱性条件下会慢慢分解析出氧化亚铜沉淀,使试剂有效浓度降低。
(2)滴定必须是在沸腾条件下进行,其原因一是加快还原糖与Cu2+的反应速度;二是亚甲基蓝的变色反应是可逆的,还原型的亚甲基蓝遇空气中的氧时会再被氧化为氧化型。
此外,氧化亚铜也极不稳定,易被空气中的氧所氧化。
保持反应液沸腾可防止空气进入,避免亚甲基蓝和氧化亚铜被氧化而增加消耗量。
(3)滴定时不能随意摇动锥形瓶,更不能把锥形瓶从热源上取下来滴定,以防止空气进入反应溶液中。
二、维生素C 的含量-----钼蓝比色分光光度法,原理:因为磷钼酸铵经还原剂维生素C 还原后, 可以生成亮蓝色的络合物, 通过分光比色可以测定青椒中还原维生素C[ 6 ]。
本法快速、准确、灵敏度高。
仪器与实验材料紫外- 可见分光光度计(UV - 1600, 日本岛津) ; 6% 的钼酸铵溶液: 准确称取钼酸铵30. 0000g, 加适量蒸馏水溶解后定容至500mL; 草酸- EDTA 溶液: 准确称取含结晶水的草酸6. 5000g, EDTA 0. 0600g,充分溶解定容至1000mL; 偏磷酸- 醋酸溶液: 溶解20g 片状偏磷酸于40mL 醋酸中, 稀释至500mL , 用滤纸过滤, 取滤液备用; 标准V c 溶液: 准确称取V c 0. 0500g; 用上述配好的草酸- EDTA 溶液定容于100mL 的容量瓶中, 使标准液浓度达到0. 5m g?m L; 6% 的硫酸溶液。
准确称取一定量的市售青椒, 加入草酸- EDTA 溶液, 用搅碎机捣碎后移入250mL 容量瓶中, 定容, 过滤, 滤液即为待测样品的提取液。
吸取上述青椒的提取液1mL 于25mL 的容量瓶中, 加入9. 00mL草酸- EDTA 溶液1. 00mL 偏磷酸- 醋酸溶液和3. 00mL 的硫酸, 最后再加入3. 00mL 钼酸铵, 显色。
三、测微量元素Fe、Cu、zn、Mg、Na、Ca、Mn----吸光光度法试剂:HNO3,HC104,蒸馏水,均为分析纯。
仪器:TAS一986型原子吸收分光光度计,DT一100型光电天平,DOB20003型恒温烤箱. 1样品处理将青辣椒、红辣椒自然晾干、粉碎。
放人恒温箱80℃恒温干燥至恒重,精确称取0.500g样品置于50mL带塞锥形瓶中,加入混合液(HNO3)+V(HC104)=2+110mL盖上塞子,放人70~C的恒温烤箱内进行消化8h,然后去塞,并按下列程序控温消化赶酸:100℃30min,120℃30min,150℃120min。
消化赶酸完成时,溶液为淡黄色清亮液体,稍冷即为无色,冷却后,用2o%的稀硝酸定容至50mL的容量瓶中,待测。
同时作试剂空白对照。
2测定方法原子吸收分光光度法测定青辣椒、红辣椒中Fe、Cu、zn、Mg、Na、Ca、Mn的含量。
采用计算机程序控制,以非线性校正方式测定。
四、考马斯亮蓝G-250法测定蛋白质含量(一)原理:考马斯亮蓝G-250(Coomassie brilliant blue G-250)测定蛋白质含量属于染料结合法的一种。
考马斯亮蓝G-250在游离状态下呈红色,最大光吸收在488 nm;当它与蛋白质结合后变为青色,蛋白质-色素结合物在595 nm波长下有最大光吸收。
其光吸收值与蛋白质含量成正比,因此可用于蛋白质的定量测定。
蛋白质与考马斯亮蓝G-250结合在2 min左右的时间内达到平衡,完成反应十分迅速;其结合物在室温下1h内保持稳定。
该法是1976年Bradford建立,试剂配制简单,操作简便快捷,反应非常灵敏,灵敏度比Lowry法还高4倍,可测定微克级蛋白质含量,测定蛋白质浓度范围为0~1 000μg/mL,是一种常用的微量蛋白质快速测定方法。
(二)材料、主要仪器和试剂1.实验材料新鲜辣椒2.主要仪器(1)分析天平、台式天平(2)刻度吸管(3)具塞试管、试管架(4)研钵(5)离心机、离心管(6)烧杯、量筒(7)微量取样器(8)分光光度计3.试剂(1)牛血清白蛋白标准溶液的配制:准确称取100 mg牛血清白蛋白,溶于100 mL蒸馏水中,即为1 000μg/mL的原液。
(2)蛋白试剂考马斯亮蓝G-250的配制:称取100 mg考马斯亮蓝G-250,溶于50 mL 90%乙醇中,加入85%(W/V)的磷酸100 mL,最后用蒸馏水定容到1 000 mL。
此溶液在常温下可放置一个月。
(3)乙醇(4)磷酸(85%)(三)操作步骤1.标准曲线制作(1)0~100μg/mL标准曲线的制作:取6支10mL干净的具塞试管,按表1取样。
盖塞后,将各试管中溶液纵向倒转混合,放置2min后用1cm光经的比色杯在595nm波长下比色,记录各管测定的光密度OD595nm,并做标准曲线。
表1 低浓度标准曲线制作管号 1 2 3 4 5 61 000μg/mL标准蛋白0 0.02 0.04 0.06 0.08 0.10 液(mL)蒸馏水(mL) 1.00 0.98 0.96 0.94 0.92 0.905 5 5 5 5 5 考马斯亮蓝G-250试剂(mL)蛋白质含量(μg)0 20 40 60 80 100 OD595(2)0~1 000μg/mL标准曲线的制作:另取6支10mL具塞试管,按表2取样。
其余步骤同(1)操作,做出蛋白质浓度为0~1 000μg/mL的标准曲线。
表2 高浓度标准曲线制作管号7 8 9 10 11 120 0.2 0.4 0.6 0.8 1.01 000μg/mL标准蛋白液(mL)蒸馏水(mL) 1.00 0.8 0.6 0.4 0.2 05 5 5 5 5 5考马斯亮蓝G-250试剂(mL)蛋白质含量(μg)0 200 400 600 800 1000 OD595nm2.样品提取液中蛋白质浓度的测定(1)待测样品制备:称取新鲜辣椒2g放入研钵中,加2mL蒸馏水研磨成匀浆,转移到离心管中,再用6mL蒸馏水分次洗涤研钵,洗涤液收集于同一离心管中,放置0.5~1h以充分提取,然后在4 000r/min离心20min,弃去沉淀,上清液转入10mL容量瓶,并以蒸馏水定容至刻度,即得待测样品提取液。