蛋白组分测定
- 格式:doc
- 大小:64.50 KB
- 文档页数:3

蛋白组分绝对含量计算公式在食品科学和营养学领域,蛋白质是一种重要的营养物质,它是人体生长和维持生命所必需的。
蛋白质的含量和质量是衡量食品营养价值的重要指标之一。
因此,准确计算蛋白质的含量对于评价食品的营养价值至关重要。
本文将介绍蛋白组分绝对含量的计算公式,并探讨其在食品科学中的应用。
蛋白质是由氨基酸组成的大分子有机化合物,它是构成细胞和组织的重要成分,对维持人体正常的新陈代谢和生理功能起着重要作用。
蛋白质的含量可以通过多种方法进行测定,其中蛋白组分绝对含量的计算公式是一种常用的方法之一。
蛋白组分绝对含量的计算公式如下:蛋白组分绝对含量(g/100g)=氨基酸含量(g/100g)×氨基酸的蛋白质转化因子。
其中,氨基酸含量是指食品中各种氨基酸的含量,通常通过氨基酸分析仪进行测定;氨基酸的蛋白质转化因子是指不同氨基酸的蛋白质转化率,它反映了不同氨基酸对蛋白质含量的贡献程度。
蛋白组分绝对含量的计算公式可以帮助我们准确地计算食品中蛋白质的含量,从而评价其营养价值。
在实际应用中,我们可以通过以下步骤来计算蛋白组分绝对含量:1. 测定食品中各种氨基酸的含量。
这一步通常通过氨基酸分析仪进行测定,得到各种氨基酸的含量数据。
2. 计算氨基酸的蛋白质转化因子。
不同氨基酸对蛋白质含量的贡献程度不同,因此需要根据氨基酸的生理功能和蛋白质转化率来计算其转化因子。
3. 根据上述公式计算蛋白组分绝对含量。
将测定得到的各种氨基酸的含量数据代入公式中,再乘以相应的氨基酸的蛋白质转化因子,即可得到蛋白组分绝对含量。
蛋白组分绝对含量的计算公式在食品科学中具有重要的应用价值。
它可以帮助我们准确地评价食品中蛋白质的含量,从而指导人们合理膳食,保障人体对蛋白质的需求。
此外,蛋白组分绝对含量的计算公式还可以用于食品加工和生产中的质量控制,帮助生产者控制食品中蛋白质的含量,提高产品的营养价值。
除了在食品科学中的应用,蛋白组分绝对含量的计算公式还可以在营养学研究中发挥重要作用。

蛋白质含量的测定方法及原理蛋白质是生物体内一种重要的有机化合物,具有构建细胞结构、调节生理功能等重要作用。
因此,准确测定蛋白质的含量对于生物科学研究和临床诊断具有重要意义。
本文将介绍几种常用的蛋白质含量测定方法及其原理。
一、比色法比色法是一种常用的蛋白质含量测定方法,其原理是利用蛋白质与某些特定试剂形成显色物,根据显色物的光吸收特性来测定蛋白质的含量。
1. 低里氏法低里氏法是一种经典的蛋白质含量测定方法,其原理是利用试剂双硫苏三唑酮(DTNB)与蛋白质中的半胱氨酸残基反应产生黄色的二硫苏三唑,然后通过分光光度计测定其在412nm处的吸光度,根据标准曲线计算出蛋白质的含量。
2. 伯杰法伯杰法是一种基于酪蛋白与浊度试剂金霉素的显色反应来测定蛋白质含量的方法。
酪蛋白与金霉素结合形成沉淀,通过比色法测定沉淀的光吸收度,再根据标准曲线计算出蛋白质的含量。
3. 白蛋白-酷伊斯基(BCA)法BCA法是一种常用的高灵敏度蛋白质测定方法,其原理是在碱性条件下,蛋白质与BCA试剂中的铜离子络合生成紫色的离子螯合物,通过比色法测定在562nm处的光吸收度,再根据标准曲线计算出蛋白质的含量。
二、光谱法光谱法是一种基于蛋白质在特定波长下的吸收特性来测定蛋白质含量的方法。
1. 紫外吸收法紫外吸收法根据蛋白质中的芳香族氨基酸(如酪氨酸、酪氨酸和色氨酸)在紫外光区域(200-400nm)的吸收特性来测定蛋白质含量。
通过分光光度计测定蛋白质溶液在280nm处的吸光度,再根据标准曲线计算出蛋白质的含量。
2. 近红外光谱法近红外光谱法是一种无损、非破坏性的蛋白质含量测定方法,其原理是利用蛋白质溶液在近红外光区域(700-2500nm)的吸收特性与其含量之间的关系。
通过近红外光谱仪获取蛋白质溶液的光谱图像,然后利用化学计量学方法建立标准模型,通过光谱图像预测蛋白质的含量。
三、生化分析法生化分析法是一种利用生化技术和仪器设备来测定蛋白质含量的方法。

α1α2球蛋白是人体内重要的蛋白质组分,主要由肝脏合成。
它们在血液中的含量可以反映肝功能的状况。
对于α1α2球蛋白的标准值,不同实验室和
地区可能会有所差异,但一般来说,成年人的参考范围如下:
1. α1球蛋白:正常值范围为0.7-1.8g/L。
2. α2球蛋白:正常值范围为0.4-1.4g/L。
如果α1α2球蛋白的测定值超出正常范围,可能表明肝功能存在异常。
需要注意的是,单独的α1α2球蛋白测定值异常并不足以确诊肝病,需要结合其他肝功能指标和临床症状综合判断。
在检测肝功能时,最好进行全面的肝功能检查,包括转氨酶、碱性磷酸酶、γ-谷氨酰转移酶等多种指标,以获得更准确的诊断结果。

一、实验目的1. 了解组分蛋白测定的原理和方法。
2. 掌握组分蛋白测定实验的步骤和注意事项。
3. 培养实验操作技能,提高对蛋白质组分分析的认识。
二、实验原理组分蛋白测定是利用特定的方法将蛋白质样品中的各种组分分离,并对各组分进行定量分析。
本实验采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)技术,对蛋白质样品进行分离,并通过比色法测定各组分蛋白的相对含量。
SDS-PAGE是一种常用的蛋白质分离技术,其原理是在样品中加入一定浓度的SDS (十二烷基硫酸钠)和还原剂(如β-巯基乙醇),使蛋白质发生变性、解离,形成SDS-蛋白质复合物。
SDS-蛋白质复合物在电场作用下,根据分子量大小进行分离。
由于SDS对蛋白质的变性作用,蛋白质的分子量与其迁移率呈线性关系,因此可以通过测定各组分蛋白的迁移率来推算其分子量。
比色法是一种快速、简便的定量分析方法,其原理是利用蛋白质与特定试剂反应产生的颜色变化与蛋白质含量成正比,通过比色计测定吸光度,从而计算蛋白质含量。
三、实验材料与仪器1. 实验材料:- 蛋白质样品- SDS-PAGE凝胶- 电泳缓冲液- 还原剂- 标准蛋白溶液- 比色试剂- 比色计2. 实验仪器:- 电泳仪- 离心机- 研钵- 移液器- 烧杯- 移液管- 比色杯四、实验步骤1. 准备SDS-PAGE凝胶:按照说明书配制SDS-PAGE凝胶,加入蛋白质样品、还原剂和上样缓冲液。
2. 电泳:将SDS-PAGE凝胶置于电泳仪中,加入电泳缓冲液,设置电压和电泳时间。
3. 取出凝胶:电泳结束后,取出凝胶,用考马斯亮蓝G250染色。
4. 洗脱:将染色后的凝胶置于脱色液中,脱色至背景清晰。
5. 定量分析:将凝胶置于比色杯中,加入比色试剂,用比色计测定吸光度。
6. 结果分析:根据标准蛋白溶液的吸光度值和蛋白质含量,绘制标准曲线。
根据实验样品的吸光度值,从标准曲线上查找相应的蛋白质含量。
五、实验结果与分析1. 实验结果:通过SDS-PAGE分离,蛋白质样品被成功分离成多个组分。

蛋白质分子量测定方法目前,蛋白质分子量测定的常用方法主要有四种:年度法、凝胶过滤层析法、凝胶电泳法和凝胶渗透色谱(GPC)法。
一、粘度法一定温度条件下,高聚物稀溶液的粘度与其分子量之间呈正相关性,随着分子量的增大,聚合物溶液的粘度增大。
通过测定高聚物稀溶液粘度随浓度的变化,即可计算出其平均分子量(粘均分子量)。
该方法操作简单、设备价格较低,通常不需要标准样品,但无法测定聚合物的分子量分布。
粘度法所需设备:恒温槽、乌倍路德粘度计。
二、凝胶过滤层析法在凝胶色谱柱中,分子量不同的聚合物分子,由于其渗入凝胶微孔的能力不同而在柱中得以分离。
分子量较大的分子,渗入凝胶微孔较浅,随洗脱液流动速度较快,因而先流出色谱柱;相反,分子量较小的聚合物分子后流出。
通过测定从进样到聚合物分子流出色谱柱期间流过凝胶柱的洗脱液的体积,并与标准样品比较,即可计算聚合物的分子量,并估算其分子量分布。
凝胶层析技术操作方便,设备简单,样品用量少,而且有时不需要纯物质,用一粗制品即可,目前已得到相当广泛的应用。
凝胶层析法测定分子量也有一定的局限性,在pH6—8的范围内,线性关系比较好,但在极端pH时,一般蛋白质有可能因变性而偏离。
糖蛋白在含糖量超过5%时,测得分子量比真实的要大,铁蛋白则与此相反,测得的分子量比真实的要小。
凝胶过滤层析法所需设备:层析柱、紫外分光光度计。
三、SDS-凝胶电泳法SDS是十二烷基硫酸钠的简称,它是一种阴离子表面活性剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(在一定条件下,大多数蛋白质与SDS的结合比为1.4gSDS/1g蛋白质),使各种蛋白质-SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而使其电泳迁移率只取决于分子大小这一因素,于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线,可求得未知物的分子量。
SDS-凝胶电泳法是目前蛋白质分子量测定中使用最广泛的方法,实验成本较低,仪器设备也相对很简单,一套电泳装置即可。

实验一蛋白质分子的测定─凝胶层析法一、实验原理凝胶层析法(即凝胶过滤法,gel filtration)是利用凝胶把分子大小不同的物质分离开的一种方法。
将凝胶颗粒在适宜溶剂中浸泡,使充分吸液膨胀,然后装入层析柱中,加入欲分离的混合物,再以同一溶剂洗脱,在洗脱过程中大分子不能进入凝胶内部而沿凝胶颗粒间的空隙最先流出柱外,小分子可以进入凝胶内部,流苏缓慢,一直最后流出柱外,从而使样品中分子大小不同的物质得以分离。
凝胶是由胶体溶液凝结而成的固体物质,不论是天然凝胶还是人工合成凝胶,其内部都具有很微细的多空网状结构。
凝胶层析法常用的天然凝胶是琼脂糖凝胶(Sepharose),人工合成的凝胶是聚丙烯酰胺凝胶(Bio-gel-P)和葡聚糖凝胶(Sephadex G)。
其中葡聚糖凝胶是具有不同孔隙度的立体网状结构的凝胶,不溶于水。
将凝胶装柱后,柱床体积称为“总体积”,以Vt表示。
Vt由V o,Vi与Vg三部分组成,即Vt=Vi+Vg+V o。
V o为“孔隙体积”、“外水体积”,即存在于柱床内凝胶颗粒外面空隙之间的水相体积;Vi为内体积,即凝胶颗粒内部所含水相的体积;Vg为凝胶本身体积;Ve为洗脱体积,即自加入样品时算起到组分最大浓度(峰)出现时所流出的体积,Ve与V o及Vi之间的关系为:Ve=V o+K d Vi,;K d为样品组分在二相间的分配系数,Kd=(Ve-V o)/Vi,有效分配系数为Kav,Kav=(Ve-V o)/(Vt-V o)。
在一般情况下,凝胶对组分没有吸附作用时,当流动相流过Vt体积后,所有的组分都应该被洗出来,这一点为凝胶层析的特点,与一般层析方法不同。
Ve与分子量的关系:对同一类型的化合物,洗脱特性与组分的分子量有关,流过凝胶柱时,按分子量大小顺序流出,分子量大的走在前面。
Ve与分子量的关系为:Ve=K1-K2logM,K1与K2为常数,M为分子量,通常用Kav代替V e,建立标准蛋白质分子式量LgM与Kav的标准曲线,称为“选择曲线”。

蛋白质组学三大基本技术
1、质谱技术:质谱技术是蛋白质组学中最常用的和最基本的技术,它可以检测和识
别各种生物样品中的蛋白质和其他大分子有机物,从而可以提高研究的准确性,特别是在
研究动态蛋白信号转导及表观遗传因子的时候,质谱技术的应用更加广泛。
质谱技术包括
两种:基于气相法的高级数据库技术,和基于液相法的maldi技术。
质谱技术主要是利用
质谱仪来获取受体上蛋白质结构的数据,然后利用数据库搜索,来识别出蛋白质结构特征
及在受体上的结合状态。
2、SDS-PAGE技术:SDS-PAGE技术是一种蛋白电泳分析技术,它可以分离组成复合蛋
白的每个蛋白质组分,并对蛋白质的组成成分及其特有的分子量进行测定,是一种蛋白质
分类及检测的基础性技术。
SDS-PAGE技术利用聚丙烯酰胺亚胺(SDS)作为为分子内部量均
分剂,可将蛋白链折叠、聚集形成单个分子,然后进行电泳分离操作,在膜隔开一定距离,然后再对所获取到的蛋白分子特征进行识别,以得出它的结构和分子量的信息,进而得出
受体上分子的特征及其功能。
3、免疫淋巴细胞技术:免疫淋巴细胞技术是实验可能性较好、分离效果更好。
它以
电泳分离技术作为分离介质,从新鲜样品中分离出完整的肽盐化药物,可有效地检测及克
隆受体上的蛋白片段及肩膀,进而得出蛋白质组学上受体特征及其功能。

小麦籽粒蛋白组分测定
小麦是一种广泛种植的农作物,其籽粒中含有丰富的蛋白质。
对小麦籽粒蛋白组分的测定对于了解小麦的品质和营养价值具有重要意义。
小麦籽粒蛋白组分测定是通过一系列的实验方法和技术来进行的。
首先,需要将小麦籽粒样品进行研磨,得到细粉末。
然后,利用溶液进行提取,将蛋白质从其他组分中分离出来。
接下来,通过离心等操作,将提取的蛋白质进一步纯化和分离。
最后,利用色谱技术或质谱技术等方法,对蛋白质进行定性和定量分析。
小麦籽粒蛋白组分的测定可以得到多个指标,例如总蛋白质含量、谷蛋白含量、球蛋白含量等。
这些指标可以反映小麦的营养价值和品质。
总蛋白质含量是评价小麦蛋白质丰富程度的重要指标,谷蛋白含量是衡量小麦蛋白质营养价值的关键指标,而球蛋白含量则与小麦面筋质地和加工性能有关。
小麦籽粒蛋白组分的测定对于小麦品种改良和农产品质量控制具有重要意义。
通过了解小麦蛋白质的组成和含量,可以选择适合特定用途的小麦品种。
同时,对于小麦加工工业来说,了解小麦蛋白质的特性可以优化加工工艺,提高产品质量。
小麦籽粒蛋白组分测定是一项重要的研究工作,对于了解小麦的品质和营养价值具有重要意义。
通过科学准确的实验方法和技术,可
以获取关于小麦蛋白质组分的详细信息,为小麦品种改良和农产品质量控制提供科学依据。
我们相信,随着科技的不断进步,小麦籽粒蛋白组分测定将在农业领域发挥越来越重要的作用。

江苏农业学报(JiangsuJ.ofAgr.Sci.)ꎬ2023ꎬ39(1):30 ̄36http://jsnyxb.jaas.ac.cn戚良轩ꎬ徐晴玉ꎬ李㊀晶ꎬ等.灰飞虱唾液鞘形态及其蛋白质组分鉴定[J].江苏农业学报ꎬ2023ꎬ39(1):30 ̄36.doi:10.3969/j.issn.1000 ̄4440.2023.01.004灰飞虱唾液鞘形态及其蛋白质组分鉴定戚良轩1ꎬ㊀徐晴玉1ꎬ㊀李㊀晶1ꎬ㊀鞠佳菲1ꎬ㊀孙㊀洋2ꎬ㊀方继朝1ꎬ3ꎬ㊀纪㊀锐1ꎬ2ꎬ3(1.江苏省农业科学院植物保护研究所ꎬ江苏南京210014ꎻ2.安徽师范大学生命科学学院/安徽省重要生物资源保护与利用研究重点实验室ꎬ安徽芜湖241000ꎻ3.淮阴师范学院/江苏省区域现代农业与环境保护协同创新中心ꎬ江苏淮安223300)收稿日期:2022 ̄09 ̄26基金项目:国家自然科学基金面上项目(31871965)ꎻ 十四五 国家重点研发计划项目(2021YFD1401100)ꎻ江苏省农业科技自主创新基金项目[CX(22)3018]作者简介:戚良轩(1993-)ꎬ男ꎬ安徽铜陵人ꎬ博士ꎬ助理研究员ꎬ主要从事作物与害虫互作研究ꎬ(E ̄mail)470724564@qq.comꎮ徐晴玉为共同第一作者ꎮ通讯作者:纪㊀锐ꎬ(E ̄mail)jirui@jaas.ac.cnꎻ方继朝ꎬ(E ̄mail)fangjc@jaas.ac.cn㊀㊀摘要:㊀灰飞虱是一种小型的刺吸式口器昆虫ꎬ是危害水稻的主要害虫之一ꎮ灰飞虱刺吸取食时分泌的胶状唾液可形成唾液鞘ꎬ保护口针并帮助取食ꎬ同时其中的蛋白质效应子在调控作物免疫中扮演重要角色ꎮ本研究利用扫描电子显微镜观察了灰飞虱唾液鞘的形态:多呈树枝状ꎬ表面为较为光滑的珠状结构ꎮ应用双层膜装置收集了若虫的唾液鞘ꎬ经液相色谱与串联质谱联用检测鉴定得到42种灰飞虱唾液鞘蛋白质ꎬ其中19种蛋白质检测到2个及以上的唯一肽段ꎮ进一步分析了编码这19种蛋白质的基因在各个组织中的表达模式ꎬ发现其中8个基因在唾液腺中明显高表达ꎬ推测其可能参与了唾液鞘的形成以及害虫 ̄作物的互作ꎮ唾液鞘蛋白质组分鉴定为后续筛选和研究灰飞虱效应子功能提供了基础ꎬ有助于明确灰飞虱 ̄水稻互作的分子机制ꎬ为开发害虫绿色防控新策略提供思路ꎮ关键词:㊀灰飞虱ꎻ唾液鞘ꎻ蛋白质组分中图分类号:㊀S435.112㊀㊀㊀文献标识码:㊀A㊀㊀㊀文章编号:㊀1000 ̄4440(2023)01 ̄0030 ̄07MorphologyandproteinidentificationofsalivarysheathfromLaodelphaxstriatellusQILiang ̄xuan1ꎬ㊀XUQing ̄yu1ꎬ㊀LIJing1ꎬ㊀JUJia ̄fei1ꎬ㊀SUNYang2ꎬ㊀FANGJi ̄chao1ꎬ3ꎬ㊀JIRui1ꎬ2ꎬ3(1.InstituteofPlantProtectionꎬJiangsuAcademyofAgriculturalSciencesꎬNanjing210014ꎬChinaꎻ2.KeyLaboratoryforConservationandUseofImpor ̄tantBiologicalResourcesofAnhuiProvince/CollegeofLifeSciencesꎬAnhuiNormalUniversityꎬWuhu241000ꎬChinaꎻ3.JiangsuCollaborativeInnovationCenterofRegionalModernAgriculture&EnvironmentalProtection/HuaiyinNormalUniversityꎬHuaiᶄan223300ꎬChina)㊀㊀Abstract:㊀Smallbrownplanthopper(SBPH)Laodelphaxstriatellusꎬthetinnysap ̄suckinginsectsꎬisoneofthemostdestructiveherbivoresdamagingriceinChina.DuringthefeedingprocessꎬgelsalivasecretedbySBPHscanformthesalivarysheathtoprotectstyletandhelpfeeding.Someproteineffectorsinthesalivarysheathplayimportantrolesinregula ̄tingplantimmunity.HereꎬweobservedthemorphologyofSBPHsalivarysheathsunderscanningelectronmicroscope:mostsalivarysheathsweredendriticandhadsmoothbeadstructuresinthesurface.ThesalivarysheathsofSBPHnymphswerecollectedusingdoublemembranedevice.Aftertheliquidchromatography ̄tandemmassspec ̄trometer(LC ̄MS/MS)analysisꎬ42proteinswerefinallyi ̄dentifiedinthesalivarysheathsꎬandamongthemꎬ19pro ̄teinswithtwoormoreuniquepeptidesweredetected.U ̄singquantitativepolymerasechainreactionꎬweanalyzed03theexpressionpatternsofgenesencodingthese19proteinsindifferenttissuesofSBPHꎬandfoundeightgeneswithdramat ̄icallyhigherexpressionlevelsinthesalivaryglandꎬsuggestingtheirimportanceintheformationofsalivarysheathsandin ̄teractionofinsectandplant.TheseresultslayasolidfoundationforstudyingthefunctionofSBPHsalivarysheathꎬrevea ̄lingthedetailedmechanismofSBPH ̄riceinteractionꎬanddevelopinggreenpestmanagementstrategies.Keywords:㊀Laodelphaxstriatellusꎻsalivarysheathꎻproteincomponent㊀㊀作物与害虫之间一直存在共同进化的 军备 竞赛ꎮ作物通过受体识别与感知害虫的相关分子信号激活一系列的免疫反应ꎬ比如:诱发钙离子内流ꎬ激活丝裂原活化蛋白激酶途径ꎬ诱导活性氧爆发和抗虫激素积累ꎬ进而产生有毒物质影响昆虫的取食㊁发育ꎬ或产生挥发物来吸引害虫天敌ꎮ相应地ꎬ害虫也进化出各种对抗策略来逃避与破解植物的防御反应ꎬ分泌效应子至宿主作物体内就是其中的重要策略之一[1]ꎮ灰飞虱(Laodelphaxstriatellus)等刺吸式口器害虫在取食过程中ꎬ向作物体内不断地分泌2种类型的唾液 水状唾液与胶状唾液ꎬ调控植物免疫ꎬ帮助昆虫取食[2]ꎮ水状唾液中的酶类可以将植物的营养物质初步降解ꎬ有利于消化吸收ꎬ部分效应子还能以多种形式与植物抗虫因子相互作用ꎬ比如ꎬ(1)酶解宿主植物中的抗虫物质:褐飞虱(Nilaparvatalugens)唾液中的内切β ̄1ꎬ4 ̄葡聚糖酶能分解水稻中的纤维素ꎬ便于口针在水稻细胞间和向细胞内穿刺时突破细胞壁屏障ꎬ帮助其顺利取食[3]ꎮ灰飞虱唾液中的DNaseII能够降解刺吸损伤时植物产生的胞外DNAꎬ进而抑制刺吸损伤诱导的防御反应[4]ꎻ(2)与植物细胞内的金属离子结合:褐飞虱和灰飞虱唾液中的钙结合蛋白通过结合水稻细胞质中的Ca2+ꎬ阻断钙信号通道ꎬ抑制取食所诱导的水稻胼胝质沉积以及抗虫信号分子的积累[5 ̄7]ꎻ(3)与植物中的关键抗虫蛋白质互作:灰飞虱效应子卵黄原蛋白在细胞核中与免疫调控转录因子OWRKY71互作ꎬ并抑制其转录活性ꎬ进而抑制OsWRKY71介导的防御反应[8]ꎻ烟粉虱(Bemisiatabaci)效应子Bt56㊁Bsp9㊁Ar ̄met分别和寄主植物中的转录因子NTH202和WRKY33以及半胱氨酸蛋白酶抑制子CYS6互作ꎬ抑制植物免疫[9 ̄11]ꎮ然而ꎬ胶状唾液的成分鉴定和功能分析的报道相对较少ꎬ目前仅在褐飞虱中鉴定到16种蛋白质[12]ꎮ胶状唾液分泌进入植物体内后凝结成唾液鞘ꎬ包裹㊁润滑和保护口针[13]ꎬ还能隔绝口针和植物细胞结构的接触ꎬ封闭针刺产生的细胞伤口ꎬ防止植物细胞内容物外流所引发的免疫反应ꎮ飞虱唾液鞘中的主要蛋白质(Salivarysheathprotein和Mucin)对于唾液鞘的形成和取食至关重要[14 ̄15]ꎬ沉默Mucin能影响飞虱的取食行为ꎬ不利于植物病毒的水平传播[16]ꎬ而且Mucin还可以被作物识别ꎬ激发强烈的防御反应[15]ꎮ灰飞虱属半翅目飞虱科害虫ꎬ由其直接取食㊁产卵和传播病毒病所引起的粮食减产损失极其严重ꎮ唾液是植物 ̄病毒 ̄昆虫三者互作的关键因素ꎬ鉴定灰飞虱的唾液鞘蛋白效应子ꎬ设计相应策略阻断这些唾液效应子的功能ꎬ一方面可以有效地控制灰飞虱的直接危害ꎬ另一方面通过抑制其取食来阻断作物病毒的水平传播ꎬ起到 一石二鸟 的作用ꎮ本研究拟在电子显微镜下观察灰飞虱唾液鞘的形态ꎬ利用液相色谱与串联质谱联用(Liquidchromatography ̄tandemmassspec ̄trometerꎬLC ̄MS/MS)等方法鉴定灰飞虱唾液鞘蛋白质组分ꎬ并采用定量PCR技术对唾液鞘基因的组织表达模式进行分析ꎬ为后续效应子筛选积累重要的蛋白质资源ꎮ1㊀材料与方法1.1㊀供试昆虫灰飞虱在人工气候室内[温度:(28ʃ1)ħꎻ光周期:14h光照㊁10h黑暗]以南粳9108稻苗为寄主进行饲养ꎮ1.2㊀双层膜夹蔗糖溶液用高压灭菌后的超纯水溶解蔗糖ꎬ配置成2.5%的蔗糖溶液ꎬ经针孔式过滤器(滤膜孔径0 22μm)除菌ꎮ将Parafilm膜裁成小方块ꎬ置于紫外灯下灭菌1hꎮ将充分拉伸过的膜覆盖在双通玻璃管的一端ꎬ另一端用纱布包住透气ꎮ将80μl蔗糖溶液滴到膜的中央位置ꎬ再覆上第2层膜ꎬ压紧2层膜使蔗13戚良轩等:灰飞虱唾液鞘形态及其蛋白质组分鉴定糖溶液在膜间充分铺展ꎮ1.3㊀唾液鞘样品处理及形态观察(1)样品收集与清洗:将约60头4~5龄灰飞虱若虫放进双通管中ꎬ待灰飞虱在上述的Parafilm膜上取食蔗糖溶液24h后ꎬ用75%乙醇溶液轻轻漂洗带有唾液鞘的膜ꎮ(2)固定:将4%多聚甲醛与2 5%戊二醛(2ʒ1ꎬ体积比)混合配置成固定液ꎬ对Parafilm膜进行固定ꎬ然后去除固定液ꎬ并用PBS溶液进行清洗ꎮ(3)脱水:用梯度浓度的乙醇溶液(30%~100%)对样品进行梯度脱水ꎮ(4)置换:向上述样品中倒入醋酸异戊酯和乙醇(1ʒ2ꎬ体积比)的混合液ꎬ适当摇动10minꎻ转移膜至醋酸异戊酯ʒ乙醇(1ʒ1ꎬ体积比)的混合液中ꎬ摇动10minꎻ最后转移膜至醋酸异戊酯中ꎬ缓慢摇动10minꎬ从样品中充分置换出乙醇ꎮ(5)干燥:用滤纸吸除样品表面残留的醋酸异戊酯ꎬ将样品膜在室温下干燥24hꎬ然后转移至50ħ的烘箱中ꎬ干燥2hꎻ(6)粘样㊁镀膜:采用导电双面胶将膜粘到样品台上ꎬ利用离子溅射法镀膜ꎻ(7)样品观察:在扫描电镜观察室进行观察ꎬ拍摄获得唾液鞘的清晰图片ꎮ涉及的具体方法参照文献[17]ꎮ1.4㊀唾液鞘收集在体视显微镜下观察ꎬ用镊子从Parafilm膜上取下完整的唾液鞘ꎬ放入SDT蛋白裂解液中ꎬ-80ħ保存ꎮ取约6000头若虫的唾液鞘ꎬ超声波破碎处理(100W工作10sꎬ间歇10sꎬ循环10次)ꎬ沸水浴10minꎮ离心后取上清液ꎬ利用胰蛋白酶进行充分酶解ꎬ获得肽段ꎮ1.5㊀LC ̄MS/MS测定上述酶解后的肽段上样到经0 1%甲酸溶液平衡过的色谱柱ꎬ再经分析柱分离ꎬHPLC系统流速设定为0 3μl/minꎮ色谱分离后的产物进一步用Q ̄Exactive质谱仪检测2hꎮ1.6㊀质谱数据分析和蛋白质鉴定将获得的质谱数据利用MASCOT软件比对灰飞虱基因组预测的蛋白质数据库(https://www.ncbi.nlm.nih.gov/data ̄hub/genome/?taxon=195883&annotated_only=true&refseq_annotation=true&genbank_annotation=true)ꎮ参数设定如下:enzyme为trypsinꎻmissedcleav ̄agesites为2ꎻfixedmodification为carbamidomethylꎻvar ̄ialbemodification为oxidation(M)和Acetyl(ProteinN ̄term)ꎻ过滤参数FDRɤ0 01ꎮ1.7㊀灰飞虱各组织总RNA提取和荧光定量PCR分析㊀㊀灰飞虱各组织总RNA的提取参照普洛麦格生物技术有限公司的总RNA提取试剂盒说明书进行ꎬ提取的总RNA用琼脂糖凝胶电泳和艾本德有限公司的微量分光光度计检测其质量和浓度ꎮcDNA合成参照宝生物工程有限公司的反转录试剂盒说明书进行ꎮ定量PCR配置体系和方法参照宝生物工程有限公司的染料法荧光定量试剂盒(TBGreenTMPremixExTaqTMkit)说明书进行ꎬ在罗氏的LightCy ̄cler480II实时荧光定量PCR仪上进行反应ꎮ灰飞虱延伸因子基因(EF ̄1)为内参基因ꎬ唾液鞘基因相对表达量的计算采用2-әCt方法[8]ꎮ2㊀结果与分析2.1㊀灰飞虱唾液鞘形态利用扫描电子显微镜观察Parafilm膜上的灰飞虱唾液鞘的形态ꎮ唾液鞘多为树枝状ꎬ可有多个分叉ꎬ大多数表面为较光滑的珠状结构(图1)ꎮ图1㊀扫描电子显微镜观察的灰飞虱唾液鞘的形态Fig.1㊀Morphologicalobservationofsmallbrownplanthoppersalivarysheathunderscanningelectronmicroscope2.2㊀灰飞虱唾液鞘样品质量检测收集到69 7μg灰飞虱唾液鞘蛋白质ꎬ利用SDS ̄PAGE分析了唾液鞘样品的质量ꎬ蛋白质条带(考染)清晰㊁丰富(图2)ꎬ表明唾液鞘蛋白质含量较高ꎬ并且未发生明显的降解和损失ꎮ唾液鞘样品质量较好ꎬ可满足后续蛋白质组分测定的要求ꎮ23江苏农业学报㊀2023年第39卷第1期2.3㊀灰飞虱唾液鞘蛋白质鉴定与注释利用LC ̄MS/MS检测了灰飞虱唾液鞘的蛋白质成分ꎬ共鉴定到42种蛋白质ꎬ其中19种蛋白质检测到的肽段数量较多ꎬ有2~34个唯一肽段ꎻ其他23种蛋白质只检测到1条唯一肽段ꎮ利用SignalP ̄5.0预测这些唾液鞘蛋白质的信号肽序列:仅4个含信号肽ꎬ分别是精氨酸激酶和肌动蛋白ꎬ以及2个未知功能蛋白质(KAF7751974.1和RZF33379.1)ꎮ将鉴定到的蛋白质氨基酸序列比对到NCBI的Non ̄RedundantProtein(NR)数据库进行功能注释ꎬ发现其中36个具有功能注释结果(表1)ꎮ肌球蛋白重链在唾液鞘蛋白质中含量最高ꎬ检测到34个唯一肽段ꎮ副肌球蛋白质的含量次之ꎬ检测到12个唯一肽段ꎮ图2㊀SDS ̄PAGE分析灰飞虱唾液鞘样品Fig.2㊀Analysisofsmallbrownplanthoppersalivarysheathsu ̄singSDS ̄PAGE2.4㊀灰飞虱唾液鞘基因的组织表达模式检测到19种唾液鞘蛋白质的唯一肽段数ȡ2(表1)ꎬ表明这些蛋白质的鉴定结果可信度较高ꎬ因此利用定量PCR探究了这19个基因在灰飞虱各组织中的表达模式ꎬ引物见表2ꎮ结果(图3)表明ꎬ编码副肌球蛋白㊁精氨酸激酶㊁原肌球蛋白 ̄1㊁延伸因子1 ̄α㊁肌球蛋白调节轻链2㊁碱性肌球蛋白轻链㊁组蛋白H2B以及微管蛋白β ̄1链的8个基因在唾液腺中特异性高表达ꎬ而在脂肪体㊁肠道㊁精巢以及卵巢中表达量很低ꎮ其余基因在灰飞虱各个组织中均有不同程度的表达ꎮ表1㊀灰飞虱唾液鞘蛋白质组分Table1㊀Proteincomponentsofsmallbrownplanthoppersalivarysheath蛋白质组分㊀㊀㊀㊀㊀㊀㊀登录号㊀㊀唯一肽段数是否含有信号肽肌球蛋白重链APA34054.134否副肌球蛋白RZF40854.112否肌动蛋白相关蛋白1RZF32723.110否ATP合酶α亚基AIL26069.15否精氨酸激酶RZF41846.14是原肌球蛋白 ̄1RZF37477.13否组蛋白H4XP_015372596.13否羧化酶/加氧酶大亚基ASD35392.13否原肌球蛋白1RZF46537.13否延伸因子1 ̄αRZF35682.13否ATP合酶β亚基RZF41650.13否钙转运ATP酶RZF36560.12否肌球蛋白调节轻链2RZF41800.12否碱性肌球蛋白轻链RZF45242.12否组蛋白H2BAAB48092.12否α ̄肌动蛋白RZF39134.12否肌动蛋白GFT55090.12否ADP/ATP易位酶RZF32594.12否微管蛋白β ̄1链XP_022207921.12否原肌球蛋白 ̄1XP_022187623.11否未知功能蛋白XP_022168166.11否未知功能蛋白RZF39757.11否未知功能蛋白RZF47266.11否黏蛋白JF502033.11是动力蛋白β链RZF44437.11否剪接因子1KAF7742323.11否光系统IICP43反应中心蛋白KAH9752498.11否可能的分泌蛋白QMU23604.11否组蛋白H4CAF9928778.11否未知功能蛋白KAF7751974.11是表皮蛋白7XP_022186634.11否ATP合酶α亚基KXN69528.11否线粒体F1F0ATP合酶RCI05405.11否肌动蛋白AMZ01553.11否未知功能蛋白RZF40234.11否热休克蛋白70 ̄5AQP31338.11否微管蛋白α ̄1链RZF47578.11否原肌球蛋白 ̄1RZF41119.11否液泡蛋白分选蛋白XP_022195458.11否ATP合酶脂质结合蛋白RZF46192.11否包含BTB/POZ结构域的蛋白1RZF37421.11否未知功能蛋白RZF33379.11是33戚良轩等:灰飞虱唾液鞘形态及其蛋白质组分鉴定SG:唾液鞘ꎻGut:肠道ꎻTe:精巢ꎻOv:卵巢ꎻFB:脂肪体ꎮ不同字母表示组织间同一基因的相对表达量具有显著性差异(P<0 05)ꎮ图3㊀灰飞虱唾液鞘基因的组织表达模式Fig.3㊀Expressionpatternofsalivarysheathgenesindifferenttissuesofsmallbrownplanthopper3㊀讨论本研究利用扫描电子显微镜观察到灰飞虱唾液鞘呈树枝状的清晰形态ꎬ并收集了大量的灰飞虱唾液鞘样品ꎬ利用LC ̄MS/MS测定了其蛋白质组分ꎬ鉴定得到42个灰飞虱唾液鞘蛋白质ꎬ其中ATP合成酶ꎬ肌动蛋白和Mucin在褐飞虱唾液鞘蛋白质中也被鉴定到[12]ꎬ其他唾液鞘蛋白质组分为首次报道ꎮ我们鉴定到的灰飞虱唾液鞘蛋白质数量虽然比褐飞虱唾液鞘中鉴定得到的蛋白质数量(16种)要多[12]ꎬ但是远少于水状唾液中鉴定得到的蛋白质数量(褐飞虱水状唾液中鉴定到149种蛋白质ꎬ灰飞虱中鉴定到236种)[18]ꎬ这说明水状唾液中蛋白质比胶状唾液中蛋白质的种类和功能更丰富ꎬ这可能是因为水状唾液参与了飞虱取食㊁体外消化和降解㊁调控水稻防御等多种功能ꎬ而胶状唾液多为结构性蛋白质ꎬ其主要参与唾液鞘形成ꎮ43江苏农业学报㊀2023年第39卷第1期表2㊀灰飞虱唾液鞘基因定量PCR检测的引物Table2㊀PrimersusedforqPCRdetectionofsalivarysheathgenesinsmallbrownplanthopper检测基因㊀㊀㊀㊀引物(5ᶄң3ᶄ)肌球蛋白重链F:CGTGGTAAGAGGAGGAACGAR:TTCTTTGAGCTGGCACCAAC副肌球蛋白F:AACTGGAACTGGACGAGGAGR:CTGGGTCTGTTTGTCCAAGC肌动蛋白相关蛋白1F:CCATGTACGTTGCCATCCAGR:AGGTAGTCGGTCAAGTCACGATP合酶α亚基F:GCCGTGTATTGAGCATTGGTR:CAATGTCGCCCTCCTTGATG精氨酸激酶F:ACCTTCCTCGTATGGTGCAAR:TGGGGCAGAAGGTCAAGAAT原肌球蛋白 ̄1F:CCAACCAACTGAAGGAAGCCR:ACCGACAACCTTCAACTCCT组蛋白H4F:TCCGGTTTGATTTACGAAGAAACR:ACCTCCGAAACCGTAAAGAG羧化酶/加氧酶大亚基F:ATGAGTGTCTACGTGGTGGAR:TCTTCACATGTACCCGCAGT原肌球蛋白1F:TGAGGAGGCCGACAAGAAATR:TCTGGGTCGCCTTTTCTTCT延伸因子1 ̄αF:AAGTGCGGAGGTATCGACAAR:TACTTGGCCGTCTCGAACTTATP合酶β亚基F:GATCGGTCTGTTTGGTGGTGR:TGTCCTTGAGCGAGATGACA钙转运ATP酶F:TGACCAGTTGACAGCGTTTGR:TCCTTGGCCCTGATCTTCTG肌球蛋白调节轻链2F:GCTCAAAGGGCTCCAAGAAGR:CTTCAGCGAGCATGTCATCC碱性肌球蛋白轻链F:GCTCTACGACAAGGCTGAGAR:AGCCAGGAATGGGATGTAGG组蛋白H2BF:TCACTACAACAAACGCTCGACR:ACTGCTTTTGTTCCCTCACTα ̄肌动蛋白F:GACGGCAACCTGAAGATGACR:GCCAAACCGTCCTTGAAACT肌动蛋白F:TGGATTTGGCTGGACGAGATR:TCGGGCAATTCGTAGGACTTADP/ATP易位酶F:TCACTCTGCTTCGTCTACCCR:CGACACTCCGAATCCTCTGT微管蛋白β ̄1链F:CGCCGATCTGAGAAAACTGGR:ATGGACATTCGGCCTCTGAA延伸因子F:TCGAGTCCTTCCAGGAGTTCR:CGACAGATCCTTCTGCGTTA㊀㊀水状唾液中的降解酶可以帮助昆虫体外消化㊁分解植物中的营养物质和抗性因子ꎮ本研究在唾液鞘中虽然未检测到相关的降解酶ꎬ但鉴定到一些与能量代谢相关的酶ꎬ比如ADP/ATP转移酶和5种ATP合成酶ꎬ这在稻飞虱水状唾液㊁胶状唾液中也被检测到[5ꎬ12]ꎬ其可能在植物中发挥了与消耗能量相关的功能ꎮ此外ꎬ还发现了肌球蛋白㊁原肌球蛋白㊁副肌球蛋白㊁微管蛋白㊁肌动蛋白等参与维持细胞功能的一些结构蛋白质ꎬ推测这些蛋白质可能与唾液鞘的形成有关ꎬ其在昆虫 ̄植物互作中的功能尚需进一步研究ꎮ灰飞虱唾液鞘蛋白质组分比较丰富ꎬ但仅有4个蛋白质含有信号肽ꎬ这与其他刺吸式口器昆虫唾液中大部分蛋白质不含信号肽类似ꎬ说明除了内质网 ̄高尔基体这一经典的分泌途径外ꎬ唾液蛋白质还有着其他非经典的分泌方式[12]ꎮ不同的唾液鞘基因在灰飞虱各组织中的表达模式不尽相同ꎬ测定的19个基因中ꎬ42%的基因在唾液腺中的表达水平显著高于在其他组织中的表达量ꎬ这些蛋白质可能在唾液腺中合成ꎬ然后被分泌到寄主作物中ꎬ主要在保持唾液腺的生理功能㊁维持正常的取食行为或调控水稻防御过程中发挥重要作用ꎬ它们是潜在的效应子ꎮ唾液鞘蛋白质除了具有参与唾液鞘形成以及介导昆虫与植物互作的功能ꎬ还可能参与植物病毒的传播ꎮ普通的非虫接种方式很难使病毒感染植物ꎬ唾液作为植物 ̄病毒 ̄昆虫三者互作的关键因素ꎬ极可能是病毒侵染作物并且传播爆发的关键因子ꎮ水稻条纹病毒(RicestripevirusꎬRSV)随着灰飞虱唾液进入到水稻中ꎬ最近研究发现唾液鞘蛋白质Mucin与唾液鞘形成相关ꎬ通过影响灰飞虱的取食行为来干扰RSV的水平传播ꎬ表明正常结构的唾液鞘对于刺吸式口器害虫水平传播植物病毒极为重要[16]ꎮ由于唾液鞘蛋白质在植物 ̄病毒 ̄昆虫互作中的重要性及其功能的多样性ꎬ本研究鉴定到的42种灰飞虱唾液鞘蛋白质是研究灰飞虱 ̄水稻 ̄病毒互作过程中的重要里程碑ꎮ深入研究这些蛋白质在帮助灰飞虱危害作物和传播病毒过程中的作用ꎬ一方面有利于明晰害虫 ̄病毒 ̄作物互作背后复杂的分子机制等基础科学问题ꎬ另一方面鉴定出的效应子以及与效应子互作的水稻抗虫因子ꎬ可以成为抗性育种㊁新型RNAi生物农药㊁高效防控的新靶标ꎬ这对于制定害虫可持续治理对策㊁研发新的绿色防控产品及技术ꎬ具有重要价值ꎮ参考文献:[1]㊀董玉妹ꎬ张美倩ꎬ沈㊀慧ꎬ等.植食性昆虫唾液效应子和激发子的研究进展[J].昆虫学报ꎬ2021ꎬ64(8):982 ̄997.53戚良轩等:灰飞虱唾液鞘形态及其蛋白质组分鉴定[2]㊀COHENCA.Extra ̄oraldigestioninpredaceousterrestrialarthrop ̄oda[J].AnnualReviewofEntomologyꎬ1995ꎬ40:85 ̄103. [3]㊀JIRꎬYEWFꎬCHENHDꎬetal.Asalivaryendo ̄β ̄1ꎬ4 ̄glu ̄canaseactsasaneffectorthatenablesthebrownplanthoppertofeedonrice[J].PlantPhysiologyꎬ2017ꎬ173:1920 ̄1932. [4]㊀HUANGHJꎬCUIJRꎬXIAXꎬetal.SalivaryDNaseIIfromLao ̄delphaxstriatellusactsasaneffectorthatsuppressesplantdefence[J].NewPhytologistꎬ2019ꎬ224(2):860 ̄874. [5]㊀FUJMꎬSHIYꎬWANGLHꎬetal.Planthopper ̄secretedsalivarycalmodulinactsasaneffectorfordefenseresponsesinrice[J].FrontiersinPlantScienceꎬ2022ꎬ13:841378.[6]㊀TIANTꎬJIRꎬFUJMꎬetal.Asalivarycalcium ̄bindingproteinfromLaodelphaxstriatellusactsasaneffectorthatsuppressesde ̄fenseinrice[J].PestManagementScienceꎬ2021ꎬ77(5):2272 ̄2281.[7]㊀YEWFꎬYUHXꎬJIANYKꎬetal.AsalivaryEF ̄handcalcium ̄bindingproteinofthebrownplanthopperNilaparvatalugensfunc ̄tionsasaneffectorfordefenseresponsesinrice[J].ScientificRe ̄portsꎬ2017ꎬ7:40498.[8]㊀JIRꎬFUJMꎬSHIYꎬetal.Vitellogeninfromplanthopperoralsecretionactsasanoveleffectortoimpairplantdefenses[J].NewPhytologistꎬ2021ꎬ232:802 ̄817.[9]㊀WANGNꎬZHAOPZꎬMAYHꎬetal.AwhiteflyeffectorBsp9targetshostimmunityregulatorWRKY33topromoteperformance[J].PhilosophicalTransactionsoftheRoyalSocietyBꎬ2019ꎬ374(1767):20180313[10]XUHXꎬQIANLXꎬWANGXWꎬetal.Asalivaryeffectorena ̄bleswhiteflytofeedonhostplantsbyelicitingsalicylicacid ̄signa ̄lingpathway[J].ProceedingsoftheNationalAcademyofSci ̄encesꎬ2019ꎬ116(2):490 ̄495.[11]DUHꎬXUHXꎬWANGFꎬetal.Armetfromwhiteflysalivaactsasaneffectortosuppressplantdefensesbytargetingtobaccocysta ̄tin[J].NewPhytologistꎬ2022ꎬ234(5):1848 ̄1862.[12]HUANGHJꎬLIUCWꎬHUANGXHꎬetal.Screeningandfunc ̄tionalanalysesofNilaparvatalugenssalivaryproteome[J].JournalofProteomeResearchꎬ2016ꎬ15:1883.[13]SŌGAWAK.Thericebrownplanthopper:feedingphysiologyandhostplantinteractions[J].AnnualReviewofEntomologyꎬ2003ꎬ27(1):49 ̄73.[14]HUANGHJꎬLIUCWꎬCAIYFꎬetal.Asalivarysheathproteinessentialfortheinteractionofthebrownplanthopperwithriceplants[J].InsectBiochemistryandMolecularBiologyꎬ2015ꎬ66:77 ̄87.[15]SHANGGUANXXꎬZHANGJꎬLIUBFꎬetal.Amucin ̄likepro ̄teinofplanthopperisrequiredforfeedingandinducesimmunityresponseinplants[J].PlantPhysiologyꎬ2018ꎬ176(1):552 ̄565. [16]HUOYꎬZHAOJꎬMENGXYꎬetal.Laodelphaxstriatellussalivamucinenablestheformationofstyletsheathestofacilitateitsfeed ̄ingandricestripevirustransmission[J].PestManagementSci ̄enceꎬ2022ꎬ78(8):3498 ̄3507.[17]鞠佳菲ꎬ孙㊀洋ꎬ刘宝生ꎬ等.一种制备稻飞虱唾液鞘扫描电镜样品的方法:ZL201811514920.X[P].2021 ̄06 ̄01.[18]HUANGHJꎬLUJBꎬLIQꎬetal.Combinedtranscriptomic/pro ̄teomicanalysisofsalivaryglandandsecretedsalivainthreeplan ̄thopperspecies[J].JournalofProteomicsꎬ2018ꎬ172:25 ̄35.(责任编辑:陈海霞)63江苏农业学报㊀2023年第39卷第1期。
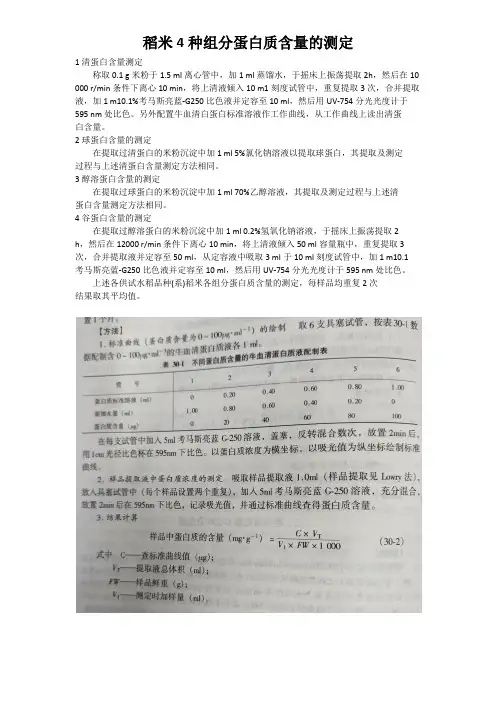
稻米4种组分蛋白质含量的测定
1清蛋白含量测定
称取0.1 g米粉于1.5 ml离心管中,加1 ml蒸馏水,于摇床上振荡提取2h,然后在10 000 r/min条件下离心10 min,将上清液倾入10 m1刻度试管中,重复提取3次,合并提取液,加1 m10.1%考马斯亮蓝-G250比色液并定容至10 ml,然后用UV-754分光光度计于595 nm处比色。
另外配置牛血清白蛋白标准溶液作工作曲线,从工作曲线上读出清蛋
白含量。
2球蛋白含量的测定
在提取过清蛋白的米粉沉淀中加1 ml 5%氯化钠溶液以提取球蛋白,其提取及测定
过程与上述清蛋白含量测定方法相同。
3醇溶蛋白含量的测定
在提取过球蛋白的米粉沉淀中加1 ml 70%乙醇溶液,其提取及测定过程与上述清
蛋白含量测定方法相同。
4谷蛋白含量的测定
在提取过醇溶蛋白的米粉沉淀中加1 ml 0.2%氢氧化钠溶液,于摇床上振荡提取2
h,然后在12000 r/min条件下离心10 min,将上清液倾入50 ml容量瓶中,重复提取3 次,合并提取液并定容至50 ml,从定容液中吸取3 ml于10 ml刻度试管中,加1 m10.1
考马斯亮蓝-G250比色液并定容至10 ml,然后用UV-754分光光度计于595 nm处比色。
上述各供试水稻品种(系)稻米各组分蛋白质含量的测定,每样品均重复2次
结果取其平均值。

1.方法原理根据小麦种子蛋白的溶解性能,把它们可分为清蛋白(Albumin)、球蛋白(Globulin)、麦醇溶蛋白(Gliadin)和麦谷蛋白(Glutenin)四种组分。
清蛋白在中性或微酸性条件下易溶解于水。
球蛋白不溶于水而溶于中性稀盐溶液。
醇溶蛋白不溶于水及稀盐溶液,溶于乙醇溶液。
谷蛋白不溶于水,稀盐溶液及乙醇溶液,只溶于稀碱或稀酸溶液。
因此,可用水、10%NaCl、70%~80%乙醇、0.2%NaOH 溶液作溶剂,分别提取小麦种子蛋白中的清蛋白、球蛋白、醇溶蛋白及谷蛋白四种不同组分,并用凯氏法定量。
2.蛋白质组分的分离提取1.清蛋白称1g试样于15ml离心管中,加几滴纯水用玻璃棒搅拌成匀浆,再加10ml纯水。
将离心管放入50℃水浴中,搅拌提取半小时。
离心(4000r/min)20min,上清液移入50ml容量瓶中。
用纯水如上法洗残渣2次,每次加水10ml,搅拌10min,离心10min。
上清液并入提取液中,加水定容至50ml。
2.球蛋白向上述残渣中加入10m10%的氯化钠溶液,同前提取、离心,并用氯化钠洗残渣2次。
提取液并入50ml容量瓶中,加10%氯化钠溶液定容至50ml。
3.醇溶蛋白向上述残渣中加入10ml75%乙醇,放入50℃水浴中,搅拌浸提5min,然后在室温下继续搅拌浸提30min。
同前离心,用乙醇洗残渣2次,每次在室温下搅拌洗渣5min。
提取液并入容量瓶,加75%乙醇定容至50ml。
4.谷蛋白向上述残渣中加入10ml0.2%氢氧化钠溶液,同清蛋白的方法提取、离心,用NaOH洗残渣2次。
提取液并入容量瓶,加入0.2%的氢氧化钠定容至50ml。
3蛋白质组分的测定1.清蛋白吸取清蛋白提取液10ml于50ml消解试管中,加催化剂0.2g,混液(过氧化氢—硫酸混合液,30%过氧化氢:浓硫酸:水=3:2:1)3ml。
在试管口放一小曲颈漏斗,置于远红外消解炉上。
开始小火力,使管内溶液微沸,并保持微沸约5min。
4种蛋白组分的测定引言蛋白质是生物体中最重要的大分子有机化合物之一,对维持生命活动起着重要的作用。
蛋白质的组成非常复杂,不同种类的蛋白质具有不同的结构和功能。
测定蛋白质的组分可以帮助我们更好地了解生物体的生理状态和疾病的发生机制。
本文将介绍4种常用的蛋白组分测定方法,包括总蛋白测定、血清白蛋白测定、血清球蛋白测定和尿液微量白蛋白测定。
1. 总蛋白测定总蛋白测定是一种常用的测定方法,用于确定生物样品中所有蛋白质的总含量。
常用的总蛋白测定方法有比色法和免疫测定法。
1.1 比色法比色法是一种通过测定蛋白质与某种试剂反应后产生的比色反应来确定蛋白质含量的方法。
常用的比色试剂有布拉德福试剂和比昂斯基试剂。
具体操作步骤如下:1.取一定量的生物样品,将其与比色试剂混合。
2.等待一定的反应时间,使蛋白质与试剂充分反应。
3.使用分光光度计测定反应液的吸光度。
4.根据吸光度与已知标准曲线的关系,计算出样品中蛋白质的含量。
1.2 免疫测定法免疫测定法是一种利用抗体与特定蛋白质结合的特异性来测定蛋白质含量的方法。
常用的免疫测定方法有酶联免疫吸附测定法(ELISA)和放射免疫测定法(RIA)。
ELISA方法的操作步骤如下:1.在微孔板上涂覆特定抗体,使其与待测蛋白质结合。
2.加入待测样品,使样品中的蛋白质与已固定的抗体结合。
3.加入辣根过氧化物酶标记的第二抗体,使其与待测蛋白质结合。
4.加入底物,使辣根过氧化物酶催化产生发色反应。
5.使用分光光度计测定发色液的吸光度。
6.根据吸光度与已知标准曲线的关系,计算出样品中蛋白质的含量。
2. 血清白蛋白测定血清白蛋白是血液中含量最丰富的蛋白质之一,对维持血浆渗透压和运输物质起着重要作用。
血清白蛋白测定可以用于评估肝功能和营养状况。
2.1 电泳法电泳法是一种通过电场作用使蛋白质在凝胶上移动的方法,根据蛋白质的电荷和大小分离不同种类的蛋白质。
血清白蛋白测定可以通过电泳法进行。
具体操作步骤如下:1.准备电泳凝胶,常用的凝胶有聚丙烯酰胺凝胶和琼脂糖凝胶。
4种蛋白组分的测定蛋白质是生物体中不可或缺的基本营养物质,具有重要的生理功能。
在科学研究和食品工业等领域,测定蛋白质的组分和含量是一项重要任务。
本文将介绍四种常见蛋白组分的测定方法,包括总蛋白、酪蛋白、胶原蛋白和麦芽蛋白。
一、总蛋白的测定总蛋白是指生物体内所有蛋白质的总和,常用于评价生命的生物样本中蛋白质的含量。
常见的测定方法有比色法和光散射法。
1. 比色法:这是一种常见且简单的方法,基于蛋白质与某些化学试剂发生颜色反应的原理。
常用的比色试剂有布拉德福德试剂、伯松试剂和Lowry试剂。
通过与标准蛋白溶液进行比色反应,可以利用分光光度计测定反应后溶液的吸光度,然后通过与标准曲线对比,确定样品中总蛋白的含量。
2. 光散射法:这是一种通过测量蛋白质溶液中散射光的强度来测定蛋白质浓度的方法。
根据蛋白质的浓度和颗粒大小,散射光的强度也会发生变化,利用散射光强度与蛋白质浓度的关系,可以计算出样品中的总蛋白含量。
二、酪蛋白的测定酪蛋白是奶制品中的主要蛋白质,具有良好的营养价值。
常用的酪蛋白测定方法有比色法和酸碱滴定法。
1. 比色法:通过与酪蛋白反应的比色试剂,如联苯胺和二甲基氨基苯,形成有色化合物的方法来测定酪蛋白的含量。
通过分光光度计测量比色反应后溶液的吸光度,并与标准曲线对比,确定样品中酪蛋白的含量。
2. 酸碱滴定法:这是一种基于蛋白质的氨基酸组成和等值点的性质来测定酪蛋白含量的方法。
通过加入酸或碱溶液,使酪蛋白在等值点的pH值范围内发生电中性点,从而确定酪蛋白的含量。
三、胶原蛋白的测定胶原蛋白是构成哺乳动物体内结缔组织的主要蛋白质,对于维持皮肤、骨骼和关节的功能至关重要。
常用的胶原蛋白测定方法有氢氧化物溶解法和酶解法。
1. 氢氧化物溶解法:这是一种通过将胶原蛋白与氢氧化物溶液反应生成游离氨基酸的方法来测定胶原蛋白含量。
通过检测胶原蛋白溶解反应后产生的游离氨基酸的含量,可以计算出胶原蛋白的含量。
2. 酶解法:这是一种通过将胶原蛋白与特定酶反应产生多肽链的方法来测定胶原蛋白的含量。
蛋白质分子量测定方法目前,蛋白质分子量测定的常用方法主要有四种:年度法、凝胶过滤层析法、凝胶电泳法和凝胶渗透色谱(GPC)法。
一、粘度法一定温度条件下,高聚物稀溶液的粘度与其分子量之间呈正相关性,随着分子量的增大,聚合物溶液的粘度增大。
通过测定高聚物稀溶液粘度随浓度的变化,即可计算出其平均分子量(粘均分子量)。
该方法操作简单、设备价格较低,通常不需要标准样品,但无法测定聚合物的分子量分布。
粘度法所需设备:恒温槽、乌倍路德粘度计。
二、凝胶过滤层析法在凝胶色谱柱中,分子量不同的聚合物分子,由于其渗入凝胶微孔的能力不同而在柱中得以分离。
分子量较大的分子,渗入凝胶微孔较浅,随洗脱液流动速度较快,因而先流出色谱柱;相反,分子量较小的聚合物分子后流出。
通过测定从进样到聚合物分子流出色谱柱期间流过凝胶柱的洗脱液的体积,并与标准样品比较,即可计算聚合物的分子量,并估算其分子量分布。
凝胶层析技术操作方便,设备简单,样品用量少,而且有时不需要纯物质,用一粗制品即可,目前已得到相当广泛的应用。
凝胶层析法测定分子量也有一定的局限性,在pH6—8的范围内,线性关系比较好,但在极端pH时,一般蛋白质有可能因变性而偏离。
糖蛋白在含糖量超过5%时,测得分子量比真实的要大,铁蛋白则与此相反,测得的分子量比真实的要小。
凝胶过滤层析法所需设备:层析柱、紫外分光光度计。
三、SDS-凝胶电泳法SDS是十二烷基硫酸钠的简称,它是一种阴离子表面活性剂,加入到电泳系统中能使蛋白质的氢键和疏水键打开,并结合到蛋白质分子上(在一定条件下,大多数蛋白质与SDS的结合比为1.4gSDS/1g蛋白质),使各种蛋白质-SDS复合物都带上相同密度的负电荷,其数量远远超过了蛋白质分子原有的电荷量,从而使其电泳迁移率只取决于分子大小这一因素,于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线,可求得未知物的分子量。
SDS-凝胶电泳法是目前蛋白质分子量测定中使用最广泛的方法,实验成本较低,仪器设备也相对很简单,一套电泳装置即可。
测定蛋白质含量的方法和原理蛋白质是生物体内最为重要的有机分子之一,对于了解生物体的结构和功能至关重要。
因此,准确、精确地测定蛋白质含量是生物化学研究中的关键一步。
本文将介绍常用的测定蛋白质含量的方法和其原理。
一、低里德伯法(Lowry法)低里德伯法是测定蛋白质含量的常用方法之一。
其原理基于酚在碱性条件下与蛋白质发生反应,在存在重铬酸钾的条件下生成一种带有吸收峰的蓝色化合物。
这种蓝色化合物在750 nm波长处有最大的吸光度,其吸光度与蛋白质含量呈线性关系。
二、比色法比色法是测定蛋白质含量的常用方法之一。
常用的比色剂有布拉德福法和加伦氏法。
布拉德福法主要原理是根据蛋白质中含有的酪氨酸、酪氨酸衍生物等组分在碱性条件下与染料结合,形成有色产物,利用比色计测定产物的吸光度从而测定蛋白质的含量。
三、BCA法BCA法是一种基于铜离子的氧化还原反应的方法。
其原理是在碱性条件下,蛋白质中的蛋白质-联没有的二瓣基色团(BCA)与四氢呋喃(THF)结合,生成紫色的螯合物。
这种紫色螯合物的吸光度与蛋白质的含量成正比,可以通过比色计测定吸光度值来确定蛋白质含量。
四、荧光法荧光法是一种基于蛋白质与荧光染料之间的相互作用的测定方法。
常用的荧光染料有吖啶橙、铜铁磺胺二异硫氰酸盐(Ferrozine)等。
这些荧光染料在特定的pH值和溶液中与蛋白质发生作用,产生荧光信号。
利用荧光光谱仪测定荧光强度,通过标准曲线得出蛋白质的含量。
五、生物传感器法生物传感器法是利用生物传感器对蛋白质的特异性识别和反应进行测定的方法。
常用的生物传感器包括酶传感器、抗体传感器等。
这些传感器可以通过与蛋白质结合形成复合物或发生反应,产生信号。
利用信号的强度可以测定蛋白质的含量。
六、尿素与氨基酸分析法尿素与氨基酸分析法是通过测定蛋白质降解产生的尿素和游离氨基酸来推测蛋白质的含量。
该方法基于蛋白质降解后,其氨基酸经氧化反应生成尿素,通过检测尿素或游离氨基酸的浓度来间接测定蛋白质含量。
小麦籽粒蛋白组分测定
1. 蛋白质含量测定,常用的方法包括Kjeldahl法和Bradford 法。
Kjeldahl法是通过测定样品中氮的含量来计算蛋白质含量,而Bradford法则是利用蛋白质与染料结合产生颜色变化来测定蛋白质含量。
2. 蛋白质组分分析,常用的方法包括凝胶电泳和质谱分析。
凝胶电泳可以将蛋白质按照其大小和电荷进行分离,从而得到不同蛋白质的组分信息。
质谱分析则可以通过测定蛋白质分子的质量和序列来确定其组分和结构特征。
3. 含氨基酸分析,蛋白质的氨基酸组成对其功能和营养价值具有重要影响,因此对小麦籽粒蛋白的氨基酸组成进行分析也是很重要的一步。
4. 免疫学方法,利用抗体对特定蛋白质进行检测和定量,可以帮助确定小麦籽粒中特定蛋白质的存在和含量。
总的来说,小麦籽粒蛋白组分测定是一个复杂而多方面的分析过程,需要综合运用化学、生物学和物理学的方法来全面了解小麦
籽粒中蛋白质的组成和特征。
这些信息对于小麦的营养评价、加工利用以及相关产品的质量控制具有重要意义。
检测人体血清中的蛋白质组分介绍利用毛细管电泳法可检测人体血清中相对的白蛋白和球蛋白的含量。
测量方法毛细管电泳法检测人体血清中白蛋白和球蛋白的含量是基于这些物质在电场中因电泳淌度的不同实现有差别的迁移和分离。
定性和定量分析蛋白质是通过直接测定该物质在215-220 nm区域内的紫外吸收。
血浆中蛋白质组分的参考值毛细管电泳的优点与其它方法相比,测定血清中蛋白质所使用的电泳和醋酸纤维素和琼脂糖凝胶,毛细管电泳有几个优点:●没有特别的样品制备●实时检测●易于使用●定量测定●低的成本分析设备与试剂以下设备和试剂在测量中被使用:●CAPEL®-105毛细管电泳仪●蒸馏水●白蛋白●氢氧化钠,超级纯●硫酸,超级纯●四硼酸钠,超级纯●十二烷基硫酸钠(SDS),超级纯在WINDOWS®98/ME/NT/2000/XP系统下安装采集和处理色谱数据的Chrom&Spec®软件包可实现对数据的采集、收集、处理和输出。
前处理步骤前处理步骤包括:取样和样品准备,毛细管调试,辅助和校准溶液的准备,CAPEL®毛细管电泳仪的校正。
测量步骤样品收集样品(静脉血)的收集必需按照临床要求。
执行标准条例获得血清。
样品准备分析前,血清必需用蒸馏水稀释(稀释比50:1),彻底搅拌并离心。
毛细管的调试每次清洗毛细管10分钟。
依次用浓硫酸,蒸馏水、氢氧化钠(1 mol/l),蒸馏水,缓冲液冲洗。
测量采用毛细管电泳法在CAPEL®-105毛细管电泳仪上使用日常惯例,分析预备溶液。
数据处理Chrom&Spec®软件输出一份白蛋白和球蛋白的含量(%)报告。
实例分析样品:人体血清(正常)缓冲剂:10 mM硼酸,5 mM SDS,pH 9.2 毛细管:L EFF/L TOTAL 50/60 cm,ID 75 μm 注射量:150 mbar*S电压:15kV测量:215 nm,直接。
大麦籽粒蛋白质组分含量测定
根据溶解度分类法,大麦籽粒中的蛋白质可分为四类:水溶性蛋白、盐溶性蛋白、醇溶蛋白和碱溶性蛋白。
根据其电泳迁移率和氨基酸组成,醇溶蛋白可分为四种,即B 醇溶蛋白、C 醇溶蛋白、D 醇溶蛋白和γ醇溶蛋白。
1.蛋白组分的提取
成熟籽粒在80℃烘箱中烘干至恒重,用样品粉碎机粉碎,过0.5mm 筛。
水溶蛋白:0.5g 样品加10mM Tris-HCl(pH7.5, 10ml)室温下置于连续振荡器上提取2 h ,离心(4000 g)10min ,连续提取两次,将得到的上清液混合保存。
盐溶蛋白:0.5g 样品加5ml 提取液1在室温下置于连续振荡器上提取1 h ,离心(1000 g ≈3900rpm)8min 。
醇溶蛋白:0.5g 样品加1.5ml 提取液2在60℃下置于连续振荡器上提取1 h ,离心(14000 rpm)10min 。
碱溶蛋白:0.2g 样品加10ml0.24%五水合硫酸铜,1.68%KOH ,0.5%酒石酸钾钠和50%(v/v)异丙醇提取显色液在室温下置于连续振荡器上提取1.5 h ,再在60o
C 恒温水浴震荡5min ,离心(4000g)10min ,550nm 比色测定。
提取液配置顺序参考后面的双缩脲试剂配制。
2.蛋白组分含量测定
清蛋白、球蛋白和醇溶蛋白含量利用考马斯亮蓝法以牛白蛋白做标准曲线测定,谷蛋白用Biuret法测定。
清蛋白,球蛋白,醇溶蛋白含量测定(考马斯亮兰法Bradford,1976):
(一)实验原理
1976年由Bradford建立的考马斯亮兰法(Bradford法),是根据蛋白质与染料相结合的原理设计的。
这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。
这一方法是目前灵敏度最高的蛋白质测定法。
考马斯亮兰G-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰由465nm变为595nm,溶液的颜色也由棕黑色变为蓝色。
经研究认为,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。
在595nm下测定的吸光度值A595,与蛋白质浓度成正比。
(二)操作方法
染色剂配制:考马斯亮蓝G-250(100mg)溶于50 ml 95%乙醇,加入100ml,85% (w/v)磷酸,稀释至1L。
最终浓度为: 0.01% (w/v)考马斯亮蓝G-250, 4.7% (w/v)乙醇, 8.5% (w/v)磷酸。
蛋白质含量测定:称取样品蛋白M1(10-100μg)用缓冲液稀释至0.1ml,移至12 x 100 mm 试管。
加入5ml以上染色剂。
摇匀后 2min-1h 时间内测595 nm波长下的吸光值(3ml比色皿)。
空白对照为0.1 ml缓冲液+5 ml染色剂。
样品蛋白质含量可以根据其吸光值在标准曲线上定位。
Bradford法的突出优点是:
(1)灵敏度高,据估计比Lowry法约高四倍,其最低蛋白质检测量可达1mg。
这是因为蛋白质与染料结合后产生的颜色变化很大,蛋白质-染料复合物有更高的消光系数,因而光吸收值随蛋白质浓度的变化比Lowry法要大的多。
(2)测定快速、简便,只需加一种试剂。
完成一个样品的测定,只需要5分钟左右。
由于染料与蛋白质结合的过程,大约只要2分钟即可完成,其颜色可以在1小时内保持稳定,且在5分钟至20分钟之间,颜色的稳定性最好。
因而完全不用像Lowry法那样费时和严格地控制时间。
(3)干扰物质少。
如干扰Lowry法的K+、Na+、Mg2+离子、Tris缓冲液、糖和蔗糖、甘油、巯基乙醇、EDTA等均不干扰此测定法。
此法的缺点是:
(1)由于各种蛋白质中的精氨酸和芳香族氨基酸的含量不同,因此Bradford法用于不同蛋白质测定时有较大的偏差,在制作标准曲线时通常选用g—球蛋白为标准蛋白质,以减少这方面的偏差。
(2)仍有一些物质干扰此法的测定,主要的干扰物质有:去污剂、Triton X-100、十二烷基硫酸钠(SDS)和0.1N的NaOH。
(如同0.1N的酸干扰Lowary法一样)。
(3)标准曲线也有轻微的非线性,因而不能用Beer定律进行计算,而只能用标准曲线来测定未知蛋白质的浓度。
谷蛋白测定(双缩脲法,Biuret法)
(一)实验原理
双缩脲(NH3CONHCONH3)是两个分子脲经180℃左右加热,放出一个分子氨后得到的产物。
在强碱性溶液中,双缩脲与CuSO4形成紫色络合物,称为双缩脲反应。
凡具有两个酰胺基或两个直接连接的肽键,或能过一个中间碳原子相连的肽键,这类化合物都有双缩脲反应。
紫色络合物颜色的深浅与蛋白质浓度成正比,而与蛋白质分子量及氨基酸成分无关,故可用来测定蛋白质含量。
测定范围为1-10mg蛋白质。
干扰这一测定的物质主要有:硫酸铵、Tris 缓冲液和某些氨基酸等。
此法的优点是较快速,不同的蛋白质产生颜色的深浅相近,以及干扰物质少。
主要的缺点是灵敏度差。
因此双缩脲法常用于需要快速,但并不需要十分精确的蛋白质测定。
(二)试剂与器材
1. 试剂:
(1)标准蛋白质溶液:用标准酪蛋白,配制成10mg/ml的标准蛋白溶液,如有需要,标准蛋白质还可预先用微量凯氏定氮法测定蛋白氮含量,计算出其纯度,再根据其纯度,称量配制成标准蛋白质溶液。
酪蛋白用0.05N NaOH配制。
(2)双缩脲试剂:称以1.50克硫酸铜(CuSO4•5H2O)和6.0克酒石酸钾钠(KNaC4H4O6•4H2O),用500毫升水溶解,在搅拌下加入300毫升10% NaOH溶液,用水稀释到1升,贮存于塑料瓶中(或内壁涂以石蜡的瓶中)。
此试剂可长期保存。
若贮存瓶中有黑色沉淀出现,则需要重新配制。
2. 器材:
可见光分光光度计、大试管15支、旋涡混合器等。
(三)操作方法
1. 标准曲线的测定:取12支试管分两组,分别加入0,0.2,0.4,0.6,0.8,1.0毫升的标准蛋白质溶液,用水补足到1毫升,然后加入4毫升双缩脲试剂。
充分摇匀后,在室温(20~25℃)下放置30分钟,于540nm处进行比色测定。
用未加蛋白质溶液的第一支试管作为空白对照液。
取两组测定的平均值,以蛋白质的含量为横座标,光吸收值为纵座标绘制标准曲线。
2、样品的测定:取2~3个试管,用上述同样的方法,测定未知样品的蛋白质浓度。
注意样品浓度不要超过10mg/ml。