硫及其氧化物一轮复习
- 格式:pptx
- 大小:608.07 KB
- 文档页数:26

考点一、硫及其氧化物的性质和应用一、硫单质(1)自然界中的硫①游离态:硫单质俗称硫黄,主要存在于火山喷口附近或地壳的岩层里。
②化合态:主要以硫化物和硫酸盐的形式存在,有关化学式如下表:硫铁矿 黄铜矿 石膏 芒硝 FeS 2CuFeS 2CaSO 4·2H 2ONa 2SO 4·10H 2O(2)物理性质颜色状态 溶解性黄色晶体不溶于水微溶于酒精易溶于CS 2(3)化学性质(反应用化学方程式表示)S -2――→氧化性S 0 ――→还原性S +4O 2①与金属反应⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫Cu :2Cu +S====△Cu 2S Fe :Fe +S====△FeS 表现氧化性②与非金属反应⎩⎪⎨⎪⎧O 2:S +O 2=====点燃SO 2,表现还原性H 2:S +H 2====△H 2S ,表现氧化性③与金属反应——表现氧化性。
S 与Fe 、Cu 、Hg 反应的化学方程式为:Fe +S=====△FeS ,2Cu +S=====△Cu 2S ,Hg +S===HgS 。
④与强氧化剂浓H 2SO 4反应——表现还原性。
第12讲 硫及其重要的化合物考纲要求:1.了解硫元素单质及其重要化合物的制备方法,掌握其主要性质及其应用。
2.了解硫元素单质及其重要化合物对环境的影响。
S +2H 2SO 4(浓)=====△3SO 2↑+2H 2O 。
⑤与碱反应——既表现氧化性,又表现还原性。
如:与NaOH 溶液反应的化学方程式为: 3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O 。
【易错警示】:二、二氧化硫1.SO 2的物理性质SO 2是一种无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(常温常压下,1体积的水大约能溶解40体积的SO 2)。
高中阶段需掌握的易液化的三种气体分别是SO 2、Cl 2、NH 3。
2.SO 2的化学性质①②将二氧化硫分别通入下列溶液中,把产生的现象与其体现的性质填入下表空格中:溶液 石蕊 试液加有酚酞 的氢氧化 钠溶液 KMnO 4酸 性溶液 溴水 品红溶液现象 变红 红色褪去 紫红色 褪去 溴水褪色 品红褪色SO 2 的性质溶于水 显酸性溶于水显 酸性还原性还原性 漂白性2223洗涤附着在试管内壁上的硫,可用CS 2或热强碱液洗涤。

硫及其氧化物一、选择题1.(2024·珠海模拟)下列关于SO2的叙述正确的是( )A.SO2是无色、无味、有毒的气体B.SO2不能使酸性高锰酸钾溶液褪色C.SO2的大量排放是形成酸雨的唯一原因D.SO2与NaOH溶液反应可能生成Na2SO3或NaHSO32.SO2属于大气污染物,可用H2与SO2在加热条件下反应消除SO2的污染,反应原理可分为两步,过程如下图所示。
下列说法正确的是( )A.SO2排放到空气中会形成pH≈5.6的酸雨B.可用CuSO4溶液检验是否有气体X生成C.在100~200 ℃时发生的是置换反应D.工业上可用浓硝酸处理尾气中的SO23.科学家通过研究揭示了大气中臭氧层被破坏的机理,如下图所示。
下列说法错误的是 ( )A.CFCl3是四面体结构B.过程Ⅲ中的O原子可能来自大气中O2或O3的解离C.整个过程中,CFCl3是O3分解的催化剂D.紫外线辐射提供破坏化学键的能量4.(2024·佛山高三质检)大约4000年前,埃及人会用硫燃烧产生的SO2来漂白布匹。
利用下列装置验证SO2的性质,下列有关说法不正确的是( )A.装置a中的反应体现了浓硫酸的强氧化性B.装置b中白色粉末变蓝C.品红和酸性KMnO4溶液褪色原理相同D.澄清石灰水变浑浊,气体产物中可能含SO25.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:下列说法正确的是 ( )A.分离器中的物质分离操作为过滤B.该工艺中I2和HI的相互转化体现了“碘循环”C.该工艺中HI的量没有改变,可视为该工艺的催化剂D.碘循环工艺的总反应为 2SO2+4H2O+I2===H2+2H2SO4+2HI6.科学家研究发现,水蒸气冷凝成直径小于10 μm(1 μm=10-6m)的水滴后会自发形成H2O2,揭示了世界上第一个O2分子可能来自H2O2的分解。
下列有关说法不正确的是 ( ) A.太阳光直射过10 μm大小的水滴会产生丁达尔现象B.“H2O―→H2O2”中氧元素被氧化C.每产生2.24 L O2(标准状况下)需分解6.8 g H2O2D.水蒸气冷凝生成H2O2是一种简单经济的绿色杀菌剂生产工艺7.(2024·东莞光正实验学校月考)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如图所示,实验中Y装置产生白色沉淀。

2025年高考化学一轮复习专题知识点归纳及训练—硫及其重要化合物(解析版)知识点01硫单质的性质及应用1.硫元素的存在形态游离态:火山口附近或地壳的岩层里;化合态:主要以硫化物和硫酸盐的性质存在。
2.硫的物理性质黄色或淡黄色固体;俗称硫黄,质脆,易研成粉末,密度比水大,难溶于水,微溶于酒精,易溶于CS 2。
3.硫的化学性质S -2←――――氧化性S 0――→还原性S+4(1)与非金属单质反应与氧气反应:S+O 2=====点燃SO 2与氢气反应:S+H 2=====△H 2S (2)与金属反应与钠反应:2Na+S===Na 2S 与铁反应:Fe+S=====△FeS 与铜反应:2Cu+S=====△Cu 2S 与汞反应:Hg+S===HgS应用:去除洒落的汞硫与变价金属反应生成低价态化合物(3)与NaOH 溶液反应:3S+6NaOH=====△2Na 2S+Na 2SO 3+3H 2O应用:清洗试管壁残留的硫(1)硫与Fe 反应生成FeS ,与Cu 反应生成CuS(×)错因:硫与变价金属反应时,生成低价态金属硫化物(如Cu 2S 、FeS)2。
(2)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理(√)(3)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(4)硫与少量的O 2反应生成SO 2,与过量的O 2反应生成SO 3(×)错因:硫燃烧只能生成SO 2,与O 2的量无关,SO 2与O 2反应生成SO 3,需要温度较高,且有催化剂存在才可以。
(5)实验室洗涤附着在试管内壁上的硫,可用酒精清洗(×)错因:硫微溶于酒精,易溶于CS2,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去。
1.硫和氯气的氧化性强弱比较方法(1)与变价金属反应,Cl 2与变价金属反应生成高价态化合物,S 与变价金属反应生成低价态化合物;(2)氢化物的稳定性:HCl >H 2S ;(3)置换反应:H 2S +Cl 2===2HCl +S↓;(4)最高价含氧酸的酸性:HClO 4>H 2SO 4;(5)还原性:S 2->Cl -。



硫及其化合物【考情分析】硫元素的多种价态及各种价态化合物的相互转化内容丰富,也是氧化还原反应的重要素材。
命题空间广阔,而且与生产、生活及社会联系紧密,高考中通过框图推断题、工业生产流程题、实验题等形式进行考查。
主要有以下几个重要考点:1、环境污染问题越来越受到人们的重视,因而以环保问题为载体考查SO2性质的试题应予以关注。
2、H2SO4是与生产、生活密切相关的物质,因而要理解、掌握H2SO4的性质,尤其是浓硫酸的特性及其应用。
从命题形式来看,1、硫酸一般不单独命题,而在选择题的选项出现或穿插在主观题中。
2、环境污染和防护与工农业联系紧密,又以硫和氮的氧化物知识为背景,既可以构成选择题的选项,又可以构成主观题。
【核心素养分析】1.变化观念与平衡思想:从硫的化合价变化认识硫及其化合物的相互转化及应用。
2.科学探究与创新意识:从不同的角度探究硫及其重要化合物的性质及制备实验方案,并进行实验操作验证。
3.科学态度与社会责任:关注与SO2有关的污染和环境保护,具有可持续发展意识和绿色化学观念。
【网络构建】【知识梳理】智能点一硫及其氧化物(一)硫单质的性质及应用1.硫元素的存在形态(1)游离态:在火山口附近或地壳的岩层例存在;(2)化合态:以硫化物和硫酸盐的形式存在。
2.硫单质的物理性质硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS2;有多种同素异形体,如单斜硫、斜方硫等。
3.从化合价的角度认识硫单质的化学性质H 2S -2←―――― 氧化性 S 0 ――→ 还原性 S +4O 2(1)S 的氧化性S 与Fe 、Cu 、Hg 反应的化学方程式依次为Fe +S FeS 、2Cu +SCu 2S 、S +Hg===HgS(此反应适用于除去室内洒落的Hg)。
(2)S 的还原性①S 与O 2反应的化学方程式为S +O 2=====点燃SO 2,在空气中燃烧火焰为淡蓝色。
②与强氧化剂反应(如浓硫酸)的化学方程式为 S +2H 2SO 4(浓)3SO 2↑+2H 2O 。
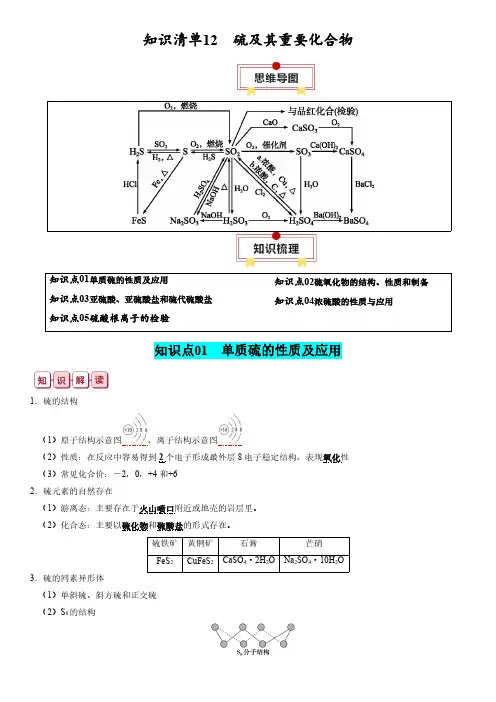
知识清单12硫及其重要化合物知识点01单质硫的性质及应用知识点03亚硫酸、亚硫酸盐和硫代硫酸盐知识点05硫酸根离子的检验知识点02硫氧化物的结构、性质和制备知识点04浓硫酸的性质与应用知识点01单质硫的性质及应用1.硫的结构(1)原子结构示意图,离子结构示意图(2)性质:在反应中容易得到2个电子形成最外层8电子稳定结构,表现氧化性(3)常见化合价:-2,0,+4和+62.硫元素的自然存在(1)游离态:主要存在于火山喷口附近或地壳的岩层里。
(2)化合态:主要以硫化物和硫酸盐的形式存在。
硫铁矿黄铜矿石膏芒硝FeS 2CuFeS 2CaSO 4·2H 2ONa 2SO 4·10H 2O3.硫的同素异形体(1)单斜硫、斜方硫和正交硫(2)S 8的结构①化学键/mol :8②S 原子的杂化方式:sp 3③分子极性:非极性分子4.硫单质物理性质(1)色、态:黄色或淡黄色的固体,俗称硫黄(2)溶解性:不溶于水,微溶于酒精,易溶于二硫化碳5.弱氧化性:Fe ------→S加热FeS ;Cu -----→S加热Cu 2S 6.燃烧反应(1)反应:S+O 2SO 2;S ---------→过量O 2点燃SO 2(2)氧气浓度不同,产物相同,现象不同①空气:产生微弱的淡蓝色火焰②氧气:产生明亮的蓝紫色火焰易错点:硫的易错知识点(1)单质硫燃烧时,产物只能是SO 2,无论O 2的量是否充足,均不会生成SO 3。
(2)硫单质的氧化性较弱,与变价金属反应时一般生成低价态金属硫化物(和Cl 2与变价金属的反应情况相反),如FeS 、Cu 2S 等。
(3)等量的硫在空气中完全燃烧比在氧气中完全燃烧放热多(光能少)(4)汞蒸气有毒,实验室里不慎洒落一些汞,可撒上硫粉进行处理。
(5)实验室中,残留在试管内壁上的硫可用CS 2溶解除去,也可用热的NaOH 溶液除去,反应化学方程式为3S+6NaOH2Na 2S+Na 2SO 3+3H 2O 。

考点12硫的化合物一、选择题1.下列关于硫及其化合物的说法不正确的是()。
A.自然界中存在游离态的硫B.二氧化硫的排放可能会导致酸雨的产生C.二氧化硫能使滴有酚酞溶液的氢氧化钠溶液褪色,体现了二氧化硫的漂白性D.浓硫酸可用来干燥SO2、CO、Cl2等气体答案:C解析:自然界中存在游离态的硫,如火山口附近就有单质硫,A项正确;过度排放二氧化硫会污染空气,形成酸雨,B项正确;二氧化硫能使滴有酚酞溶液的氢氧化钠溶液褪色,体现了SO2酸性氧化物的性质,与漂白性无关,C项错误;浓硫酸具有吸水性,可干燥SO2、CO、Cl2等气体,D项正确。
2.下列说法正确的是()。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊溶液褪色B.能使品红溶液褪色的不一定是SO2C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同D.SO2和Cl2混合使用,具有更强的漂白能力答案:B解析:SO2使溴水、酸性KMnO4溶液褪色是因为SO2具有还原性,能使品红溶液褪色是因为SO2具有漂白性,SO2不能使指示剂褪色,A项错误;能使品红溶液褪色的物质很多,B项正确;SO2的漂白属于化合型漂白,活性炭的漂白属于吸附型漂白,漂白粉、Na2O2的漂白属于氧化型漂白,这些漂白剂的漂白原理不相同,C项错误;等物质的量的SO2和Cl2在溶液中会发生反应生成H2SO4和HCl,而使漂白能力减弱,D项错误。
3.某同学按下图实验装置探究铜与浓硫酸的反应,记录实验现象如下,下列说法正确的是()。
A.②③中白色沉淀都是BaSO4B.实验开始时①中的黑色固体可能是CuOC.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡D.加热④中褪色后的溶液,溶液不变色答案:B解析:②中含有N O3-,在酸性条件下能把二氧化硫氧化成硫酸,S O42-与Ba2+结合生成白色沉淀BaSO4;③中二氧化硫与氨水反应生成S O32-,S O32-与Ba2+结合生成白色沉淀BaSO3,A项错误。



硫及其化合物一、单选题(本大题共16小题)1. 下列关于浓硫酸的叙述中,错误的是( )A. 浓硫酸滴在纸上使纸变黑,是由于浓硫酸有脱水性B. 稀释浓硫酸时,应将浓硫酸沿器壁慢慢注入水中,并不断用玻璃棒搅拌C. 欲除去NH3中的水蒸气,可将气体通过盛有浓硫酸的洗气瓶D. 不慎在皮肤上沾上少量浓硫酸时,应立即用大量水冲洗2. 下列说法正确的是( )A. 向HClO溶液中通入SO2,生成H2SO4,证明H2SO4的酸性比HClO强B. SO2、H2S为强还原性化合物,都不可用浓硫酸干燥C. 将SO2通入品红溶液,溶液褪色后加热恢复原色D. 蔗糖遇浓H2SO4后变黑,膨胀,最后产生刺激性气味气体,说明浓H2SO4具有酸性、氧化性和脱水性3. 下列物质性质与用途具有对应关系的是( )A. S的沸点低,可用于杀菌消毒B. SO2有氧化性,可用于漂白纸张C. 浓硫酸具有强酸性,可用于制备HCl气体D. BaSO不溶于盐酸且不被X射线透过,可用作钡餐44. 浓硫酸与下列物质作用时,既表现氧化性,又表现酸性的是( )①炽热的木炭②H2S气体③Cu(加热条件下)④FeO⑤NH3⑥蔗糖⑦CuSO4·5H2O⑧铁、铝(常温下)A. ③④B. ①②⑤⑧C. ①②③④⑦D. ⑥⑦5. 某同学在实验室选用如图实验装置,验证浓硫酸与碳反应的产物。
下列说法正确的是( )A. 浓硫酸与碳的反应中浓硫酸表现出酸性和强氧化性B. 正确连接顺序可能为I→Ⅳ→Ⅲ→ⅡC. 装置Ⅱ中酸性高锰酸钾溶液左右品红溶液的作用不相同D. 若连接顺序为I →Ⅱ→Ⅲ→Ⅳ,无法检验产物中有无CO 26. 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与结论相符的是( )A. AB. BC. CD.D7. 由下列实验操作及现象能得出相应结论的是( )A. AB. BC. CD. D8. 下列变化能用同一性质解释的有( )①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小;②二氧化硫和氯气均能使品红溶液褪色;③二氧化硫能使KMnO4溶液、溴水褪色;④氨气和碘化氢气体均不能用浓硫酸干燥;⑤常温下浓硫酸用铁制的容器存放、加热条件下浓硫酸能与木炭反应;⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字;⑦二氧化碳、二氧化硫使澄清石灰水变浑浊。
第19讲 硫及其氧化物[复习目标] 1.了解硫的存在及其单质的性质和用途。
2.掌握硫的氧化物的主要性质及应用。
3.了解空气中SO 2的测定及治理。
考点一 硫单质的性质1.硫元素的存在形态2.硫单质的物理性质俗称 颜色状态溶解性 水酒精 CS 2 硫黄黄色晶体难溶微溶易溶思考 (1)硫有S 2、S 4、S 6、S 8等多种单质,它们的关系是什么?加热时,S 8转化为S 6、S 4、S 2属于什么变化?(2)硫单质难溶于水,易溶于CS 2,其原因是什么?提示 (1)S 2、S 4、S 6、S 8属于同一元素的不同种单质,它们互为同素异形体,S 8转化为S 6、S 4、S 2属于化学变化。
(2)硫单质、CS 2均属于非极性分子,而H 2O 属于极性分子,根据“相似相溶”规律,非极性分子易溶于非极性分子形成的溶剂中。
3.从化合价的角度认识硫单质的化学性质S -2←―― 氧化性S 0 ――→还原性S +41.硫在空气中燃烧的产物是SO 2,在纯氧中燃烧的产物是SO 3( ) 2.硫与铁粉和铜粉分别反应,都可生成二价金属硫化物( ) 答案 1.× 2.×硫及多硫化物的性质1.在下列反应中硫元素只表现氧化性的是( ) A .2Al +3S=====△Al 2S 3B .S +2H 2SO 4(浓)=====△2H 2O +3SO 2↑ C .H 2S=====△H 2+SD .3S +6NaOH=====△2Na 2S +Na 2SO 3+3H 2O 答案 A解析 A 项,该反应中S 的化合价由0价变为-2价,S 只体现氧化性,正确;B 项,该反应中S 的化合价由0价、+6价变为+4价,S 体现还原性和氧化性,错误;C 项,该反应中S 的化合价由-2价变为0价,S 只体现还原性,错误;D 项,该反应中S 的化合价由0价变为-2价、+4价,S 体现氧化性和还原性,错误。
2.硫元素最常见和最稳定的一种同素异形体是黄色的正交α-型,1912年E.Beckmann 由硫在碘中的冰点降低法测得它含有S 8分子。
专题15 硫及其重要化合物1.化学与生活亲密相关,下列说法正确的是A.二氧化硫有毒,肯定不能用作食品添加剂B.二氧化硅有半导体性能,可用于制作光电池C.爆竹燃放过程中,硫燃烧干脆生成三氧化硫D.同位素示踪技术常用于医疗、考古及物质变更规律的探究【答案】D【解析】A.二氧化硫有还原作用,可消耗果蔬组织中的氧,可以抑制氧化酶的活性,从而抑制酶性褐变,有抗氧化作用,所以二氧化硫能作食品防腐剂,但不能超量,故A错误; B.Si可以作半导体材料,能制作光电池,二氧化硅是制作光导纤维原料,故B错误; C.硫在空气或氧气中燃烧只能生成二氧化硫,二氧化硫和氧气在催化剂作用下加热才能氧化生成三氧化硫,故C错误;D.同位素示踪法可以用来探讨一些化学反应的历程、医疗、考古及物质变更规律,故D正确。
2.Na2S2O5是常用的防腐剂和漂白剂。
可利用烟道气中的SO2生产Na2S2O5,其流程如下:下列说法正确的是A.上述制备过程所涉及的物质中只有一种酸性氧化物B.Na2S2O5作防腐剂和SO2作漂白剂时,均表现还原性C.上述流程中的Na2CO3饱和溶液和Na2CO3固体不行互换D.试验室模拟“结晶脱水”时用到的仪器只有蒸发皿、玻璃棒、烧杯、漏斗【答案】C【解析】A.上述制备过程所涉及的物质中有2种酸性氧化物——二氧化硫和二氧化碳,故A错误;B.SO2作漂白剂时,未发生氧化还原反应,没有表现还原性,故B错误;C.依据上述分析,上述流程中的Na2CO3饱和溶液和Na2CO3固体不行互换,否则得不到过饱和的NaHSO3溶液,故C正确;D.“结晶脱水”是加热固体分解,应当在坩埚中进行,故D错误。
3.下列关于浓硫酸的叙述正确的是( )A.浓硫酸具有吸水性,因而能使蔗糖炭化B.浓硫酸在常温下可快速与铜片反应放出二氧化硫气体C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体D.浓硫酸在常温下能够使铁、铝等金属钝化【答案】D【解析】A.浓硫酸具有脱水性,可使蔗糖炭化,故A错误;B.浓硫酸与铜的反应应在加热条件下进行,故B 错误;C.浓硫酸可与氨气反应生成硫酸铵,则不能用于干燥氨气,故C错误;D.浓硫酸具有强氧化性,在常温下可使铁、铝等金属在表面生成一层致密的氧化膜而钝化,故D正确.4.SO2是一种大气污染物,工业上可用NaClO碱性溶液汲取SO2。