新鲁科版2020版高考化学大一轮复习第8章物质在水溶液中的行为5第3节盐类的水解课件
- 格式:pdf
- 大小:10.07 MB
- 文档页数:67


新教材适用·高考化学第三节盐类的水解明考纲要求理主干脉络1.了解盐类水解的原理2.了解影响盐类水解的主要因素3.了解盐类水解的应用一、盐类的水解1.概念在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2.实质3.特点(1)可逆:是中和反应的逆反应。
(2)微弱:通常盐类水解程度很小,一般无沉淀析出,无气体放出。
(3)吸热:中和反应放热,水解反应吸热。
(4)符合化学平衡移动原理。
4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
填写下表(常温下):盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH 强酸强碱盐NaCl、KNO3不水解中性=7 NH4Cl、水解NH+4、Cu2+酸性<7强酸弱碱盐Cu(NO3)2弱酸强碱盐CH 3COONa 、Na 2CO 3水解CH 3COO -、CO 2-3碱性 >75.水解的离子方程式(1)一般来说,盐类水解的程度不大,应该用可逆号“”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如Cu 2++2H 2O Cu(OH)2+2H +; NH +4+H 2ONH 3·H 2O +H +。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式为CO 2-3+H 2OHCO -3+OH -、HCO -3+H 2OH 2CO 3+OH -。
(3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)3+3H +。
(4)水解分别是酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“===”、“↑”、“↓”等,如NaHCO 3溶液与AlCl 3溶液混合反应的离子方程式为Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
二、影响盐类水解的主要因素 1.内因形成盐的酸或碱越弱就越易发生水解。


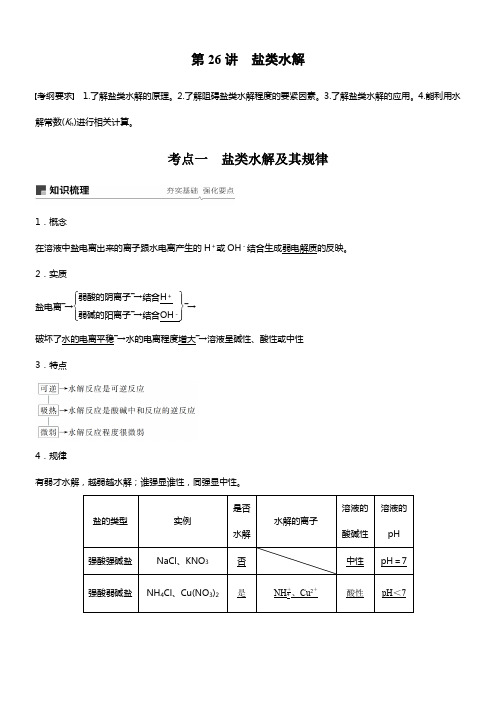
第26讲 盐类水解考纲要求 1.了解盐类水解的原理。
2.了解阻碍盐类水解程度的要紧因素。
3.了解盐类水解的应用。
4.能利用水解常数(K h )进行相关计算。
考点一 盐类水解及其规律1.概念在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反映。
2.实质盐电离―→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子―→结合H +弱碱的阳离子―→结合OH -―→ 破坏了水的电离平稳―→水的电离程度增大―→溶液呈碱性、酸性或中性 3.特点4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH 强酸强碱盐 NaCl 、KNO 3 否 中性pH =7强酸弱碱盐NH 4Cl 、Cu(NO 3)2是NH +4、Cu 2+酸性 pH <7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性pH>75.盐类水解离子方程式的书写要求(1)一样来讲,盐类水解的程度不大,应该用可逆号“”表示。
盐类水解一样可不能产生沉淀和气体,因此不用符号“↓”和“↑”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解别离显酸性和碱性的离子组由于彼此增进水解程度较大,书写时要用“===”“↑”“↓”等。
(1)溶液呈中性的盐必然是强酸、强碱生成的盐(×)(2)酸式盐溶液可能呈酸性,也可能呈碱性(√)(3)某盐溶液呈酸性,该盐必然发生了水解反映(×)(4)常温下,pH=10的CH3COONa溶液与pH=4的NH4Cl溶液,水的电离程度相同(√)(5)常温下,pH=11的CH3COONa溶液与pH=3的CH3COOH溶液,水的电离程度相同(×)(6)NaHCO3、NaHSO4都能增进水的电离(×)(7)向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成(×)(8)Na2CO3的水解:CO2-3+2H2O===H2CO3+2OH-(×)(9)FeCl3溶液与NaHCO3溶液混合:Fe3++3HCO-3===Fe(OH)3↓+3CO2↑(√)1.如何用最简单的方式区别NaCl溶液、氯化铵溶液和碳酸钠溶液?答案三种溶液各取少量别离滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化铵溶液,变蓝色的为碳酸钠溶液。

大一轮复习讲义第8章物质在水溶液中的行为考纲要求KAOGANGYAOQIU1.了解电解质的概念,了解强电解质和弱电解质的概念。
2.理解电解质在水中的电离以及电解质溶液的导电性。
3.理解弱电解质在水中的电离平衡,能利用电离平衡常数(K a、K b)进行相关计算。
内容索引NEIRONGSUOYIN考点一弱电解质的电离平衡考点二电离平衡常数考点三强酸(碱)与弱酸(碱)的比较探究高考明确考向课时作业01考点一弱电解质的电离平衡知识梳理ZHISHISHULI1.弱电解质(1)概念电解质全部电离强电解质,包括_____、_____、__________等部分电离弱电解质,包括_____、_____、___等在水溶液里(2)与化合物类型的关系强电解质主要是大部分_____化合物及某些_____化合物,弱电解质主要是某些_____化合物。
强酸强碱大多数盐弱酸弱碱水离子共价共价2.弱电解质的电离概念(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。
(2)电离平衡的建立与特征①开始时,v(电离)_____,而v(结合)为___。
②平衡的建立过程中,v(电离)___v(结合)。
= ≠最大0>3.外因对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,越易电离。
(2)温度:温度越高,电离程度越大。
(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。
(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
如:以0.1mol·L-1CHCOOH溶液为例,填写外界条件对CH3COOH CH3COO-3+H+ΔH>0的影响。
改变条件平衡移动方向n (H +)c (H +)导电能力K a 加水稀释向右________________________加入少量冰醋酸向右________________________通入HCl(g)向左________________________加NaOH(s)向右________________________加CH 3COONa(s)向左________________________加入镁粉向右________________________升高温度向右________________________增大减小减弱不变增大增大增强不变增大增大增强不变减小减小增强不变减小减小增强不变减小减小增强不变增大增大增强增大解析 由于OH -的浓度小于0.1 mol·L -1,所以BOH 应属于弱碱,其电离方程式应为BOHB ++OH -。