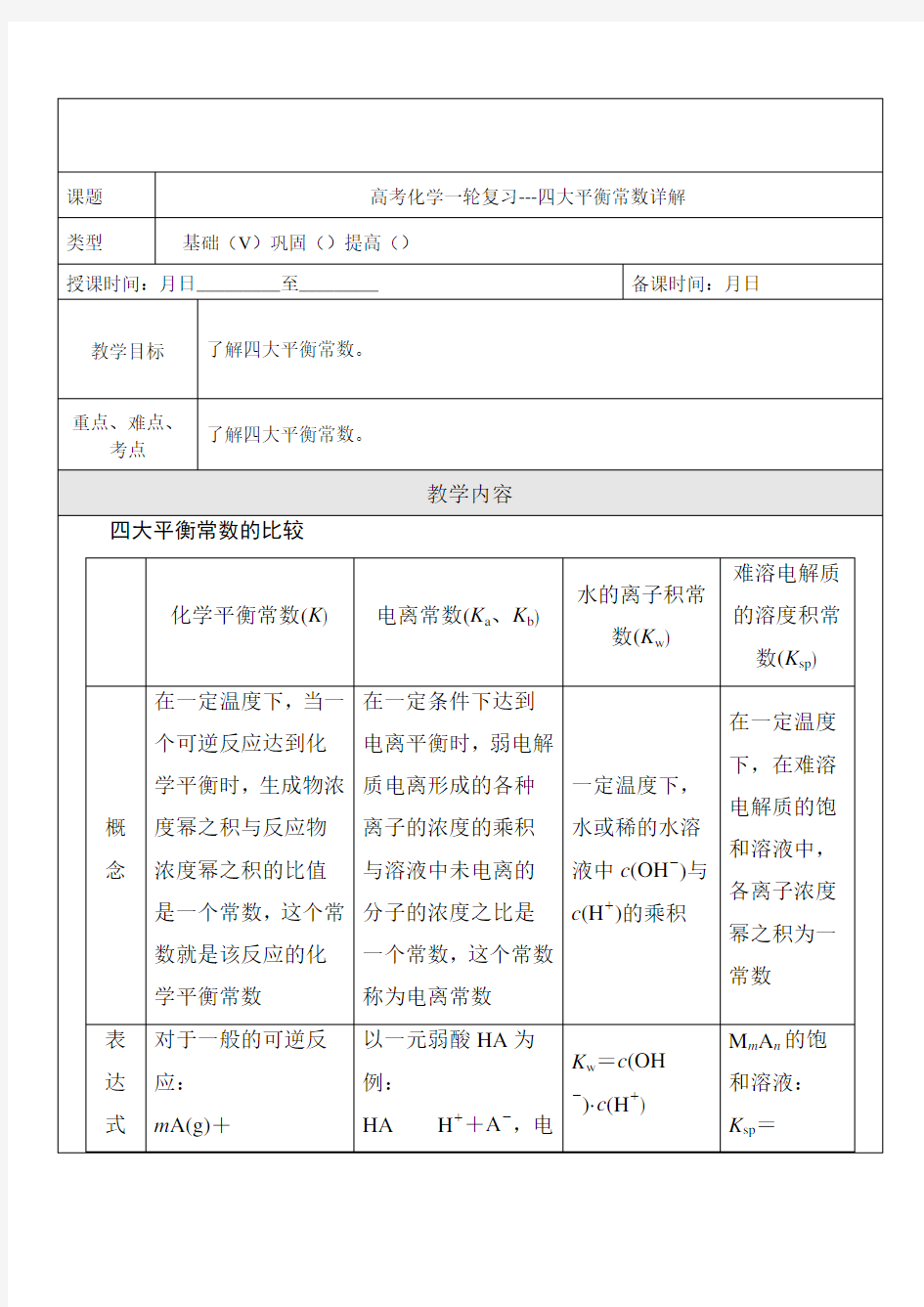
3、四大平衡常数详解
- 格式:doc
- 大小:158.50 KB
- 文档页数:17


以一元弱酸HA为例:
HA H++A-,电
n B(g)p C(g)+q D(g),
在一定温度下达到平衡时:
K=离常数
K a=
c m(M n)·c n(A
m-)
影
响因素
只与温度有关
只与温度有关,升高
温度,K值增大
只与温度有
关,升高温度,
K w增大
只与难溶电
解质的性质
和温度有关
考点一化学平衡常数
常考题
型
1.求解平衡常数;
2.由平衡常数计算初始(或平衡)浓度;
3.计算转化率(或产率);
4.应用平衡常数K判断平衡移动的方向(或放热、吸热等情
况)。
对策
从基础的地方入手,如速率计算、“三阶段式”的运用、阿
伏加德罗定律及其推论的应用、计算转化率等,这些都与化
学平衡常数密不可分(严格讲电离平衡、水解平衡、沉淀溶
解平衡也是化学平衡,只是在溶液中进行的特定类型的反应
而已),要在练习中多反思,提高应试能力。
1.高炉炼铁过程中发生的主要反应为Fe2O3(s)+CO(g)Fe(s)+CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃1000 1150 1300
平衡常
数
4.0 3.7 3.5
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________,CO的平衡转化率=________。
2.已知可逆反应:M(g)+N(g)P(g)+Q(g)ΔH>0,请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol/L,
c(N)=2.4mol/L;达到平衡后,M的转化率为60%,此时N的转化率为________。
(2)若反应温度升高,M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol/L,c(N)=a mol/L;达到平衡后,c(P)=2mol/L,a=________。
(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol/L,达到平衡后,M的转化率为________。
考点二电离常数
常考题型1.直接求电离平衡常数;
2.由电离平衡常数求弱酸(或弱碱)的浓度;3.由K a或K b求pH。
对策试题一般难度不大,是在化学平衡基础上派生出来的。注意平衡体系中同种离子的浓度是同一个浓度,当两个量相加或相减时,若相差100倍以上,要舍弃小的等一些基本的近似处理能力。
1.(2014·山东高考)已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中()
A.水的电离程度始终增大
A.1∶10B.9∶1
C.10∶1 D.99∶21
2.(2013·大纲卷)下图表示水中c(H+)和c(OH-)的关系,下列判断错误的是() A.两条曲线间任意点均有c(H+)×c(OH-)=K w
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
考点四难溶电解质的溶度积常数
常考题型1.溶解度与K sp的相关转化与比较;
2.沉淀先后的计算与判断;
3.沉淀转化相关计算;
4.金属阳离子沉淀完全的pH及沉淀分离的相关计算;5.与其他平衡(如氧化还原平衡、配位平衡)综合的计算;6.数形结合的相关计算等。
对策应用K sp数值大小比较物质的溶解度大小时,一定是在组成上属于同一类型的难溶电解质才能进行比较,否则,不能比较;在判断沉淀的生成或转化时,把离子浓度数值代入K sp表达式,若数值大于K sp,沉淀可生成或转化为相应难溶物质;利用K sp可计算某些沉淀转化反应的化学平衡常数。
1.(2015·常州模拟)已知25℃时,K a(HF)=6.0×10-4,K sp(MgF2)=5.0×10-11。现向1L0.2mol/LHF溶液中加入1L0.2mol/LMgCl2溶液。下列说法中正确的是() A.25℃时,0.1mol/LHF溶液中pH=1
B.0.2mol/LMgCl2溶液中离子浓度关系为2c(Mg2+)=c(Cl-)>c(H+)=c(OH-)
C.2HF(aq)+Mg2+(aq)MgF2(s)+2H+(aq),该反应的平衡常数K=1.2×107
D.该反应体系中有MgF2沉淀生成
2.常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:K sp(Ag2SO4)=7.7×10-5、K sp(AgCl)=1.8×10-10、K sp(AgI)=8.3×10-17。下列有关说法中,错误的是() A.常温下,Ag2SO4、AgCl、AgI在水中的溶解能力依次减弱
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
1.化学平衡常数(K)、弱酸的电离平衡常数(K a)、难溶物的溶度积常数(K sp)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是() A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数K a变小
C.K sp(AgCl)>K sp(AgI),由此可以判断AgCl(s)+I-(aq)===AgI(s)+Cl-(aq)能够发生
D.K a(HCN) ③Ag++2NH3Ag(NH3)(平衡常数为K3)。①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是() A.氯化银不溶于氨水B.银氨溶液中加入少量氯化钠有白色沉淀 C.银氨溶液中加入盐酸有白色沉淀D.银氨溶液可在酸性条件下稳定存在 3.T℃时,将6molA和8molB充入2L密闭容器中,发生反应:A(g)+3B(g)C(g)+D(g),容器中B的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,B的物质的量随时间的变化。下列说法正确的是()