蛋白质的泛素化降解总结
- 格式:pdf
- 大小:717.55 KB
- 文档页数:9


蛋白质降解中的泛素系统调控蛋白质降解是细胞中的一项重要代谢过程,对于维持细胞内环境的稳定性和平衡性发挥着关键作用。
泛素系统是其中一种重要的调控机制,负责识别、标记和降解具有异质性或损伤的蛋白质。
泛素系统是由三种主要酶类构成的:Ubiquitin-activating enzyme(E1)、Ubiquitin-conjugating enzyme(E2)、Ubiquitin ligase(E3)。
这些酶类的作用机制分别是:E1酶类在ATP的作用下首先将Ubiquitin结合到自身,然后将Ubiquitin转移给E2酶类,在E3酶类的帮助下通过缺陷蛋白的赋标(Ubiquitination)实现这个蛋白的特异性降解。
其中每一个环节都是必不可少的,也就是说,E1、E2和E3酶都对泛素系统的发挥有着至关重要的作用。
泛素系统在蛋白质降解过程中的作用是标记那些需要被降解的蛋白质,避免它们对细胞和机体整体的损害。
在这个过程中,泛素分子首先与目标蛋白发生共有基的结合,然后以特异性方式将目标蛋白质进行Ubiquitination标记,最终被送往蛋白酶体降解系统中完成降解。
这个过程中,泛素系统的发挥也对于许多其他的代谢途径产生了重要的影响,例如与细胞凋亡、细胞周期调控和热休克反应等等相关。
泛素系统在蛋白质降解中的作用机制并不是一成不变的。
事实上,机体中存在各种各样的泛素分子,它们在不同的条件下可能发挥着完全不同的作用。
例如,在基因突变或细胞环境恶化的情况下,泛素系统可能会失去一些关键的功能,从而导致蛋白质功能异常、许多常见疾病的出现和进展(例如肿瘤、神经退行性疾病等等)。
因此,在细胞和人类健康方面,对泛素系统的调控显得尤为重要。
值得注意的是,泛素系统对蛋白质降解中的调控可能不仅限于Ubiquitination标记这个基本机制。
在一些基因表达和调控的过程中,泛素系统也可能发挥着其他的功能,例如通过某些方式来影响对基因表达或生命活动的调控。
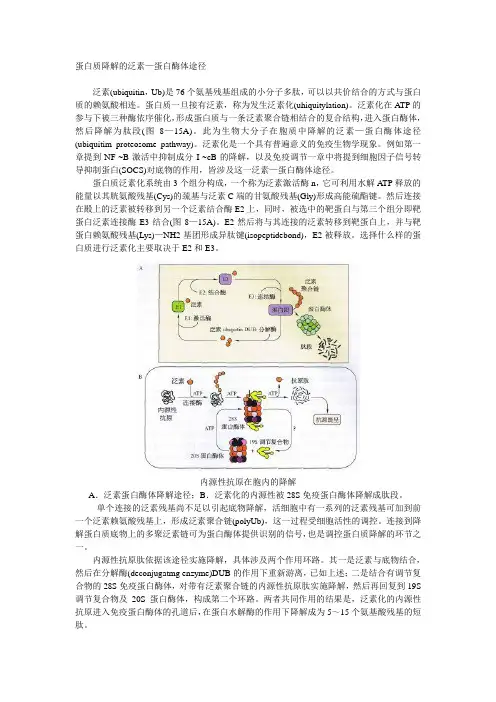
蛋白质降解的泛素—蛋白酶体途径泛素(ubiquitin,Ub)是76个氨基残基组成的小分子多肽,可以以共价结合的方式与蛋白质的赖氨酸相连。
蛋白质一旦接有泛素,称为发生泛素化(uhiquitylation)。
泛素化在A TP的参与下被三种酶依序催化,形成蛋白质与一条泛素聚合链相结合的复合结构,进入蛋白酶体,然后降解为肽段(图8—15A)。
此为生物大分子在胞质中降解的泛素—蛋白酶体途径(ubiquitim proteosome pathway)。
泛素化是一个具有普遍意义的免疫生物学现象。
例如第一章提到NF-~B激活中抑制成分I-~cB的降解,以及免疫调节一章中将提到细胞因子信号转导抑制蛋白(SOCS)对底物的作用,皆涉及这一泛素—蛋白酶体途径。
蛋白质泛素化系统由3个组分构成,一个称为泛素激活酶n,它可利用水解A TP释放的能量以其胱氨酸残基(Cys)的巯基与泛素C端的甘氨酸残基(Gly)形成高能硫酯键。
然后连接在殿上的泛素被转移到另一个泛素结合酶E2上,同时,被选中的靶蛋白与第三个组分即靶蛋白泛素连接酶E3结合(图8—15A)。
E2然后将与其连接的泛素转移到靶蛋白上,并与靶蛋白赖氨酸残基(Lys)—NH2基团形成异肽键(isopeptidebond),E2被释放。
选择什么样的蛋白质进行泛素化主要取决于E2和E3。
内源性抗原在胞内的降解A.泛素蛋白酶体降解途径;B.泛素化的内源性被28S免疫蛋白酶体降解成肽段。
单个连接的泛素残基尚不足以引起底物降解,活细胞中有一系列的泛素残基可加到前一个泛素赖氨酸残基上,形成泛素聚合链(polyUb),这一过程受细胞活性的调控。
连接到降解蛋白质底物上的多聚泛素链可为蛋白酶体提供识别的信号,也是调控蛋白质降解的环节之一。
内源性抗原肽依据该途径实施降解,具体涉及两个作用环路。
其一是泛素与底物结合,然后在分解酶(deconjugatmg enzyme)DUB的作用下重新游离,已如上述;二是结合有调节复合物的28S免疫蛋白酶体,对带有泛素聚合链的内源性抗原肽实施降解,然后再回复到19S 调节复合物及20S蛋白酶体,构成第二个环路。

蛋白质降解的机制与应用蛋白质降解是一种常见的生物化学过程,可以通过许多方式进行以满足不同的细胞需求。
在此过程中,蛋白质被分解成小分子的氨基酸,这些氨基酸可以再次被重组成彼此需要的蛋白质。
本文将关注蛋白质降解的机制及应用。
1. 蛋白质降解的机制蛋白质降解主要是通过两种机制进行的:泛素-蛋白酶体途径(UPS)和自噬途径。
1.1 UPS途径UPS是一种非常常见的方式,它包括两个过程:泛素化和蛋白酶体降解。
泛素化是通过连接泛素来标记蛋白质,使其变得“可降解”的过程。
泛素化过程需要特殊的酶和ATP的作用。
一旦标记,附带着泛素的蛋白会被输送到蛋白酶体内,然后被放入“降解序列”的核心中。
在这里,降解蛋白酶会将蛋白质降解为氨基酸,并释放出一些有用的材料,这些材料可供其他细胞部件使用。
1.2 自噬途径与UPS不同,自噬途径可以在缺乏氧气、营养不足或其他抗应激情况下发挥重要作用。
这种途径通常可以通过形成自噬小体来达成“蛋白质可降解”的状态。
自噬小体是由自噬泡和融合的内质网、线粒体、固醇体、蛋白质复合物等构成的双层膜结构中的中心部分,可维持阴离子和阳离子间的交互作用,从而形成裸露的“降解序列”。
通过降低降解序列中的pH值,细胞可将蛋白质降解为小分子的氨基酸。
2. 蛋白质降解的应用2.1 治疗疾病蛋白质降解对于治疗某些疾病可能非常重要。
例如,不良蛋白质的存在是导致多种神经退行性疾病的主要因素之一;此外,在肥胖症、糖尿病、多发性硬化、红斑狼疮和肝病等疾病中,蛋白质的过量沉积也被看作是一种重要的细胞伤害因素。
因此,通过研究蛋白质降解机制,可以为治疗这些疾病提供新的思路。
2.2 蛋白质药物蛋白质药物是一类越来越受欢迎的治疗药物,许多蛋白质药物涉及降解途径。
例如,利用时间-转录的分析技术,已经确定了某些特定药物的治疗作用,而这种作用主要是通过促进UPS途径的蛋白酶体活性来实现的。
同时,自噬还被证明对有关疾病的药物治疗也可能有贡献,例如利用自噬去除蛋白质残留物,在某些疾病中具有显著的治疗效果。

泛素化蛋白酶体降解途径名词解释1. 什么是泛素化蛋白酶体降解途径?嘿,大家好!今天咱们聊聊一个生物学里的大腕——泛素化蛋白酶体降解途径。
这听起来是不是很高大上?其实它的意思就是细胞怎么处理那些“老旧、过期”的蛋白质,换句话说,就是细胞里的“清理工”工作。
咱们都知道,细胞里有许多重要的成分,其中蛋白质就是一个关键角色。
它们像建筑工人一样,负责维持细胞的运转,干各种活儿。
但是,有时候这些蛋白质也会“老化”,就像旧车一样,不能再继续工作了。
这时候,细胞就得动手,把它们处理掉。
哎,没错,这就是泛素化蛋白酶体降解途径要干的事情。
2. 泛素化的过程2.1 泛素的角色首先,咱们得认识一个小家伙——泛素(ubiquitin)。
这个家伙可是个小明星,体积不大,但功能强大。
它就像一个小标签,专门给那些“过期蛋白”贴上标记,让其他细胞知道这些蛋白得退休了。
想象一下,一个工人到了退休年龄,身上得贴个标签,告诉大家“我该回家了”。
泛素就是这么干的,它会和目标蛋白结合,把这个标签贴上去。
2.2 蛋白质的降解接着,带着这个标签的蛋白质就会被送往蛋白酶体,这个地方可以说是细胞的“垃圾处理中心”。
在这里,泛素就像个调度员,把那些过期的蛋白质送进“销毁车间”。
一旦进了这个车间,蛋白质就会被切割成小碎片,彻底清理掉。
这个过程可不是一蹴而就的,得经历一些复杂的步骤,但最终,细胞会把这些废料处理掉,保持内部环境的整洁。
3. 这个过程的重要性3.1 维持细胞健康那么,为什么泛素化蛋白酶体降解途径如此重要呢?其实,这个过程就像是细胞的清洁工,保持着细胞内部的“卫生”。
想象一下,如果细胞里堆满了“过期蛋白”,那就像一个杂乱的办公室,根本没法正常工作。
所以,这个清理工作对细胞的健康至关重要。
3.2 疾病与老化此外,如果这个清理系统出了问题,就可能导致一些疾病,甚至加速衰老。
比如,有些神经退行性疾病就和这个过程有关。
想象一下,一个人年纪大了,家里东西堆得满满的,没法找到需要的东西,最终就会乱成一团。

泛素化降解的名词解释泛素化降解是细胞内一种重要的降解通路,它在维持细胞内蛋白质稳态以及调节许多生物学过程中发挥着关键的作用。
本文将对泛素化降解进行名词解释,并探讨其机制、调节因子以及在相关疾病中的作用。
泛素化降解最初由以色列科学家阿伦·赫希科维茨发现,并因此获得了2014年诺贝尔化学奖。
这一过程通过泛素(ubiquitin)蛋白的共价结合来标记需要降解的蛋白质。
泛素是一种由76个氨基酸组成的小蛋白质,它通过与目标蛋白质形成酯或胺结合的方式发挥作用。
泛素化降解的过程涉及到三个主要步骤:泛素激活、泛素连接和降解。
首先,泛素会与泛素激活酶结合,形成一个泛素-酶复合物。
这个复合物会将泛素激活为泛素腺苷酸二聚体,并将其与泛素结合酶一起转移到目标蛋白质上。
接下来,泛素连接酶会将泛素从泛素激活酶转移至目标蛋白质上,形成泛素链。
泛素链的形成方式决定了目标蛋白质的降解方式。
最后,泛素化目标蛋白质会被送往蛋白骨架复合物,并经过蛋白骨架复合物介导的降解途径被降解。
泛素化降解的调节因子对于其正常运行起着重要的调控作用。
其中,泛素连接酶族(E3酶)是指导具体目标蛋白质与泛素连接的关键因子。
E3酶可分为两大类:一个是对特定目标蛋白质具有高度选择性的E3酶家族,另一个是对多种目标蛋白质起催化作用的RBR(RING-between-RING)超家族。
这些E3酶能识别目标蛋白质的特定结构域,并与之相互作用,导致泛素与目标蛋白质结合。
泛素化降解在许多生物学过程中发挥着重要的作用。
首先,它对于维持细胞内蛋白质稳态至关重要。
蛋白质的合成和降解存在着动态平衡。
泛素化降解通过及时清除运行异常或不再需要的蛋白质,确保细胞内蛋白质的适当水平。
其次,泛素化降解还参与了细胞生命周期的调节、DNA损伤修复、信号通路的调控以及细胞凋亡等许多生物学过程。
除了在正常生理过程中的作用外,泛素化降解还在一些疾病的发生和发展中扮演重要角色。
例如,糖尿病、神经退行性疾病、心血管疾病以及癌症等都与泛素化降解的异常调节有关。





细胞内蛋白质降解途径细胞内蛋白质降解途径是维持细胞内蛋白质稳态的重要过程。
细胞内蛋白质在其生命周期内会经历合成、折叠、功能发挥和降解等多个环节,其中降解是维持细胞内蛋白质稳态的关键环节。
本文将介绍细胞内蛋白质降解的三个主要途径:泛素-蛋白酶体途径、泛素-溶酶体途径和自噬途径,并探讨它们在维持细胞内蛋白质稳态中的作用和调控机制。
一、泛素-蛋白酶体途径泛素-蛋白酶体途径是细胞内最主要的蛋白质降解途径之一。
该途径主要通过降解已被泛素化的蛋白质。
泛素是一种小分子蛋白质,可以通过泛素激活酶、泛素结合酶和泛素连接酶的协同作用与目标蛋白质结合,形成泛素化的复合物。
这些泛素化的蛋白质复合物会被蛋白酶体识别并降解。
蛋白酶体是一种含有多种蛋白酶的细胞器,能够降解具有不同结构和功能的泛素化蛋白质。
这种途径在调控细胞周期、应激反应和免疫应答等生理过程中起到重要作用。
二、泛素-溶酶体途径泛素-溶酶体途径是另一种重要的蛋白质降解途径。
与泛素-蛋白酶体途径不同,该途径主要通过降解溶酶体中的蛋白质来维持细胞内蛋白质稳态。
在这个过程中,目标蛋白质被泛素化,并通过蛋白质糖基化修饰与溶酶体膜相结合,形成泛素化的溶酶体。
这些泛素化的溶酶体会进一步与内质网相关蛋白质一起进入溶酶体内部,并被溶酶体中的酸性酶降解。
泛素-溶酶体途径在细胞内维持蛋白质质量控制和细胞应激反应中发挥重要作用。
三、自噬途径自噬途径是一种通过溶酶体降解细胞内器官、蛋白质聚集体和异常蛋白质等的过程。
自噬途径主要通过形成自噬体来实现降解目标物质。
自噬体是由自噬囊膜包裹的膜囊结构,它能够将目标物质包裹并输送到溶酶体内部进行降解。
自噬途径在细胞发育、维持细胞内营养平衡和清除异常蛋白质等方面发挥重要作用。
此外,自噬途径还与多种疾病的发生和发展密切相关,如癌症、神经退行性疾病等。
细胞内蛋白质降解途径的调控机制非常复杂。
泛素-蛋白酶体途径和泛素-溶酶体途径都需要泛素连接酶家族的参与,而自噬途径则需要自噬相关基因的参与。
蛋白质降解的生物化学机制蛋白质是生物体内的重要分子,它们在维持生命活动过程中起着重要的作用。
然而,随着时间的推移,蛋白质会逐渐老化或受到外界条件的影响而失去功能,需要被降解和清除。
蛋白质的降解是细胞内的一个关键过程,它由一系列生物化学机制调控。
一、泛素-蛋白酶体系统泛素-蛋白酶体系统是蛋白质降解中最常见的途径之一。
在这个系统中,蛋白质的降解是通过一系列酶的协作完成的。
首先,目标蛋白质上的泛素分子被连接到蛋白质上,这个过程称为泛素化。
泛素化是由泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)协同完成的。
泛素连接到蛋白质上后,蛋白质被识别并被泛素连接酶(E3)转移到蛋白酶体内,随后,在蛋白酶体中,蛋白质被泛素连接酶(E3)的作用下被泛素连接酶(E1)和泛素连接酶(E2)协同降解为小肽片段。
二、蛋白酶介导的降解途径蛋白酶介导的降解途径是通过蛋白酶的活性直接降解蛋白质。
蛋白酶是一类具有特定降解蛋白质功能的酶,它能够识别特定的肽链并将其切割成较短的片段。
在这个过程中,蛋白质的三维结构发生改变,导致其失去功能并容易被蛋白酶降解。
三、自噬途径自噬是一种特殊的蛋白质降解途径,它通过细胞内的溶酶体系统将细胞内的老化或损坏的蛋白质、细胞器和其他的宏分子降解掉。
自噬通过分泌液泡来识别和包裹目标物质,随后包裹体与溶酶体融合,被消化酶降解,释放出氨基酸和其他营养物质,供细胞再利用。
四、选择性蛋白质降解途径除了以上三种主要的降解途径外,还存在一些选择性的蛋白质降解途径。
这些途径通常用于特定类型的蛋白质,如细胞周期蛋白,转录因子等特定功能蛋白质的降解。
在这些途径中,特定的酶或蛋白通过特定机制将目标蛋白质降解为较短的片段,以维持细胞中的正常功能和代谢活动。
综上所述,蛋白质降解是细胞内一系列生物化学机制的共同作用结果。
泛素-蛋白酶体系统、蛋白酶介导的降解途径、自噬和选择性蛋白质降解途径等都在不同程度上参与了蛋白质的降解和清除。
仅作参考,如有抄袭,依法追究目录:1.研究背景2.泛素化降解途径2.1泛素的基本结构2.2泛素化的过程2.3 E3酶对蛋白底物的识别2.4 蛋白底物在26S蛋白酶体中的降解3.研究的意义以及应用4.研究展望真核生物细胞中的蛋白质泛素化降解摘要:蛋白质是执行生命活动的基本分子,细胞中的蛋白质不断地处于合成、修饰与降解的代谢更新过程中。
保持细胞正常的蛋白质代谢对于生命的正常功能至关重要。
目前所知蛋白质的降解主要通过两种途径:溶酶体降解途径和泛素介导的蛋白酶体降解途径。
溶酶体降解途径是一个非选择的蛋白质降解途径,主要降解通过摄粒作用或胞饮作用进入细胞内的外源蛋白质;而泛素介导的途径是一个受到严格的时空调控的特异性蛋白质降解途径。
泛素系统广泛存在于真核生物中,是精细的特异性的蛋白质降解体系。
泛素是一种序列保守的小分子蛋白质,蛋白质与泛素结合后,被蛋白酶体通过消耗ATP的方式降解。
泛素系统由泛素、26S 蛋白酶体、多种酶(E1、E2、E3去泛素酶等)组成。
其中E1和E2被称为泛素活化酶和泛素载体酶。
泛素连接酶E3负责连接泛素与特异性底物,这样泛素化底物可以被26S蛋白酶体降解为若干肽段。
泛素系统在真核生物中有非常重要的作用,通过降解蛋白质,调节细胞的分化、免疫,参与转录、分泌调控和细胞形成等,与人类的某些疾病有关。
本文就泛素系统的组成、调控机制和研究进展做一介绍。
关键字:泛素系统;E3;26S蛋白酶体正文:1.研究背景蛋白质在细胞内的降解是一个复杂的过程,但是又是一个高度有序的过程。
真核生物中蛋白质的降解绝大多数都是由泛素系统完成。
蛋白质首先是由泛素分子所特异性识别结合,在泛素分子的介导下,由泛素活化酶E1、泛素载体蛋白E2以及泛素连接酶E3特异性作用,与26S蛋白酶体作用,被切割成多肽。
多聚泛素链可以还原成单体,循环使用。
泛素与细胞的多种生命活动有关,例如细胞生长发育过程中组织抑制因子的选择性降解;细胞周期中,周期蛋白选择性降解等。
许多疾病和泛素化的过程有关,利用泛素系统治疗疾病也成为了热点。
2.泛素蛋白酶系统2.1泛素的基本结构泛素是一种热稳定性蛋白,含有76个氨基酸,相对分子质量8.6kDa。
结构保守,如图一是人和酵母细胞中泛素分子序列比对,我们可以看到,只有三个氨基酸的差别。
图一人和酵母的泛素分子序列比对如图二,泛素分子是一个球形结构,包括4个β片层和1个α螺旋。
共形成三个转角。
图二泛素分子的结构由于泛素基因有两种不同的存在形式,所以泛素的合成有两种不同的途径:一种是泛素基因结合到核糖体蛋白基因上,编码融合蛋白,融合蛋白合成后,由泛素C末端水解酶切掉融合蛋白;另一种是重复基因编码出线性泛素分子链,形成多聚泛素分子。
多个泛素单元可与底物蛋白结合成泛素多聚连,各个单体之间链接主要是48位的赖氨酸(Lys48)。
2.2泛素化的过程图三Ubiquitin-proteasome system (UPS)泛素的活化过程:泛素通过E1和E2被激活的过程。
如图三和图四,泛素活化酶(E1)催化泛素C端的甘氨酸(Gly)形成泛素-腺苷酸中间产物,然后激活的泛素C末端被转移到E1酶内的Cys残基的-SH键上,形成高能硫酯键;含有高能硫酯键的泛素通过转酰基的作用使其进一步转移到泛素载体蛋白E2特异的Cys残基上,形成E2-泛素巯基键;E2-泛素巯基键提供泛素分子,使泛素C端甘氨酸与底物蛋白的Lys残基形成共价键,由第一个泛素单体与底物蛋白内部的Lys残基上的氨基结合;泛素可直接从E2转移给底物蛋白形成泛素蛋白复合体,这些蛋白一般都是碱性蛋白(如组蛋白),而大多数情况下,底物蛋白首先与泛素连接酶E3特异性结合,E3可使E2和底物蛋白相接近,继而蛋白底物与E2链接的泛素相结合,完成底物蛋白的泛素化。
这一步依赖于E3与底物蛋白的特异性结合。
图四泛素的激活过程以及蛋白质的泛素化2.3 E3酶对蛋白底物的识别蛋白质在降解之前需要泛素化,在这个过程E3起着关键作用。
在E3蛋白家族中,有不同的几个亚型:N末端规则家族、HECT家族、Ring finger家族、U-box 家族这几大类。
①N末端规则家族中典型的代表是E3α,相对分子质量为200kDa,它能够结合到蛋白质特异性残基上;它也能够识别E2,便于活化的泛素转移到底物蛋白。
②HECT家族是在研究病毒HPV时发现的。
它的原始型E6-AP能够和HPV编码的E6蛋白相结合,进而与肿瘤抑制蛋白P53相结合,导致P53的泛素化和降解。
E6-AP结合到E6上,参与tTERT启动子的反式激活。
HECT型E3的N端含有转移泛素的胱氨酸残基。
通过蛋白质-蛋白质相互作用motif,转移底物到泛素上。
对HECT型E3的研究发现,有些E3能够作用于多种不同的底物蛋白,说明E3可通过其他辅助因子的作用取得底物特异性。
③Ring finger家族结构含有8个半胱氨酸和组氨酸的保守结构:Cys-X2-Cys-X(9~39)-Cys-X(1~3)-His-X(2,3)-Cys-X2-Cys-X(4~48)-Cys-X2-Cys(X代表任意一种残基)这一序列结合两个锌离子可以形成环指结构,常见的环指类E3有SCF复合体、VHL-CBC复合体和APC复合体。
④酵母的研究中发现了一种新的酶E4,作为一种泛素链聚集因子,在底物泛素化中,对多聚链的延长有重要作用。
在人类中存在着E4酶的同源物,他们有共同的U-box区域,因此这类蛋白称为U-box蛋白。
在哺乳动物中有六种。
他们不具有环指结构,不具备锌离子结合区域。
图五Ring finger结构和U-box结构的比较E3对底物的选择机制有如下几种:①蛋白质本身有特殊序列可被E3识别,例如具有N末端原则的蛋白可以被E3α亚型识别。
②某些底物蛋白经翻译后修饰可被E3识别,例如I k Bα经磷酸化后可被SCF复合体识别。
③E3或复合体的某些成分经翻译后修饰可被活化,例如APC亚型被磷酸化后可以识别有丝分裂的细胞周期蛋白。
④一些蛋白与辅助蛋白结合后可被识别,例如P53与辅助蛋白Hscp结合后被HECP亚型E3识别。
2.4 蛋白底物在26S蛋白酶体中的降解在蛋白质底物泛素化之后,随即进行泛素-蛋白质复合体被26S蛋白酶体降解,释放泛素单体进行循环。
图六26S蛋白酶体结构如图六,26S蛋白酶体中,中部20S蛋白酶体中心为桶装外形,由内层2个β环和外层2个α环组成,每个环含有7个亚基,组成α7β7β7α7结构。
Α亚基作用是底物的识别,β亚基作用是负责底物的降解。
不同的物种不同的生理状态下,20S蛋白酶体活性强度不等。
20S蛋白酶体活性调解因子主要有两种:19S调节复合体(PA700)和11S(PA26)调节复合体。
调节复合体位于20S的两端,与α环一端相邻。
两种不同的调节复合体与20S蛋白酶体结合后,进入不同的代谢途径:20S-19S主要是参与蛋白质的降解;20S-PA28负责抗原提呈(将抗原加工处理、降解成多肽)此外在泛素系统中存在能够特异性切割泛素链C端的去泛素酶,包括泛素C 端水解酶(UCHs)和USP(ubiquitin-specific protease)家族。
UCH-13这一类酶的分析得到,酶中心部位由反向平行的β片层和两侧α螺旋组成,结构和含有巯基组织蛋白酶B相似。
在未结合泛素时,活性位点分成两个部分避免非特异性降解;当结合到泛素时,发生构象的改变,对泛素链进行切割。
USP和UCH相比结构更加复杂,有一个中心催化区域,其N端或者C端能够特异性识别底物蛋白。
DUB促进泛素分子再循环,是泛素系统的重要组成部分。
3.研究的意义与应用泛素蛋白酶体体系在在真核生物细胞中有非常重要的作用,此途径的底物也非常广泛,例如细胞周期蛋白、肿瘤抑制因子和转录因子。
如果泛素代谢途径出现异常,会导致多种疾病的产生,例如安吉尔曼综合征。
安吉尔曼综合征是由于E6-AP蛋白酶功能异常(或者是缺少编码这个蛋白的基因)造成的。
不仅如此,心脑血管疾病的研究中,泛素参与了循环系统的代谢过程。
除此之外,泛素-蛋白酶体一个重要的应用就是是作为重要的靶标。
蛋白酶体的抑制剂Velcade已经用于临床肿瘤治疗,每年全球的销售额约10亿美元,这一数字到2015年将达到20亿美元;由于泛素连接酶的底物特异性明显优于蛋白酶体,药物设计策略正在从靶向蛋白酶体向靶向泛素连接酶转移,泛素连接酶的功能与调控研究已经成为生命科学领域的前沿热点。
从药物研发的角度看,泛素化体系非常有前景,这是一个金矿,大量的资源还没有开采,Velcade这一个药在美国每年销售就有14个亿,所以这个方向的研究非常有价值。
图七泛素-蛋白酶体系统作为靶标骨质疏松是老年人常见的一种疾病,研究骨形成表明,CKIP-1在骨形成中非常重要一个新的骨形成负调控分子,CKIP-1在骨组织的表达随年龄增长而上升。
通过RNAi技术敲降CKIP-1的表达,促进骨形成来治疗骨质疏松症。
设计筛选得到的si-3可在人、恒河猴、大鼠、小鼠细胞中最为有效的干扰CKIP-1基因的表达。
建立了DSS6寡肽与Liposome融合的siRNA运载系统,DSS6-Liposome运载系统特异识别成骨细胞。
DSS6-脂质体-CKIP-1 siRNA有效提升大鼠骨量,促进骨形成,但不影响骨吸收,有效治疗卵巢切除诱导的骨质疏松症。
siRNA递送系统是迄今最特异的成骨靶向系统,将为骨质疏松治疗开辟新途径。
张令强教授团队找到了调控骨形成的重要分子,通过RNA干扰技术可有效刺激骨形成,重新注入新的骨量,从而从源头上解决了骨质疏松治疗的瓶颈问题。
图八蛋白质泛素化与常见人类疾病关系图张令强教授团队在泛素化、类泛素化与肿瘤、骨质疏松症的发生机理与治疗研究领域有很大的成果,揭示了泛素连接酶与去泛素化酶的重要功能及调控机制为骨松和肿瘤的防治提供了重要的科学依据与技术创新。
4.研究展望泛素化修饰自20世纪70-80年代发现以来,已经被证实是介导真核细胞内蛋白质降解的最主要的途径,它在调控蛋白质稳定性、活性及亚细胞定位等方面具有非常重要的作用,从低等到高等生物,这一修饰体系均广泛存在、很多酶类保守存在,在进化中具有重要的生物学功能。
2004年诺贝尔化学奖授予了泛素化降解的三位发现者,就是学术界对这一修饰类型重要性的最好的认可。
泛素化修饰降解的异常与包括肿瘤、神经退行性疾病、自身免疫病、骨质疏松症等人类疾病的发生发展密切相关。
但是从基础研究角度看,目前大量的E3、DUB还不清楚底物是什么、生理功能是什么,也不是很清楚它们与哪些疾病有关系。
另外泛素系统在调节生命活动的同时,自身又会受到那些因素的调控现在也不得而知。
由于整个泛素化、类泛素化系统的相关基因所占全基因组的比例接近5%,其工作量很大,对于这一领域的重视与投资显得尤为重要。