4-6 共价键
- 格式:ppt
- 大小:2.08 MB
- 文档页数:58



第一章 有机化合物分子结构基础习题1-1H:Cl(2)H:O:N::O(3)H:N:N:H H H (1)O::C::O Cl:C:ClO(4)(5)Na(6)+(7)(8)(9)H:C:C:O:H H H H H H:C:C::O:HH H H:C: :OO:H(10)(11)H:C:C H H(12)NH:N:C::O:H H习题1-3C C H H HO Cl :::::(1)(2)C C HH H C O ::::H H (3)H C N N H三价三价正确N 原子应带电荷更改为:C H H H O ::::(1)(2)C C HH H C O ::::H HH (3)H N N HCl ::::(4)(5)(6)C O HH H H H O ::C OH H::::O 原子应带电荷C 原子应带电荷O 原子应带电荷更改为::::(4)(5)(6)C O HH HH C HN O ::C N OH H::::习题1-3(1)CH 3CHCH 2CH 2CH 2Cl(2)CH 3CHCH 2CH 2CHCH 3OH OCH 3ClBrOHOCH 3(3)C CH 3H 3C CH 3CH 2CH 2Cl(4)(CH 3)2NCH 2CH 2CH 3N(5)CH 3CH 2COCH 3(6)(CH 3)2CHCH 2CHOH OO习题1-4(1)可以,因为轨道可以有效重叠成键,如下图(a );(2)不可以,因为轨道间不是同位相相加,故不能有效重叠成键,如下图(b )和(c )。
(a)(b)(c)习题1-5*(1)因为反键分子轨道上有一个电子,只具有相对稳定性;(2)因为成键与反键分子轨道都全部充满电子,体系能量没有有效降低,所以不能稳定存在; (3)两个氮原子的2p 轨道各有3个单电子,它们相互结合形成三个成键轨道和三个反键轨道,而6个电子将在成对地填充在三个成键轨道上,所以N 2分子可以稳定存在;(4)O 2-可以看成是1个O (4个2p 电子)与1个O -(5个2p 电子)结合而成,各自的3个2p 轨道组成3个成键和3个反键轨道,9个电子在成对填充满3个成键轨道后,还有3个电子在反键轨道,因此,该负离子具有相对稳定性。
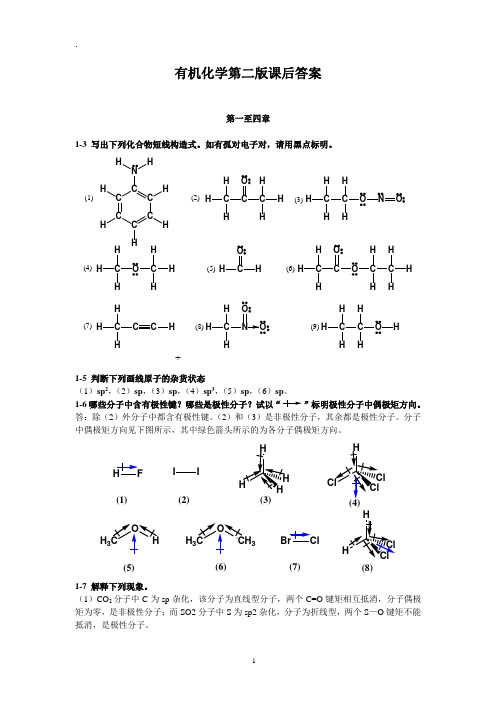
有机化学第二版课后答案第一至四章1-3 写出下列化合物短线构造式。
如有孤对电子对,请用黑点标明。
÷C C CC C CNHHH H H HC CH HHC O H HHHC H HC H HONH C HH OC H HHHHHC HHCO OCC H HH HHHC HHCCHH C HHNOOHC H HC H HOH(1)(2)(3)(4)(5)(6)(7)(8)(9)1-5 判断下列画线原子的杂货状态 (1)sp 2,(2)sp ,(3)sp ,(4)sp 3,(5)sp ,(6)sp 。
1-6哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极矩方向。
答:除(2)外分子中都含有极性键。
(2)和(3)是非极性分子,其余都是极性分子。
分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。
H H 33H 3I I(1)(2)(3)(5)(6)(7)(8)1-7 解释下列现象。
(1)CO 2分子中C 为sp 杂化,该分子为直线型分子,两个C=O 键矩相互抵消,分子偶极矩为零,是非极性分子;而SO2分子中S 为sp2杂化,分子为折线型,两个S —O 键矩不能抵消,是极性分子。
(2)在NH3中,三个N—H键的偶极朝向N,与电子对的作用相加;而NF3中三个N—F 键的偶极朝向F,与N上的未成对电子的作用相反并有抵消的趋势。
(3)Cl和F为一同主族元素,原子共价半径是Cl比F大,而电负性是F比Cl大。
键的偶极矩等于μ=qd,q为正电荷中心或负电荷中心上的电荷量,d为正负电荷中心的距离。
HCl 键长虽比HF的长,但F-中心上的电荷量大大于Cl-上的电荷量,总的结果导致HF的偶极矩大于HCl。
所以键长是H—Cl较长,偶极矩是H—F较大。
1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。
答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3到sp2至sp,s成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。


四氧化硫化合价硫(S)是一种非金属元素,常见的化合价有+2、+4和+6。
在硫的氧化物中,硫的化合价最高为+6。
四氧化硫(SO4)是硫和氧形成的化合物,其中硫的化合价为+6。
四氧化硫是一种无色气体,具有刺激性气味。
它由硫和氧反应而成,化学式为SO4。
在四氧化硫中,硫原子和四个氧原子形成共价键,硫原子处于+6的化合价状态,每个氧原子处于-2的化合价状态。
这使得硫原子的总化合价为+6。
四氧化硫的化学性质与其存在的化合价密切相关。
由于硫原子的化合价为+6,使得四氧化硫具有较强的氧化性。
它可以与许多物质反应,如金属、非金属元素和有机物等。
与金属反应时,硫原子的氧化性使它能够将金属氧化为金属离子,同时将自身还原为较低化合价状态的硫化物。
与非金属元素反应时,硫原子往往会使非金属元素氧化为氧化物或酸。
与有机物反应时,硫原子的氧化性使它能够将有机物氧化为相应的氧化产物。
四氧化硫在工业上有广泛的应用。
它被用作制取硫酸和其他硫酸盐的原料。
四氧化硫与水反应会生成硫酸,这是因为水能够将硫原子的化合价从+6还原为+4。
硫酸广泛应用于化工、冶金、农业等领域。
此外,四氧化硫还可用于制造染料、消毒剂和硫化剂等。
尽管四氧化硫在工业上有重要的应用,但它也具有一定的危险性。
四氧化硫的氧化性和刺激性使得它对人体和环境可能带来危害。
在使用四氧化硫时,必须采取适当的安全措施,并遵守相关的安全操作规程。
总结起来,硫的化合价在四氧化硫中为+6,其化学性质主要取决于硫的高化合价。
四氧化硫具有较强的氧化性,广泛应用于工业生产中。
然而,使用时需要注意安全性,以避免潜在的危害。
[Fe(CN)6]4-是一种六价铁阴离子,它的配位原子是氮、碳和铁。
首先,[Fe(CN)6]4-的中心原子是铁,它的原子序数为26,原子量为56。
铁拥有六个
配位原子,分别是三个氮原子和三个碳原子。
三个氮原子的原子序数是7,原子量为14;三个碳原子的原子序数是6,原子量为12。
氮原子和碳原子分别与铁原子形成三组共价键,使得[Fe(CN)6]4-形成六价铁阴离子。
其次,[Fe(CN)6]4-的氮原子和碳原子都可以与离子或其他物质形成配位键,形成新的化合物。
它们可以与氧原子形成水溶液,也可以与另一个离子形成双价化合物。
此外,[Fe(CN)6]4-也可以与其他离子螯合,形成螯合物。
总而言之,[Fe(CN)6]4-的配位原子是氮、碳和铁,它们可以与离子或其他物质形成配位键,形成新的化合物。
它们还可以与离子螯合,形成螯合物。