同步荧光技术
- 格式:ppt
- 大小:829.50 KB
- 文档页数:26

实验题目:测定生物样品中的蛋白质(同步荧光法)1.实验原理:蛋白质是一类重要的生物大分子,它是构成生命体最重要的物质基础之一。
蛋白质的定量测定是临床检验中诊断疾病及检查治疗效果的重要指标。
因此,蛋白质定量测定在化学、生物、医药、食品等各相关学科中已经成为一个非常热门的研究课题。
血清白蛋白是动物和人体血浆中重要的载体蛋白,它能和许多种内源或外源化合物产生作用,承载着将药物运输到达靶点产生药效和储存药物延长药效等重要作用,对研究药物的药效和药理及临床用药有重要意义。
蛋白质测定较常用的经典方法有凯氏定氮法、Lowry法、考马斯亮蓝法、紫外分光光度法b1等,其中,凯氏定氮法因其适用样品广泛,测试结果准确,是常用分析有机化合物含氮量的经典方法之一。
近来又发展了一些新方法如荧光光度法、化学发光法和共振光散射法[等。
同步荧光光谱法自1971年被提出以来,由于其与常规荧光分析法相比具有灵敏度高、选择性好、光谱简化、谱带窄化及可减小散射光影响等优点,已成功地应用于多组分的同时测定以及生物分子的研究中。
2.仪器与试剂:FP-6500荧光分光光度计(日本分光公司);T-6紫外一可见分光光度计(北京普析通用仪器公司);PB.10型酸度计(北京赛多利斯仪器系统公司);BS.110S型电子天平(北京赛多利斯天平公司);脱氧尿苷1.0×10。
3 mol/L水溶液;人血清白蛋白(HSA,华兰生物工程公司)4.0×10。
5 mol/L水溶液,在冰箱中保存(1~4 oC);pH 7.4的%s.HCI 缓冲溶液;考马斯亮蓝溶液(溶液中含0.0l%考马斯亮蓝G-250,4.7%乙醇,8.5%磷酸);0.5 mol/L的NaCl水溶液。
所用试剂均为分析纯,实验用水均为二次去离子水。
3. 实验方法:于10 mL比色管中依次加入:pH 7.4的Tris.HCl缓冲溶液2.0 mL,0.5 mol/L的NaCI溶液2.0 IllL,一定体积的HSA标准溶液,1.0×10。

演唱会荧光棒同步原理概述:场控荧光棒是异步科技自主研发、业内首创的演唱会综合应援方案。
通过中央控制台以RF 广播形式发送信号,光棒接收数据进行对应的颜色变换,以此控制整场数万支荧光棒与舞台灯光及现场音效形成交相辉映的现场效果,营造出良好的活动氛围。
一、控制器群控原理:通过无线控制,使数万支光棒在同一时间实现整体颜色的变化。
控制器群控光棒是我们与五月天巡演合作产品,成功应援2012年“诺亚方舟”和2016年“Just Rock It”世界巡回演唱会,累计使用1000000支。
使用前,通过软件来设置主控器每个键值对应的颜色和颜色变幻模式,如七色变幻、闪烁、固定颜色长亮、关闭等。
(如下图)每按一下按键,光棒即显示相对应的颜色及模式。
响应时间可做到10帧/秒,即每秒钟光棒可变换10种不同颜色。
现场效果:二、控制器分区控原理:分区控制每个区域光棒的颜色变换、明暗变换和闪烁频率,根据现场音效形成每个区域之间此起彼伏的变换节奏。
控制器分区控是我们与张学友2017全球巡演的合作产品,2017年2月首次应援张学友惠州演唱会,并与舞台灯光DMX串联,由灯光师统一控制光棒,至今累计使用超1000000支。
现场效果三、控制器点控原理:单独控制每一根光棒颜色变换,整场光棒形成字母、图案以及动画的效果。
控制器点控光棒是我们与SHE团体巡演合作产品,2013年6月在SHE小巨蛋演唱会首次应援并获得成功,新颖的节目效果在圈内引起极大反响。
我们为此开发了一套完整的软件及工具。
1.根据场馆观众坐席进行描点;2.根据客户需求制作光棒的节目素材;3.使用条码机打印全场座位编号;4.对光棒进行座位编排,专用线材连接光棒和电脑,对光棒进行节目烧录;5.现场根据编号摆放光棒,或与门票二维码对应销售;6.原理流程:现场效果:四、DMX控制2015年我们升级了控制装置,增加了RGBT四个电位器来实现整体光棒的灰度控制,另外还增加了DMX512灯光控制协议和接口,可连接DMX控制台,由舞美灯光师统一控制光棒颜色变化,以此与现场灯光形成和谐统一的氛围。

同步荧光法同时快速测定水中多环芳烃混合物蔡其洪;杨子峰;朱航;许桂芬【摘要】A synchronous fluorescence spectrometry for simultaneous and rapid determination of three polycyclic aromatic hydrocarbons ( PAHs ) 2,3- benzofluorene (2,3- BF ) , benzo [ a ] pyrene ( BaP) and perylene ( Pery) has been developed. Three PAHs could be simultaneously identified and quantitatively determined with single scanning when A A was 26 nm. The linear ranges for 2,3-benzofluorene, benzo [a] pyrene and perylene were 0. 02-50 ng · mL-1, 0. 05-200 ng · mL-1 and 0. 1 -400 ng · mL-1, with the detection limits of 0. 003 5 ng · mL-1, 0. 002 1 ng · mL-1 and 0. 006 0ng · mL-1 , respectively. This method was characterized hy its simplicity, rapidness, sensitivity and wide linear range. The proposed method had been applied to the analysis of the three PAHs in different water samples with satisfied results.%建立同时快速测定2,3-苯并芴、苯并[a]芘和苝3种多环芳烃的同步荧光法.选择波长差Δλ=26 nm,只需一次扫描,就可实现3个组分的同时鉴别和定量测定.2,3-苯并芴、苯并[a]芘和苝的线性范围分别为0.02 ~50 ng·mL-1、0.05~200 ng·mL-1和0.1 ~400ng·mL-1,检出限分别为0.0035ng·m L-1、0.002 1 ng·mL-1和0.006 0 ng·mL-1.该方法简单快速,灵敏度高,线性范围宽,用于各种实际水样的分析,获得很好的效果.【期刊名称】《安徽大学学报(自然科学版)》【年(卷),期】2012(036)005【总页数】6页(P97-102)【关键词】同步荧光法;多环芳烃;水;快速测定【作者】蔡其洪;杨子峰;朱航;许桂芬【作者单位】莆田学院医学院药学系,福建莆田351100;澳门科技大学中医药学院,澳门999078;莆田学院医学院药学系,福建莆田351100;莆田学院医学院药学系,福建莆田351100【正文语种】中文【中图分类】O657.3多环芳烃(PAHs)是两个以上的苯环以稠环形式相连的一类化合物,其中许多具有致癌、致畸、致突变的作用,人类的外环境如水、土壤和大气中都不同程度地含有多环芳烃.大气、土壤及许多物质表面的PAHs都有可能被带入水体环境,继而通过海藻、甲壳类动物、软体动物和鱼组成的食物链或直接通过饮用水向人体转移,最终都有可能在人体内聚集,对人的身体健康产生严重的危害,是人类致癌的重要起因之一[1-2].因此PAHs的监测越来越受到人们的重视,许多国家和组织都出台了水中PAHs监测目录和检测方法以控制PAHs对人类生活环境的危害.目前国内外 PAHs的检测方法主要采用高效液相色谱法[3-4]、色谱-质谱法[5-6]和荧光分析法[7-8].其中高效液相色谱法和色谱-质谱法两种方法均需烦琐的前处理操作,分析时间长,检测费用比较贵,而且由于分析过程中使用洗脱剂稀释,检测灵敏度会受到影响.PAHs具有较好的荧光性质,因此常利用荧光分析法进行检测,然而常规的荧光分析法无法同时测定光谱相互重叠的组分.同步荧光法具有谱图简化、谱带窄化、选择性提高和光散射干扰减少等特点,是一种具有高选择性、高灵敏度的分析方法,尤其适合复杂背景和多组分混合物的分析[9].目前同步荧光法用于PAHs的检测有恒波长同步荧光法[10]、恒能量同步荧光法[11]和可变角同步荧光法[12].其中,恒波长同步荧光法习惯上称为同步荧光法,是普通的商品化仪器都具有的功能,文献多报道用于两种物质的分析检测或者用于克服复杂背景的干扰,用于3种及以上物质同时检测的报道极为少见[13].作者建立了同步荧光法同时快速测定3种PAHs的新方法,并应用在实际样品的检测中,该法可大大节省分析检测的费用和时间,普通的商品化仪器即可实现,特别适用推广和基层实验室使用.1.1 主要仪器与试剂F-4600 荧光分光光度计,日本日立公司.2,3-苯并芴(Aldrich,99%)、苯并[a]芘(Sigma,97%)和苝(Sigma,99%)的标准环己烷储备液均为100 μg·mL -1,使用时用环己烷(重蒸馏)稀释到所需的浓度.1.2 水样品提取方法取不同水样品50 mL置于分液漏斗,用10 mL的环己烷分别萃取3次,合并萃取液,混合均匀.1.3 测定方法取试液置于1 cm×1 cm石英池中,设置仪器实验参数:激发和发射单色仪狭缝宽度均为5 nm,扫描速度为1 200 nm·min-1.选择Δλ=26 nm的波长差进行恒波长同步荧光法测定.2.1 荧光激发光谱和发射光谱选择2,3-苯并芴(2,3-BF)、苯并[a]芘(BaP)和苝(Pery)3种 PAHs溶液的浓度分别为20 ng·mL-1、60 ng·mL-1和100 ng·mL-1,分别扫描它们的荧光激发和发射光谱,结果如图 1 所示.2,3-苯并芴、苯并[a]芘和苝的荧光激发和发射波长分别是λex=317 nm,λem=343 nm;λex=385 nm,λem=406 nm;λex=436 nm,λem=440 nm.从图1可知,3种PAHs的荧光激发和发射光谱存在部分重叠,相互干扰严重,利用常规的荧光法难以对它们进行同时检测.2.2 同步荧光光谱同步荧光分析法中Δλ的选择是一个关键因素,通过实验选择Δλ=20~40 nm之间进行同步荧光法扫描,结果显示当Δλ=26 nm时,3种PAHs的同步荧光光谱能很好地分开,2,3-苯并芴、苯并[a]芘和苝的同步荧光峰位置分别位于317 nm、380 nm和413 nm,3种物质几乎互不干扰,且各单一物质峰高与同样浓度的3种PAHs混合物中对应组分的峰高基本一致,如图2所示.2.3 工作曲线和检出限配制一系列不同浓度的2,3-苯并芴、苯并[a]芘和苝溶液,Δλ=26 nm波长差同步荧光扫描,其中每一点平行测定3次,取荧光强度平均值,以317 nm、380 nm和413 nm处的同步荧光峰的信号强度对2,3-苯并芴、苯并[a]芘和苝的浓度作工作曲线,结果如图3所示.得到3种多环芳烃的线性方程、线性范围、相关系数和检出限如表1所示.2.4 精密度平行配制6 份含有25 ng·mL-12,3-苯并芴、100 ng·mL-1苯并[a]芘和200 ng·mL-1苝的混合溶液,在相同实验条件下进行同步荧光扫描,结果列于表2.2.5 相互干扰实验实验检验3种PAHs共同存在时相互干扰情况的结果为:当2,3-苯并芴和苯并[a]芘的最大浓度为45 ng·mL-1和180 ng·mL-1时,苝在线性范围内测定时最大相对误差为4.3%;当2,3-苯并芴和苝的最大浓度为40 ng·mL-1和360 ng·mL-1时,苯并[a]芘在线性范围内测定时最大相对误差为4.4%;当苯并[a]芘和苝的最大浓度为160 ng·mL-1和360 ng·mL-1时,2,3-苯并芴在线性范围内测定时最大相对误差为4.9%.从以上实验结果得知,3种PAHs之间相互干扰很少.2.6 水样测定和回收率实验取莆田市区内饮用自来水、东圳水库水(莆田市区饮用水源)、溪水(莆田市濑溪桥头)和海水(湄洲岛码头)4种水样品各50 mL,根据1.2方法提取,采用Δλ=26 nm进行同步荧光扫描,其中每个样品平行测定3次.结果两种饮用水源还尚未发现PAHs,说明水质较好;溪水和海水中都存在相应的PAHs,如图4所示.溪水中存在微量的苯并[a]芘,说明其受到一定的污染;海水中存在多种PAHs,主要原因是湄洲岛文甲码头轮船较多,存在石油泄漏,另外大量的人员流动、生活垃圾及污水也存在严重的污染,导致PAHs的含量较高.采用加标回收率的方法验证方法的准确性.取50 mL自来水、水库水、溪水和海水各4份,加入不同浓度的2,3-苯并芴(2,3-BF)、苯并[a]芘(BaP)和苝(Pery),混合均匀.采用 1.2 方法提取,同步荧光法测定,其中每个浓度平行测定3次,所得结果取平均值,如表3所示.实验可得回收率在82.0%~99.0%之间,从加标所测的回收率来看,除了低浓度所测结果偏低一点,大部分的回收结果令人满意.通常水中多环芳烃含量极低,背景复杂,分析检测难度较高.作者探索一种简便易行的分析方法.实验结果表明,文中所建立的同步荧光法可快速同时测定水中2,3-苯并芴、苯并[a]芘和苝3种多环芳烃,灵敏度高,线性范围宽,检出限低,能有效检出水中3种多环芳烃混合物,所需费用低,可推广使用.【相关文献】[1]Xia Z H,Duan X L,Qiu W X,et al.Health risk assessment on dietary exposure to polycyclic aromatic hydrocarbons(PAHs)in Taiyuan,China[J].Sci Total Environ,2010,408:5331-5337.[2]Kriek E,Rojas M,Alexandrov K,et al.Polycyclic aromatic hydrocarbon-DNA adducts in humans:relevance as biomarkers for exposure and cancer risk[J].Mutation Res,1998,400:215-231.[3]Hii T M,Basheer C,Lee H mercial polymeric fiber as sorbent for solid-phase microextraction combined with high-performance liquid chromatography for the determination of polycyclic aromatic hydrocarbons in water[J].J Chromatogr A,2009,1216:7520-7526.[4]Marjolaine B D,Daudin J J,Barriuso E.An experimental design approach to optimise the determination of polycyclic aromatic hydrocarbons from rainfallwaterusing stirbarsorptive extraction and high performance liquid chromatography-fluorescence detection[J].J Chromatogr A,2007,1167:143-453.[5]Ma J P,Xia R H,Li J H,et al.Determination of 16 polycyclic aromatic hydrocarbons in environmental water samples by solid-phase extraction using multi-walled carbon nanotubesasadsorbentcoupled with gas chromatography-mass spectrometry[J].J Chromatogr A,2010,1217:5462-5469.[6]Ozcan S,Tor A,Aydin M E.Determination of polycyclic aromatic hydrocarbons in waters by ultrasound-assisted emulsification-microextraction and gas chromatography-mass spectrometry[J].Anal Chim Acta,2010,665:193-199.[7]Francisco P P,Isabel C M,Isela L,et al.Rapid screening of polycyclic aromatic hydrocarbons(PAHs)in waters by directly suspended droplet microextraction-microvolume fluorospectrometry[J].Talanta,2012,89:217-222.[8]Saitoh T,Itoh H,Hiraide M.Admicelle-enhanced synchronous fluorescence spectrometry for the selective determination of polycyclic aromatic hydrocarbons in water [J].Talanta,2009,79:177-182.[9]Patra D,Mishra A K.Recent developments in multi-component synchronous fluorescence scan analysis[J].Trac Trends Anal Chem,2002,21(12):787-798.[10]展惠英,周文军,姜梅,等.同步荧光法同时测定黄土中的菲和萘[J].中国环境科学,2003,23(2):131-133.[11]何立芳,林丹丽,李耀群.多环芳烃混合物的快速导数-恒能量同步荧光光谱分析[J].应用化学,2004,21(9):937-941.[12]Lin D L,Zou Z X,He L F,et al.Rapid screening method for simultaneous determination of four polycyclic aromatic hydrocarbons in water samples by derivative non-linear variable-angle synchronous fluorescence spectrometry[J].Luminescence,2005,20(4/5):292-297.[13]蔡其洪.恒波长同步荧光法同时测定三种多环芳烃[J].莆田学院学报,2006,13(5):80-83.。
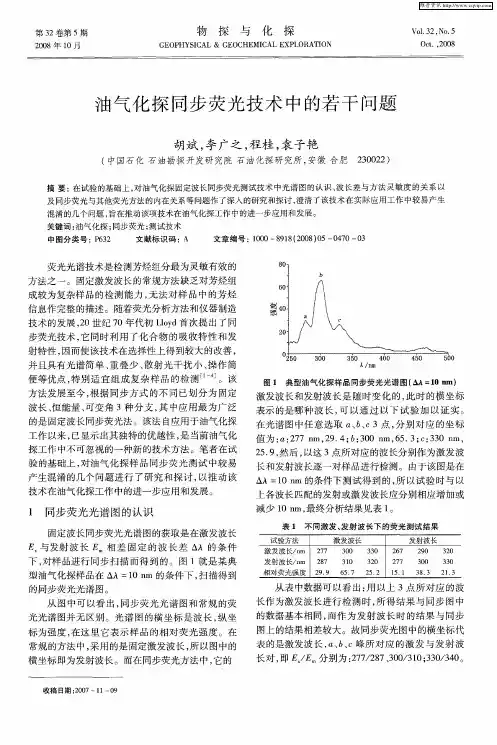

![导数恒能量同步荧光法快速同时分析芴、咔唑、苯并[α]芘和茈](https://uimg.taocdn.com/565a107727284b73f2425078.webp)

同步辐射X射线荧光法分析藏药材和藏药制剂中金属元素
同步辐射X射线荧光法是一种非破坏性、无需样品预处理的无损伤、微量金属元素分析技术。
该技术在分析藏药制剂和藏药材中的金属元素上具有独特的优势。
目前,同步辐射X射线荧光法已广泛应用于藏药制剂和藏药材中的金属元素分析,极大地促进了藏药的质量和安全控制。
同步辐射X射线荧光法能够测定药材和制剂中微量元素的浓度、分布和化学形态,包括有毒金属元素(如汞、铅、镉)、重要微量元素(如锌、铁、硒、钙等)以及其他金属元素。
该技术具有高灵敏度、高分辨率和高稳定性等优点,使得分析结果非常可靠和准确。
在分析藏药制剂中的金属元素时,同步辐射X射线荧光法能够精确测定不同配方的制剂中的金属元素含量,对于有效控制制剂中有毒金属元素(如汞、铅等)含量具有重要意义。
在分析藏药中的金属元素时,同步辐射X射线荧光法能够实现对不同生长环境、不同生长阶段的藏药材中金属元素含量的分析和比较研究,探讨藏药的药效与生长环境之间的关系。
总的来说,同步辐射X射线荧光法是一种非常有潜力的分析技术,在藏药制剂和藏药材中的金属元素分析领域具有广阔的应用前景,有利于进一步提高藏药的质量和安全性。


《等电聚焦电泳与同步辐射X荧光联用技术研究生物样品内的微量元素》篇一一、引言随着科技的发展,对生物样品内微量元素的检测和分析变得越来越重要。
微量元素在生物体内扮演着重要的角色,其含量和分布情况直接关系到生物体的健康状态。
因此,准确、快速地检测和分析生物样品内的微量元素成为了科研领域的重要课题。
等电聚焦电泳(Isoelectric Focusing Electrophoresis, IFE)和同步辐射X荧光(Synchronous Radiation X-ray Fluorescence, SRXRF)联用技术为这一课题提供了有效的解决方案。
本文将探讨这两种技术如何联用,以及它们在研究生物样品内微量元素方面的应用。
二、等电聚焦电泳技术概述等电聚焦电泳是一种生物化学技术,主要用于蛋白质和其他带电分子的分离和纯化。
该技术利用蛋白质在等电点附近的特殊性质,通过电场作用使蛋白质分子按照其等电点进行聚焦,从而实现分离和纯化。
等电聚焦电泳具有高分辨率、高灵敏度和高重复性等优点,是生物样品内微量元素分析的重要手段之一。
三、同步辐射X荧光技术概述同步辐射X荧光是一种强大的元素分析技术,能够检测和分析样品中的微量元素。
该技术利用同步加速器产生的X射线照射样品,使样品中的元素发出特征X荧光,通过检测这些荧光信号,可以确定样品的元素组成和含量。
同步辐射X荧光技术具有高灵敏度、非破坏性和无污染等优点,是生物样品内微量元素分析的重要手段之一。
四、等电聚焦电泳与同步辐射X荧光联用技术等电聚焦电泳与同步辐射X荧光联用技术将两种技术的优势结合起来,实现了生物样品内微量元素的快速、准确检测和分析。
首先,等电聚焦电泳将生物样品中的蛋白质和其他带电分子进行分离和纯化,然后通过同步辐射X荧光技术检测和分析分离出的组分中的微量元素。
这种联用技术不仅可以提高检测的灵敏度和准确性,还可以提供更全面的元素信息,为生物样品内微量元素的研究提供了强有力的支持。


固定波长同步荧光法测定污水和污泥的苯并(a)芘摘要:本文采用δλ=23nm的固定波长同步荧光法测定污泥和水样中的bap,同时测定烟头的bap含量与之对比,探讨了样品浓度对于测定的影响。
本方法相对于一般的荧光光度法和用δλ=3nm的同步荧光法,在实验的样品前处理简单方便、污染小,而且具有光谱简化、谱带窄化、光谱重叠程度减少、散射光减少等特点、灵敏度高的特点。
实验表明以δλ=23 nm的固定波长同步荧光法测定污水厂出水及污泥的bap含量的方法值得推广使用。
关键词:同步荧光法测定苯并(a)芘中图分类号:o659.36 文献标识码:a 文章编号:1674-098x(2012)06(c)-0106-02苯并(a)芘简称bap,是一种有代表性的强致癌物质,由于它对人体的严重危害,已引起了世界各国卫生和环境组织的高度重视,并被列为环境污染致癌物检测工作中常规检测项目之一。
bap是一种由五个苯环构成的多环芳烃,分子式为,分子量252,易溶于环己烷、咖啡因水溶液、苯和三氯甲烷等有机溶剂,其结构如下。
一般燃烧不充分的烟雾中(煤,沥青等)都含有bap,它还存在于工业污水、空气漂尘、香烟头和污泥等。
经典的荧光分析方法中,采用固定激发波长,扫描发射波长以测绘荧光物的荧光发射光谱;固定发射波长,扫描激发波长以测绘荧光激发光谱,然后在合适的激发和发射波长下进行测定。
环境样品中bap含量低,一般在ppb级,且与其它多环芳烃类荧光物质共存[1],因此,采用经典荧光分析法时需对样品进行反复分离后再测定(如图1)。
同步荧光分析法在实验技术上与经典方法的差别在于同时扫描激发波长和发射波长,检测相应的同步荧光信号,由测得的荧光强度信号与对应的激发波长或发射波长构成光谱图,称为同步荧光光谱。
同步荧光分析法可分为固定波长法、恒能量法和可变角度法。
固定波长同步荧光法是在扫描过程中使激发波长和发射波长两者之间保持固定的波长间隔。
同步扫描中,固定波长差δλ值的选择极为重要,因为将直接影响到同步荧光光谱的形状、信号、强度和光谱位置。