有机化学教学之七:炔烃与二烯烃
- 格式:doc
- 大小:47.00 KB
- 文档页数:9


第七章炔烃和二烯烃Chapter 7 alkynes and alkdienes炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
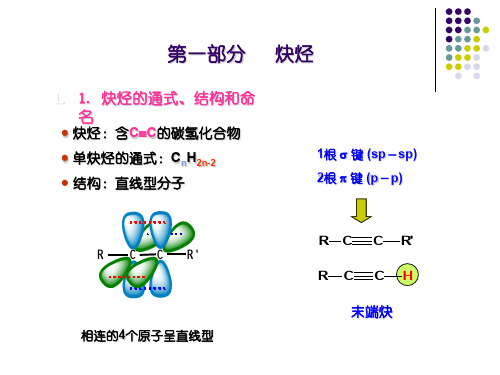
第一节炔烃的结构和命名乙炔是最简单的炔烃,分子式为C2H2,构造式为HC ≡ CH。
根据杂化轨道理论,乙炔分子中的碳原子以sp杂化方式参与成键,两个碳原子各以一条sp杂化轨道互相重叠形成一个碳碳σ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠,各形成一个碳氢σ键。
此外,两个碳原子还各有两个相互垂直的未杂化的2p轨道,其对称轴彼此平行,相互“肩并肩”重叠形成两个相互垂直的π键,从而构成了碳碳叁键。
两个π键电子云对称地分布在碳碳σ键周围,呈圆筒形。
乙炔分子中π键的形成及电子云分布其它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ·mol -1,比三个σ键的键能和(345.6 kJ·mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。



第七章炔烃和二烯烃学习要求1 掌握炔烃的结构和命名。
2 掌握炔烃的的化学性质,比较烯烃和炔烃化学性质的异同。
3 掌握共轭二烯烃的结构特点及其重要性质。
4 掌握共轭体系的分类、共轭效应及其应用。
炔烃和二烯烃都是通式为C n H2n-2的不饱和烃,炔烃是分子中含有-C≡C-的不饱和烃,二烯烃是含有两个碳碳双键的不饱和烃,它们是同分异构体,但结构不同,性质各异。
§7.1 炔烃7.1.1 炔烃的结构最简单的炔烃是乙炔,我们以乙炔来讨论三键的结构。
现代物理方法证明,乙炔分子是一个线型分子,分之中四个原子排在一条直线上0.106nm0.12nmC C H180°杂化轨道理论认为三键碳原子既满足8电子结构结构和碳的四价,又形成直线型分子,故三键碳原子成键时采用了SP杂化方式 .1 sp杂化轨道杂化后形成两个sp杂化轨道(含1/2 S和1/2 P成分),剩下两个未杂化的P轨道。
两个sp杂化轨道成180分布,两个未杂化的P轨道互相垂直,且都垂直于sp杂化轨道轴所在的直线。
2 三键的形成σ7.1.2 炔烃的命名1 炔烃的系统命名法和烯烃相似,只是将“烯”字改为“炔”字。
2 烯炔(同时含有三键和双键的分子)的命名:(1)选择含有三键和双键的最长碳链为主链。
(2)主链的编号遵循链中双、三键位次最低系列原则。
(3)通常使双键具有最小的位次。
7.1.3 炔烃的化学性质1 亲电加成(1) R-C≡C-H 与HX等加成时,遵循马氏规则。
(2)炔烃的亲电加成比烯烃困难。
例如:a: CH2=CH2 + Br2/CCl7 溴褪色快H-C≡C-H + Br2/CCl7 溴褪色慢b:c:原因: 1°炔碳原子是sp杂化的,杂化轨道中S的成分大,S的成分大,键长就越短,键的离解能就越大。
2°两个轨道分布与键的四周,重叠程度比乙烯中的要大,比双键难于极化。
2 水化反应在炔烃加水的反应中,先生成一个很不稳定的烯醇,烯醇很快转变为稳定的羰基化合物(酮式结构)。
这种异构现象称为酮醇互变异构。
这一反应是库切洛夫在1881年发现的,故称为库切洛夫反应。
其他炔烃水化时,则变成酮。
例如:3 氧化反应 (P82)(1) KMnO7氧化(2) O3氧化4 炔化物的生产成三键碳上的氢原子具有微弱酸性(pK a=25),可被金属取代,生成炔化物。
生成炔银、炔铜的反应很灵敏,现象明显,可用来鉴定乙炔和端基炔烃。
干燥的炔银或炔铜受热或震动时易发生爆炸生成金属和碳。
Ag-C≡C-Ag 2Ag + 2C + 367KJ/mol 所以,实验完毕,应立即加盐酸将炔化物分解,以免发生危险。
Ag-C≡C-Ag + 2HCl H-C≡C-H + 2AgCl 乙炔和RC≡C-H 在液态氨中与氨基钠作用生成炔化钠。
炔化钠是很有用的有机合成中间体,可用来合成炔烃的同系物。
例如:CH3CH2C≡CNa + CH3CH2CH2Br CH3CH2C≡CCH2CH2CH3 + NaBrR-X=1°RX说明:炔氢较活泼的原因是因≡C-H键是sp-s键,其电负性Csp > Hs(Csp=3.29,Hs=2.2),因而显极性,具有微弱的酸性。
5 还原(加氢)反应(1)催化加氢催化氢化常用的催化剂为 Pt , Pd , Ni,但一般难控制在烯烃阶段。
用林德拉(Lindlar)催化剂,可使炔烃只加一分子氢而停留在烯烃阶段。
且得顺式烯烃。
例如:Lindlar催化剂的几种表示方法:(1)在液氨中用钠或锂还原炔烃,主要得到反式烯烃。
7.1.4 乙炔(自学)要求:掌握乙却的制法,重要性质[氧化、加成、聚合(特别是二聚),及主要用途。
7.1.5 炔烃的制备1 邻二卤代烷脱卤化氢2 由炔化外物制备§7.2 二烯烃分子中含有两个碳碳双键的烃类化合物称为二烯烃。
7.2.1 二烯烃的分类和命名1 分类(根据两个双键的相对位置可把二烯烃分为三类)累积二烯烃-C=C=C-二烯烃共轭二烯烃-C=CH-CH=CH-孤立二烯烃-C=CH(CH2)n CH=C- n ≥ 1孤立二烯烃的性质和单烯烃相似,累积二烯烃的数量少且实际应用的也不多。
共轭二烯烃有不同于共轭二烯烃的一些特性,在理论和实际应用上都很重要。
下面我们主要讨论共轭二烯烃。
2 命名(1)和烯烃的命名一样称为某几烯(2) 多烯烃的顺反异构的标出(每一个双键的构型均应标出)。
例如:共轭二烯烃还存在着不同的构象,应以注意 P887.2.2 二烯烃结构1.丙二烯烃(累积二烯烃)结构见P892.共轭二烯烃结构(以1,3-丁二烯为例)丁二烯分子中碳原子都以杂化轨道相互重叠或与氢的轨道重叠,形成三个键和6个键,所有的原子都在同一平面上,键角都接近于120。
此外,每个碳原子上未参与杂化的轨道均垂直于上述平面,四个轨道的对称轴互相平行侧面重叠,形成了包含四个碳原子的四电子共轭体系。
按照分子轨道理论的概念,丁二烯的四个P轨道可以组成四个π电子的分子轨道, 从分子轨道图形可以看出,在ψ1轨道中π电子云的分布不是局限在C1-C2, C3-C7之间,而是分布在包括在四个碳原子的两个分子轨道中,这种分子轨道称为离域轨道,这样形成的键称为离域键。
从ψ2分子轨道中看出,C1-C2,C3-C7之间的键加强了,但C2-C3之间的键减弱,结果,所有的键虽然都具有π键的性质,但C2-C3键的π键的性质小些。
所以,在丁二烯分子中,四个π电子是分布在包含四个碳原子的分子轨道中,而不是分布在两个定域的π轨道7.2.3 共轭二烯烃的反应共轭二烯烃具有烯烃的通性,但由于是共轭体系,故又具有共轭二烯烃的特有性质。
下面主要讨论共轭二烯烃的特性。
1.1,7-加成反应共轭二烯烃进行加成时,既可1,2加成,也可1,7加成,1,2-加成和1,7-加成是同时发升的,哪一反应占优,决定于反应的温度,反应物的结构,产物的稳定性和溶剂的极性。
极性溶剂,较高温度有利于1,7-加成;非极性溶剂较低温度,有利于1,2-加成。
为什么即有1,2-加成,又有1,7-加成:这是由反应历程决定的(其加成反应为亲电加成历程)第一步:ⅠⅡ因碳正离子的稳定性为(Ⅰ) >(Ⅱ),故第一步主要生成碳正离子(Ⅰ)。
第二步:在碳正离子(Ⅰ)中,正电荷不是集中在一个碳上,而是如下分布的。
所以Br-离子既可加到C2上,也可加到C7上。
加到C2得1,2-加成产物,加到C7上得1,7-加成产物。
反应条件不同,产率不同的原因:1°速度控制与平衡控制1,2-加成反应的活化能低,为速度控制(动力学控制)产物,故低温主要为1,2-加成。
1,7-加成反应的活化能较高,但逆反应的活化能更高,一但生成,不易逆转,故在高温时为平衡控制(热力学控制)的产物,主要生成1,7-加成产物。
见位能曲线图。
在有机反应中,一种反应物可以向多种产物方向转变时,在反应未达到平衡前,利用反应快速的特点来控制产物组成比例的即为速度控制。
速度控制往往是通过缩短反应时间或降低反应温度来达到目的。
利用平衡到达来控制产物组成比例的反应即平衡控制,平衡控制一般是通过延长反应时间或提高反应温度使反应达到平衡点的。
2°产物结构的稳定性:!,7-加成产物的稳定性大于1,2-加成产物。
(可从σ-π共轭效应来理解)2.狄尔斯(Diels)—阿德尔(Alder)反应双烯合成反应共轭二烯烃和某些具有碳碳双键、三键的不饱和化合物进行1,7-加成,生成环状化合物的反应称为双烯合成反应。
例如:要明确几点:(1)双烯体是以顺式构象进行反应的,反应条件为光照或加热。
(2)双烯体(共轭二烯)可是连状,也可是环状。
如环戊二烯,环己二烯等。
(3)亲双烯体的双键碳原子上连有吸电子基团时,反应易进行。
常见的亲双烯体有:CH2=CH-CHO CH2=CH-COOH CH2=CH-COCH3CH2=CH-CN CH2=CH-COOCH3 CH2=CH-CH2Cl(4) D-A反应的产量高,应用范围广是有机合成的重要方法之一,在理论上和生都占有重要的地位。
§7.3 共轭效应7.3.1 共轭体系1.共轭体系的涵义(共轭平均分担之意,如牛之轭)在分子结构中,含有三个或三个以上相邻且共平面的原子时,这些原子中相互平行的轨道之间相互交盖连在一起,从而形成离域键(大键)体系称为共轭体系。
σπ2.共轭体系的类型1) π-π共轭体系:2) P-π共轭体系:3) σ-π共轭体系: CH3-CH=CH2见 P68; 170CH3C H2超共轭体系。
4) σ-P共轭体系:CH3C H23.共轭体系的特点:a) 组成共轭体系的洋子原子具共平面性。
b) 键长趋于平均化。
(因电子云离域而致)。
正常C-C键键长0.157nm 丁二烯中 C-C键长0.177nmC=C 0.133nm C=C 0.1337nm 苯分之中 C-C键长均为0.1397nmc) 内能较低,分子趋于稳定(可从氢化热得知)。
7.3.2 共轭效应1.共轭效应的含义在共轭效应中,由于轨道之间的相互交盖,使共轭体系中电子云分布产生离域作用,键长趋于平均化,分子的内能降低,更稳定的现象称为共轭效应。
2.共轭效应的传递: 沿着共轭链交替传递,不因链长而减弱(交替、远程传递)。
例如:3.静态共轭效应的相对强度1)对P-π共轭效应有两种情况:a 富电子时,P电子朝着双键方向转移,呈供电子共轭效应(+C)。
对同族元素,P-π共轭效应的强度(+C)为:见P95对同周期元素,P-π共轭效应的强度(+C)为:见P95b 缺电子时,π电子云向P轨道转移,呈吸电子共轭效应(- C)。
其相对强度视体系结构而定。
2)π-π共轭的相对强度双键与电负性大的不饱和基团共轭时,共轭体系的电子云向电负性大的元素偏移,呈现出吸电子的共轭效应(- C)。
例如:其相对强度为:=O>=NR>=CR2 =O>=S7.超共轭效应因σ-π共轭效应,σ-P共轭效应比π-π共轭效应和P-π共轭效应要弱得多,所以将其称为超共轭效应。
通过氢化热数据可以说明超共轭效应是存在的。
CH3CH2CH=CH2 + H2 CH3CH2CH2CH3氢化热 126.8KJ/molZ-CH3CH=CHCH3 + H2 CH3CH2CH2CH3氢化热 119.7KJ/molCH3C(CH3)=CHCH3 +H2 CH3CH(CH3)CH2CH3氢化热 112.5KJ/mol可见,与双键碳相连的C-H键越多其超共轭效应越明显。
应当指出共轭效应常与诱导效应同时存在,同时影响着分子的电子云分布和化学性质。