3 化学反应速率和化学平衡 PPT课件
- 格式:ppt
- 大小:3.16 MB
- 文档页数:52


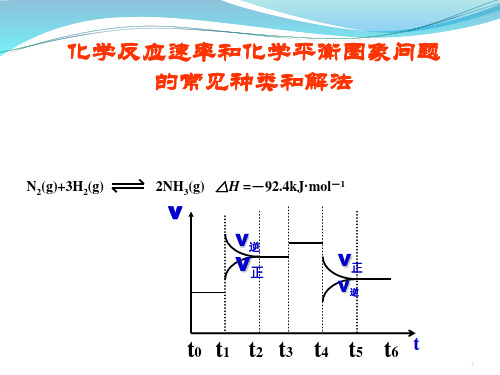



《化学反应的速率和限度》课件23(45张ppt)第三节化学反应的速率和限度化学反应有快有慢:hcl+naoh=nacl+h2o千分之一秒即完成h2+cl2=2hcl百分之一秒即完成救心丹几分钟见效钢铁腐蚀若干年煤、石油等化石燃料的形成几千万年以上定义:化学反应速率用单位时间(如每秒,每分,每小时)内反应物浓度的减小或生成物浓度的增大来表示。
计算式:一、化学反应速率(物质的量浓度)练习巩固= 0.3mol/(l·s)v (nh3) ==例题:反应4nh3+5o2 4no+6h2o 在5升的密闭容器中进行,30秒后,no 的物质的量增加了0.3mol,此反应的平均反应速率用no来表示为多少?问题1:若用o2的浓度变化来表示此反应速率是多少?若用nh3 来表示呢?问题2:此反应化学反应速率用不同物质表示为什么数值不同?数值上有何规律?v(no)=0.002mol/l·sv(o2)=0.0025mol/l·sv(nh3)=0.002mol/l·s化学反应速率的特点—①同一反应,可用不同物质在单位时间内浓度的变化来表示,但必须指明是用哪种反应物或哪种生成物来表示。
②用不同物质在单位时间内浓度变化表示时,速率比等于方程式中的系数比③均取正值,且是某一段时间内的平均速率。
练习向一个容积为1l的密闭容器中放入2molso2和1molo2,在一定条件下反应,2s末,测得容器内有0.8molso2,求2s内so2,o2,so3的反应速率和反应速率比.练习2在一定条件下,ma+nb=pc的反应中,各物质的化学反应速率为v(a)=amol·l-1·s-1,v(b)=a/2mol·l-1·s-1,v(c)=amol·l-1·s-1,则该反应的化学方程式是。
2a+b=2c练习则该反应速率的快慢顺序为:反应 a + 3b = 2c + 2d 在四种不同条件下的反应速率为:(1)ν(a)=0.3mol/(l·s )(2) ν(b)=0.6mol/(l·s)(3) ν(c)=0.4mol/(l·s)(4) ν(d)=0.45mol/(l·s)(1)>(4)>(2)=(3)反思:比较反应的快慢,应取同一参照物在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/l 盐酸反应时,速率最快的是a 镁b 铝c 钠d 铁二、影响化学反应速率的因素§化学反应速率是由反应物的性质决定的;内因是主要因素外因因素:实验2-5产生气泡速率增大,带火星火柴复燃升高温度,反应速率增大有气泡冒出产生气泡速率减小降低温度,反应速率减小规律:当其它条件不变时,升高温度,化学反应速率增大。