HPLC中的手性固定相
- 格式:ppt
- 大小:1.26 MB
- 文档页数:50


液相高效色谱仪原理液相高效色谱仪(High Performance Liquid Chromatography,HPLC)是一种分析仪器,主要用于分离、纯化和定量分析复杂的混合物样品。
其原理基于液相色谱技术,通过样品在流动相(溶液或气体)中的溶解度差异、分配系数差异或化学相互作用的差异,使样品组分在固定相上产生分离。
液相高效色谱仪的主要原理包括以下几个方面:1. 手性固定相:液相高效色谱仪通常使用手性固定相,在其表面上负载具有手性结构的配体或有机小分子。
当样品中的手性分子与手性配体发生相互作用时,会产生分离。
这种原理被广泛应用于药物分离和手性分析领域。
2. 反相色谱:该原理基于样品组分在非极性液相中的溶解度差异。
液相高效色谱仪使用非极性固定相(如疏水的C18链)和极性流动相(如乙腈-水混合溶液)进行分离。
具有较强亲水性的样品成分会更多地溶解于流动相中,而疏水性较强的样品成分则会更多地吸附在固定相上,从而实现样品的分离。
3. 离子交换色谱:该原理基于样品中带电离子与离子交换固定相间的离子交换作用。
液相高效色谱仪使用具有电荷的交换基团(如阴离子交换基团或阳离子交换基团)作为固定相,并通过调节溶液pH值和离子强度来控制样品成分的分离。
4. 尺寸排除色谱:该原理基于样品分子的尺寸差异。
液相高效色谱仪使用具有特定孔径的凝胶固定相,通过排除较大尺寸的样品分子,使较小尺寸的分子优先进入凝胶孔隙并被有效分离。
5. 亲和色谱:该原理基于样品与亲和固定相之间的特异性相互作用。
液相高效色谱仪使用具有特定亲和性的固定相,如亲和树脂或亲和柱,使样品中的目标分子与固定相间的特异亲和作用发生并得到分离。
液相高效色谱仪原理的选择和优化,取决于待分离的样品的特性和目标。
不同的原理可根据样品的需求进行选择,以实现高效、精确和准确的分离和分析。

手性固定相手性HPLC中,手性固定相是实现对映体拆分的基础,并有多种类型。
手性固定相可以根据其化学类型分类为:①“刷型”手性固定相;②手性聚合物固定相;③环糊精类手性固定相;④大环抗生素手性固定相;⑤蛋白质手性固定相;⑥配体交换手性固定相;⑦冠醚手性固定相等。
手性固定相也可以根据它们与被拆分的对映异构体间的作用机制进行分类:第一类是通过氢键、π—π或偶极吸引等相互作用与对映异构体形成配合物进行拆分的手性固定相,N—硝基苯甲酰基氨基酸或N—萘基氨基酸酯手性固定相属于该类;第二类是通过吸引和包合作,用进行拆分的手性固定相,纤维素衍生物手性固定相大都属于该类;第三类是具有手性空穴的手性固定相,对映异构体进入手性空穴后形成包合配合物被拆分,这类手性固定相主要为环糊精,冠醚手性固定相和螺旋型聚合物(如三苯甲基丁烯酸酯)也属于该类;第四类是通过对映异构金属配合物进行拆分的手性固定相,也称为手性配体交换色谱(chiral ligand exchange chromatography,CLEC);第五类是通过疏水和极性相互作用进行手性拆分的蛋白质手性固定相。
手性固定相的分类手性固定相按其分离机理分为以下几类:含有手性空腔的手性固定相:其中包括衍生化纤维素手性固定相、环糊精手性固定相、冠醚手性固定相、合成手性聚合物、手性印迹凝胶相。
纤维素是纯天然高聚物,具有高度有序螺旋状结构。
这种结构可对对映体有一定的识别作用。
将其羟基衍生化后,降低了它的极性,增加了手性固定相与被拆分分子的作用点处的空间位阻,从而改善了它的色谱行为和选择性。
将纤维素衍生化后涂覆或键合于硅胶微球上,增加其机械稳定性。
目前大赛路公司(Daicel)的手性固定相制备技术很成熟。
它现有的商品柱及其性质见下表:其中O系列的都是涂覆型手性固定相;I系列的都是键合型手性固定相。
环糊精为D-吡喃葡萄糖单元以α-1,4-糖苷键相互结合互为椅式构象的环状低聚糖,通常含有6~12个吡喃葡萄糖单元,其中有实用意义的是含有6、7、8个单元的α-CD, β-CD, γ-CD。

高效液相色谱法及其在药物分析中的应用以液体为流动相的色谱法称为液相色谱法。
用常压输送流动相的方法为经典液相色谱法,这种色谱法的柱效能低、分离周期长。
高效液相色谱法(highperformanceliquidchromatography,简称HPLC)是在经典液相色谱的基础上发展起来的一种色谱方法。
与经典的液相色谱法相比,高效液相色谱法具有下列主要优点:①应用了颗粒极细(一般为10µm以下)、规则均匀的固定相,传质阻抗小,柱效高,分离效率高;②采用高压输液泵输送流动相,流速快,一般试样的分析需数分钟,复杂试样分析在数十分钟内即可完成;③广泛使用了高灵敏检测器,大大提高了灵敏度。
目前,已经发展了多种不同的固定相,有多种不同的分离模式,使高效液相色谱法的应用范围不断扩大。
下面介绍高效液相色谱法的有关知识,新的方法和技术以及在药物分析中的应用。
一、分类高效液相色谱法按分离机理的不同可分为以下几类:(一)吸附色谱法(adsorptionchromatography)以吸附剂为固定相的色谱方法称为吸附色谱法。
使用最多的吸附色谱固定相是硅胶,流动相一般使用一种或多种有机溶剂的混合溶剂。
在吸附色谱中,不同的组分因和固定相吸附力的不同而被分离。
组分的极性越大、固定相的吸附力越强,则保留时间越长。
流动相的极性越大,洗脱力越强,则组分的保留时间越短。
(二)液-液分配色谱法(liquid-liquidchromatography)液-液分配色谱的固定相和流动相是互不相溶的两种溶剂,分离时,组分溶入两相,不同的组分因分配系数(K)的不同而被分离。
目前广泛使用的化学键合固定相是将固定液的官能团键合在载体上而制成的,使用化学键合固定相的色谱方法(简称键合相色谱法)可以用分配色谱的原理加以解释。
键合相色谱法在HPLC中占有极其重要的地位,是应用最广的色谱法。
按照固定相和流动相极性的不同,分配色谱法又可分为正相色谱法和反相色谱法两类。

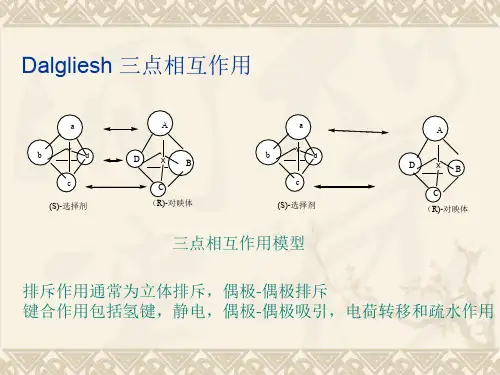

手性药物的分离在色谱法中的应用手性药物是指具有手性结构的药物。
它们可以分为左旋和右旋两种类型,两者化学性质相同,但左右旋异构体对生物系统的影响却截然不同,这种现象被称为手性诱导失活效应。
因此,在制药过程中需要对手性药物进行分离,以确保药效和安全性。
色谱法是分离手性化合物的主要方法之一,其基本原理是利用不同化合物的物理、化学性质差异,通过分离柱将混合物中的目标物分离出来。
以下是一些色谱法在手性药物分离中的应用。
手性高效液相色谱法(HPLC)手性HPLC是目前最常用于手性药物分离的方法之一,它是利用手性固定相在悬浊液中对手性化合物进行分离。
具有手性结构的固定相与目标分子相互作用,从而实现分离。
手性HPLC可以分别采用手性固定相或手性混合物来进行分离。
此外,在手性HPLC中,主要可以采用簇列技术或化学反应转化手性方法来提高分离效率和选择性。
毛细管电泳(CE)毛细管电泳是一种基于电化学原理的分离技术,它利用电场将样品中的分子分离。
在毛细管电泳中,可以采用手性高分辨涂层来进行手性药物的分离。
在此基础上,还可以采用手性化合物作为毛细管填充剂,进一步提高分离效率和分离度。
气相色谱法(GC)气相色谱法是一种利用气体作为流动相的色谱法。
在处理手性药物时,通常需要使用手性柱和手性混合物。
与HPLC不同,该方法的分离依赖于分子间的“挤压”力。
因此,手性柱具有不同的式样,以保证灵敏度和选择性。
超临界流体色谱法(SFC)SFC是一种介于HPLC和GC之间的色谱法。
它使用超临界流体作为移动相,可以在温度和压力条件下实现高效率的手性药物分离。
通常使用手性柱和手性对映异构体混合物进行分离。
此外,还可以应用具有特定分子功能的催化剂来提高分离效率。
总之,手性药物分离是一项非常复杂的任务,需要使用不同的色谱技术和方法来实现。
无论是HPLC、CE、GC还是SFC,它们都有各自的优缺点和适用范围,因此在选择分离方法时需要综合考虑样品特性,实验设备和分离效率与成本等因素。


多糖类手性固定相超临界流体色谱法分离手性化合物李冬艳;吴锡;郝芳丽;杨洋;陈小明【摘要】Eleven kinds of chiral compounds have been well separatedwithin 10 min on poly-saccharide derivative-based chiral stationary phases named Chiralpak IA,IB,IC,ID,IE and IF by supercritical fluid chromatography( SFC). The chiral recognition of these chiral compounds has demonstrated good complementary enantioselectivities of the six chiral columns,which were proved to be useful for chiral SFC. Both the elution time and enantioselectivies could be significantly affected by the modifier types and their concentrations,such as methanol,ethanol and isopropanol,which should be optimized during the experiments. In addition,the solvent versatility of the immobilized chiral stationary phaseon the optimization of the chiral separation was helpful.%采用超临界流体色谱法( SFC),在多糖固定相 Chiralpak IA、IB、IC、ID、IE和IF上成功拆分了11种手性化合物。


药物研究中手性分离分析方法及技巧药物研究中手性分离分析是指将手性药物中的手性异构体(也称为对映体)分离出来,并进行定量分析。
由于手性异构体具有不对称的结构,其物理化学性质和药理活性可能差异巨大,因此手性分离分析对于药物研究具有重要意义。
以下将介绍几种常用的手性分离分析方法及技巧。
1.气相色谱法(GC法):GC法是通过在手性固定相柱上进行气相色谱分析,分离手性异构体。
该方法基于手性碳氢化合物在手性固定相上的不同吸附能力来实现手性分离。
同时,通过合适的手性底物和手性固定相的选择,还可以更好地提高手性分离的选择性和灵敏度。
2.液相色谱法(HPLC法):HPLC法是手性分离分析中最常用的方法之一、常见的手性固定相有手性液相、手性离子对和手性硅胶等。
通过在手性固定相上进行液相色谱分析,利用手性化合物在固定相上的差异相互作用,实现手性分离。
此外,还可以结合负载式手性液相色谱法、手性离子对液相色谱法等技术,提高手性分离效果。
3.毛细管电泳法(CE法):CE法是一种高效、快速的分离技术,特别适用于分析手性药物。
通过在毛细管中施加电场,利用手性化合物在毛细管中的迁移速率差异实现分离。
此外,还可以通过改变运行缓冲液的组成、pH值等条件,调节手性分离的选择性和分离效果。
除了上述主要的手性分离分析方法外,还存在一些辅助技巧和方法,可以进一步提高手性分离的效果:1.共处理:将两个手性化合物混合在一起进行共处理,通过比较混合物中手性峰的相对峰度等信息,来判断手性分离的效果。
2.离子对调整:通过调整分析液中离子对的浓度和种类,来改变手性分离的效果。
一般来说,手性离子对可以提高手性分离的分辨率和选择性。
3.pH调控:通过改变液相色谱系统中溶液的pH值,可以影响毛细管电泳法和液相色谱法中手性分离效果。
pH值的改变可以调节化合物分子的电荷状态,从而影响手性分离的选择性。
总之,手性分离分析方法及技巧在药物研究中起着重要的作用。
通过合理选择合适的手性分离方法,并结合辅助技巧和方法,可以实现对手性异构体的高效、准确的分离和定量分析,从而为药物研究提供有价值的数据。
手性药物的分离在色谱法中的应用手性药物是由手性分子组成的药物,它们的各种生物活性和药效是与它们的绝对构型直接相关的。
在许多情况下,手性药物的两种异构体(左手和右手)的活性和毒性可能截然不同。
因此,对这些药物分子的分离和纯化成为了化学、药物研究领域的一个重要问题。
高效液相色谱法(HPLC)是一种优秀的手性药物分离和纯化的方法,其领先的分辨能力和分离效率使其在药物研究领域崭露头角。
1. 手性药物分离的基本原理手性药物分离的基本原理是结合拥有不同手性的分离柱,例如手性固定相柱和手性选择相柱。
手性固定相柱的分离机理,与分子中原子的手性不同,能产生化学和物理相互作用,因此在不同的分离相互作用下,左手和右手异构体会被分离。
手性选择相柱的分离机理与样品和手性配体的互作用有关,通过配体的稳定性和与样品的选择性作用,达到左右异构体的选择级别不同的以分离目的。
(1)手性固定相柱分离法手性固定相柱分离法是一种基于手性固定相柱的手性药物分离方法,有机合成手法制备的手性固定相柱通常包括手性多醇、手性脂肪酸、手性聚醚和手性多肽等,选择手性固定相柱进行手性分离具有选择性强、效果稳定等特点。
此外,其中含有胆固醇和环糊精等手性结构的化合物也可以应用于该方法。
手性选择相柱从手性配体分离药物,它与手性固定相柱的分离原理有所不同。
手性选择相柱通常包括带有手性标识化合物的蛋白质和不带手性标识的蛋白质。
在hand选择相柱分离中,手性标识的配体与药物分子的性质相似,可以通过配体特异性识别挑选出最终形成单独的物质。
总之,手性药物分离是药物研究和生产中的重要问题。
色谱法是一种优秀的手性药物分离和纯化技术,因其分辨率和分离效率高,在手性药物的制备和应用中具有广泛的应用前景。
色谱技术在手性药物拆分中的应用分析色谱技术是一种广泛应用于化学分析领域的分离和鉴定方法。
在手性药物的研究和开发过程中,色谱技术起着重要的作用。
本文将从手性药物的定义开始,介绍色谱技术在手性药物拆分中的应用分析。
手性药物是指分子结构中存在非对称中心,其分子构型可以存在两个立体异构体,即对映异构体。
这两种立体异构体被称为手性对,分别是左旋异构体和右旋异构体。
右旋异构体通常被称为R体,左旋异构体被称为S体。
在生物体内,由于手性药物与蛋白质、酶等分子的立体选择性相互作用,两个手性异构体的药效、药代动力学和毒理学性质可能存在差异。
拆分手性药物的目的是将其两个手性异构体分离出来,以便对它们进行独立的研究和评价。
色谱技术由于其高效、灵敏、准确和可靠的特点,成为了拆分手性药物的首选方法。
液相色谱技术(HPLC)是最常用的手性药物拆分方法之一。
HPLC通过对手性分子与手性固定相之间的相互作用进行分离。
手性固定相通常是由手性区分聚合物或小分子手性配体涂覆在硅胶微球上形成的。
选择合适的手性固定相和流动相,可以实现对手性药物的定量和定性分离。
气相色谱技术(GC)也可以用于手性药物的拆分。
在GC中,手性药物通常通过在毛细管柱上涂覆手性化合物实现分离。
毛细管柱上的手性化合物会与手性药物产生手性识别作用,从而使两个手性异构体分离。
超高效液相色谱技术(UHPLC)、离子色谱技术(IC)和凝胶渗透色谱技术(GPC)等也可以应用于手性药物的拆分分析。
这些技术可以进一步提高分离效率和灵敏度,并增加对手性药物性质的了解。
色谱技术是一种在手性药物拆分中广泛应用的分析方法。
通过选择合适的手性固定相和流动相,液相色谱和气相色谱都能有效地分离手性药物的两个手性异构体。
超高效液相色谱、离子色谱和凝胶渗透色谱等技术的应用,可以进一步提高分离效率和灵敏度。
这些研究为合理设计和开发手性药物提供了有力的支持。