高一化学化学电源
- 格式:pdf
- 大小:2.25 MB
- 文档页数:11

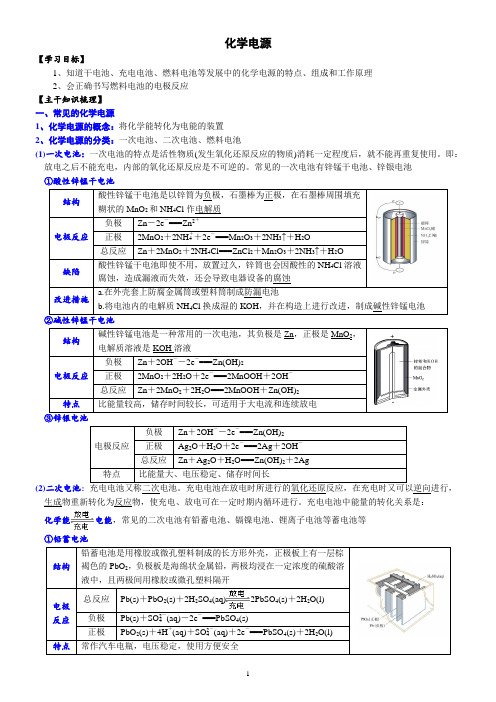
化学电源【学习目标】1、知道干电池、充电电池、燃料电池等发展中的化学电源的特点、组成和工作原理2、会正确书写燃料电池的电极反应【主干知识梳理】一、常见的化学电源1、化学电源的概念:将化学能转化为电能的装置2、化学电源的分类:一次电池、二次电池、燃料电池(1)一次电池:一次电池的特点是活性物质(发生氧化还原反应的物质)消耗一定程度后,就不能再重复使用。
即:放电之后不能充电,内部的氧化还原反应是不可逆的。
常见的一次电池有锌锰干电池、锌银电池①酸性锌锰干电池结构酸性锌锰干电池是以锌筒为负极,石墨棒为正极,在石墨棒周围填充糊状的MnO2和NH4Cl作电解质电极反应负极Zn-2e-===Zn2+正极2MnO2+2NH+4+2e-===Mn2O3+2NH3↑+H2O总反应Zn+2MnO2+2NH4Cl===ZnCl2+Mn2O3+2NH3↑+H2O缺陷酸性锌锰干电池即使不用,放置过久,锌筒也会因酸性的NH4Cl溶液腐蚀,造成漏液而失效,还会导致电器设备的腐蚀改进措施a.在外壳套上防腐金属筒或塑料筒制成防漏电池b.将电池内的电解质NH4Cl换成湿的KOH,并在构造上进行改进,制成碱性锌锰电池②碱性锌锰干电池结构碱性锌锰电池是一种常用的一次电池,其负极是Zn,正极是MnO2,电解质溶液是KOH溶液电极反应负极Zn+2OH--2e-===Zn(OH)2正极2MnO2+2H2O+2e-===2MnOOH+2OH-总反应Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2特点比能量较高,储存时间较长,可适用于大电流和连续放电③锌银电池电极反应负极Zn+2OH--2e-===Zn(OH)2正极Ag2O+H2O+2e-===2Ag+2OH-总反应Zn+Ag2O+H2O===Zn(OH)2+2Ag特点比能量大、电压稳定、储存时间长(2)二次电池:充电电池又称二次电池。
充电电池在放电时所进行的氧化还原反应,在充电时又可以逆向进行,生成物重新转化为反应物,使充电、放电可在一定时期内循环进行。


高中化学《化学电源》在我们的日常生活中,化学电源无处不在,从小小的干电池到为电动汽车提供动力的锂离子电池,它们都在默默地为我们的生活提供便利。
那么,究竟什么是化学电源?它又是如何工作的呢?让我们一起走进这个充满神奇和奥秘的化学世界。
化学电源,简单来说,就是通过化学反应将化学能转化为电能的装置。
这种装置的核心在于其内部发生的氧化还原反应,通过电子的转移产生电流。
最常见的化学电源之一就是干电池。
干电池通常使用锌筒作为负极,石墨棒作为正极。
在电池内部,锌与氯化铵等电解质溶液发生反应,锌原子失去电子变成锌离子,电子通过外电路流向正极,从而形成电流。
而在正极,二氧化锰等物质得到电子发生还原反应。
随着科技的不断发展,蓄电池逐渐成为了我们生活中不可或缺的一部分。
铅蓄电池就是一种常见的蓄电池,它由正极板(二氧化铅)、负极板(铅)和硫酸溶液组成。
在放电过程中,铅与硫酸反应生成硫酸铅,二氧化铅也与硫酸反应生成硫酸铅,同时释放出电能。
而在充电时,这些反应则逆向进行,使电池得以重复使用。
再来说说锂离子电池,这可是现代高科技产品中广泛应用的一种化学电源。
锂离子电池的正极通常是含锂的化合物,如钴酸锂、磷酸铁锂等,负极则大多是石墨。
在充放电过程中,锂离子在正负极之间来回穿梭。
充电时,锂离子从正极脱出,嵌入负极;放电时,锂离子则从负极脱出,回到正极,在这个过程中实现了电能和化学能的相互转化。
燃料电池也是一类重要的化学电源。
与前面提到的电池不同,燃料电池的燃料和氧化剂不是储存在电池内部,而是从外部源源不断地供应。
例如氢氧燃料电池,氢气作为燃料在负极发生氧化反应,氧气在正极发生还原反应,产生电能的同时只生成水,是一种非常清洁的能源。
化学电源的性能指标主要包括电池的电动势、容量、工作温度范围、充放电速率以及使用寿命等。
电动势决定了电池能够提供的电压大小;容量则表示电池能够储存和释放的电荷量;工作温度范围影响着电池的使用环境;充放电速率决定了电池充电和放电的快慢;而使用寿命则关系到电池的经济性和实用性。

