高考化学三轮复习简易通 三级排查大提分 专题七水溶液中的离子平衡训练试题
- 格式:doc
- 大小:92.51 KB
- 文档页数:6

2021届高三化学三轮复习重难点突破 水溶液中的离子平衡练习1.下列关于强弱电解质及非电解质的判断完全正确的是( )D.D2.常温下,下列有关电解质溶液的说法正确的是( )A .向盐酸中滴加氨水,由水电离出的()71H 110mol L c +--=⨯⋅时,溶液可能呈酸性B .加水稀释10.1mol L -⋅的醋酸溶液,溶液中()()+HOH c c ⋅一不变,(H )(OH )c c +-也不变C .10.1mol L -⋅的硫化氢溶液与等浓度的硫化钠溶液的导电能力相同D .120.1mol L Na S -⋅溶液与10.1mol L NaHS -⋅溶液等体积混合后:()()()()()222H S 3H 3OH HS 4S c c c c c +---+=++3.盐类水解在生产、生活中有着广泛的应用。
下列叙述不涉及水解过程的是( )A .用泡沫灭火器灭火B .用FeS 除去废水中的2Pb +C .用明矾净水D .用热碱水去油污4.一定温度下,水存在+2H OH +OH -的平衡,下列叙述一定正确的是( )A. 向水中滴入少量稀盐酸,平衡逆向移动,w K 减小B. 将水加热,w K 增大,pH 减小C. 向水中加入少量固体4NH Cl ,平衡逆向移动,()+H c 降低D. 向水中加入少量固体硫酸钠,()+7H 10mol/L c -=,w K 不变 5.下列说法能证明HA 是弱电解质的是( )A .常温下测得NaA 溶液呈碱性B .常温下测得10.01mol L HA -⋅溶液的pH =2C .HA 的导电性比醋酸弱D .往HA 溶液中滴加甲基橙,溶液显红色6.下列属于水解反应的是( ) A .23HCOOH H O H O HCOO +-++B .323HCO OH H O CO ---++C .223SO H OHSO H -+++ D .3223HCO H O H CO OH --++7.常温下,下列事实能说明HClO 是弱电解质的是( ) A. NaClO 、HClO 都易溶于水B.HClO 与23Na SO 溶液反应,可以得到24Na SOC. NaClO 的电离方程式:NaClO Na ClO +-+D. 10.01mol L -⋅的HClO 溶液2pH > 8.在常温下,纯水中存在电离平衡2H OH OH +-+,若要使水溶液的酸性增强,并使水的电离程度增大,应加入的物质是( ) A .4NaHSOB .()42KAl SOC .3NaHCOD .3CH COONa9.32NH H O ⋅在水溶液中存在电离平衡324NH H O NH OH +-⋅+,下列说法正确的是( )A .加入氯化铵晶体后,溶液的pH 减小B .加入碳酸钠固体,平衡向右移动C .加水稀释,溶液中的离子浓度均减小D .降低温度,()32NH H O b K ⋅增大10.水存在电离平衡:2H O H OH +-+,常温下,w K 的数值为14110-⨯.下列说法不正确的是( )A .常温下,水电离出的 ()()71H OH 10mol L c c +---==⋅B .向水中加入NaCl ,+H 与Cl -结合生成 HCl ,使水的电离平衡向正反应方向移动C .向水中加入HCl 或者NaOH ,水的电离平衡都向逆反应方向移动D .改变温度,w K 也会发生改变 11.下列溶液中,一定呈中性的是( ) A .()()H OH c c -+、均为816.010mol L --⨯⋅的溶液 B .由非电解质溶于水得到的溶液C .等体积、等物质的量浓度的强酸溶液与强碱溶液反应得到的溶液D .常温下将pH=4的盐酸稀释1000倍所得到的溶液 12.下列事实可证明32NH H O ⋅为弱碱的是( ) A .氨水与氯化铝溶液反应生成氢氧化铝沉淀 B .实验测得在氨水中存在32NH H O ⋅分子C .加热氨水能产生使湿润的红色石蕊试纸变蓝的气体D .等浓度、等体积的氨水和NaOH 溶液分别与醋酸中和,消耗的醋酸的量相同13.下列过程没有发生化学反应的是( ) A.用活性炭除去冰箱中的异味 B.用热碱水清除炊具上残留的油污 C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 D.用含硅胶、铁粉的透气小袋与食品一起密封包装 14.下列属于弱电解质的是( ) A .3NaHCOB .32NH H O ⋅C .3AlClD .4CCl15.下列说法不正确的是( )A .2Cl 溶于水得到的氯水能导电,但2Cl 不是电解质B .氯化钠溶液能导电,故氯化钠溶液为电解质C .等浓度的盐酸和醋酸溶液,盐酸溶液的导电能力强D .4BaSO 难溶于水,但溶于水的部分能完全电离,故4BaSO 是强电解质 16.下列相同浓度的溶液中,水电离出的氢离子浓度最大的是( ) A.34CH COONHB.4NH ClC.44NH HSOD.3CH COONa17.下列物质的水溶液因水解而呈酸性的是( ) A .NaOHB .23Na COC .4NaHSOD.()442NH SO18.用已知浓度盐酸滴定未知浓度的NaOH 溶液时,下列操作使测定结果()NaOH C 偏高的是( )A .滴定达终点时,俯视读数B .碱液移入锥形瓶后,加入10mL 蒸馏水C .酸式滴定管用蒸馏水洗涤后,未用标准液润洗D .滴定振荡锥形瓶过程中,有少量溶液溅出19.水中加入少量下列物质,对水的电离平衡不产生影响的是( ) A .3NaHCO B .NaBrC .()42KAl SOD .3NH20.常温下,下列离子浓度关系正确的是( ) A .2Na S 溶液中:()()()()+22Na H S HS 2S c c c c --=++B .将浓度均为0.1 mol/L 的KOH 溶液和3KHSO 溶液等体积混合,所得溶液中:()()()+233(HSO )OH H 2H SO c c c c --=++ C .30.1 mol/L CH COONa 和0.1mol/L NaClO 混合溶液中:()()()+3Na ClO CH COO c c c --=+ D .常温下,加水稀释23Na CO 溶液,()+H c 减小,()OH c -增大 21.下列事实能说明醋酸是弱电解质的是( ) ①醋酸与水能以任意比互溶;①醋酸溶液能导电;①醋酸稀溶液中存在醋酸分子;④常温下,0.1mol/L 醋酸的pH 比0.1mol/L 盐酸的pH 大; A .①③B .①④C .②③D .③④22.下列有关问题,与盐的水解有关的是( ) ①4NH Cl 与2ZnCl 溶液作焊接金属中的除锈剂 ②用3NaHCO 与()243Al SO 两种溶液作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用带磨口玻璃塞的玻璃瓶 ⑤加热蒸干3AlCl 溶液得到()3Al OH 固体 A.①②③B.②③④C.①④⑤D.①②③④⑤23.在酸碱中和滴定实验中,下列操作不会..引起误差的是( ) A .用未干燥的锥形瓶盛装被滴定的待测液 B .滴定管用蒸馏水洗净后直接盛装标准液 C .滴定前平视读数,终点时仰视读数D .滴定管尖嘴处在滴定前有气泡,滴定后无气泡 24.室温时,下列混合溶液的pH 一定小于7的是( )A .pH=3的盐酸和pH=11的氨水等体积混合B .pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合C .pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合D .pH=3的硫酸和pH=11的氨水等体积混合25.下列离子方程式或电离方程式表示的是盐类的水解且正确的是( ) A .223HS H OH O S --+++ B .322HS H O H S H O -++=+ C .23223CO H O H CO 2OH --++D .3++23Fe +3H Fe(OH)O+3H26.下列叙述正确的是( )A.NaOH 溶液能导电,所以NaOH 溶液是电解质B.固体KCl 不导电,所以KCl 不是电解质C.氯化氢的水溶液能导电,所以HCl 是电解质D.2CO 的水溶液能导电,所以2CO 是电解质 27.下列实验与盐类水解无关的是( ) A. FeS 不溶于水,但能溶于稀盐酸中B. 在氯化氢气流中加热蒸发2CuCl 溶液以制备22CuCl 2H O ⋅C. 将饱和3FeCl 溶液滴入沸水中以制备氢氧化铁胶体D. 实验室配制硫化钾溶液时加入适量KOH 溶液 28.计算25①时下列溶液的pH 。

专题七水溶液中的离子平衡(时间:40分钟满分:70分)小题限时满分练一、选择题(本题包括7小题,每小题4分,共28分,限时15分钟;每小题只有一个选项符合题意)1.(仿2013上海高考,11)下列离子方程式中,属于水解反应的是()。
A.HCOOH+OH-===HCOO-+H2OB.CO2+H2O HCO-3+H+C.CO2-3+H2O HCO-3+OH-D.HS-+H2O S2-+H3O+答案 C2.(仿2013天津高考,5)下列叙述正确的是()。
A.在常温下,无论是纯水,还是酸性、碱性或中性稀溶液中,c(H+)·c(OH-)=1×10-14B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱解析B项,温度不确定c(H+)=1×10-7 mol·L-1的溶液不一定为中性;C项中0.2 mol·L-1CH3COOH溶液中的CH3COOH电离程度比0.1 mol·L-1 CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol·L-1CH3COOH 溶液中的c(H+)小于0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍;当c(H+)或c(OH-)大于1 mol·L-1时,用pH表示溶液的酸碱性就不简便了,所以,当c(H+)或c(OH-)大于1 mol·L-1时,一般不用pH表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示。
答案 A3.(仿2013上海高考,19)部分弱酸的电离平衡常数如下表:弱酸HCOOH HCN H2CO3电离平衡常数(25℃) K i=1.77×10-4K i=4.9×10-10K i1=4.3×10-7K i2=5.6×10-11下列选项正确的是()。


水溶液中的离子平衡1.已知部分弱酸的电离平衡常数如下表:下列离子方程式正确的是( )A .少量的CO 2通入NaClO 溶液中:CO 2+H 2O+2ClO ﹣═CO 32﹣+2HClOB .少量的SO 2通入Na 2CO 3溶液中:SO 2+H 2O+2CO 32﹣═SO 32﹣+2HCO 3﹣C .少量的SO 2通入Ca (ClO )2溶液中:SO 2+H 2O+Ca 2++2ClO ﹣═CaSO 3↓+2HClOD .相同浓度的NaHCO 3溶液与NaHSO 3溶液等体积混合:H ++HCO 3﹣═CO 2↑+2H 2O【答案】B【解析】弱酸的电离平衡常数越大,其酸性越强,酸的电离平衡常数H 2SO 3>CH 3COOH >H 2CO 3>HSO 3->HClO >HCO 3-,则酸性:H 2SO 3>CH 3COOH >H 2CO 3>HSO 3->HClO >HCO 3-。
A .酸性:H 2CO 3>HClO>HCO 3−,所以少量的CO 2通入NaClO 溶液中:CO 2+H 2O+ClO −═HCO 3−+HClO ,故A 错误;B .酸性:H 2SO 3>H 2CO 3>HSO 3−,所以少量的SO 2通入Na 2CO 3溶液中:SO 2+H 2O+2CO 32−═SO 32−+2HCO 3−,故B 正确;C .HClO 具有强氧化性,能把二氧化硫氧化为硫酸,所以少量的SO 2通入Ca(ClO)2溶液中不生成CaSO 3,故C 错误;D.酸性:H 2CO 3>HSO 3−,NaHCO 3溶液与NaHSO 3溶液混合不能生成二氧化碳气体,故D 错误;答案选B 。
2.已知298K 时,K sp (NiS)=-212-21.010mol L ⋅⨯,K sp (NiCO 3)=-72-21.010mol L ⋅⨯; p(Ni)=-lg c (Ni 2+),p(B)=-lg c (S 2-)或-lg c (23CO -)。
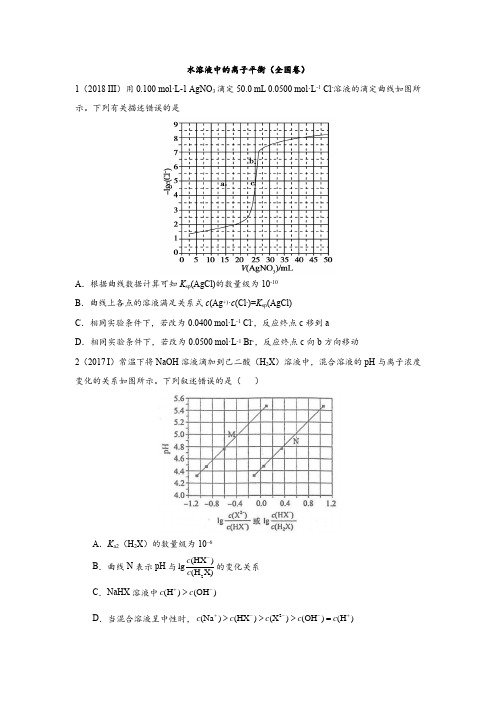
水溶液中的离子平衡(全国卷)1(2018 III )用0.100 mol·L-1 AgNO 3滴定50.0 mL 0.0500 mol·L -1 Cl -溶液的滴定曲线如图所示。
下列有关描述错误的是A .根据曲线数据计算可知K sp (AgCl)的数量级为10-10B .曲线上各点的溶液满足关系式c (Ag +)·c (Cl -)=K sp (AgCl)C .相同实验条件下,若改为0.0400 mol·L -1 Cl -,反应终点c 移到aD .相同实验条件下,若改为0.0500 mol·L -1 Br -,反应终点c 向b 方向移动2(2017 I )常温下将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是( )A .K a2(H 2X )的数量级为10–6B .曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系C .NaHX 溶液中(H )(OH )c c +->D .当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=3(2017 II )改变0.11mol L -⋅二元弱酸2H A 溶液的pH ,溶液中的2H A 、HA -、2A-的物质的量分数(X)δ随pH 的变化如图所示[已知22(X)(X)(H A)(HA )(A )c c c c δ--=++]。
下列叙述错误的是( )A .pH=1.2时,2(H A)(HA )c c -= B .22lg[(H A)] 4.2K =-C .pH=2.7时,22(HA )(H A)(A )c c c -->=D .pH=4.2时,2(HA )(A )(H )c c c --+==4(2017 III )在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。

高考化学提高题专题复习化水溶液中的离子平衡练习题含答案一、水溶液中的离子平衡1.叠氮化钠(NaN3)是一种白色剧毒晶体,是汽车安全气囊的主要成分。
NaN3易溶于水,微溶于乙醇,水溶液呈弱碱性,能与酸发生反应产生具有爆炸性的有毒气体叠氮化氢。
实验室可利用亚硝酸叔丁酯(t-BuNO2,以t-Bu表示叔丁基)与N2H4、氢氧化钠溶液混合反应制备叠氮化钠。
(1)制备亚硝酸叔丁酯取一定NaNO2溶液与50%硫酸混合,发生反应H2SO4+2NaNO2===2HNO2+Na2SO4。
可利用亚硝酸与叔丁醇(t-BuOH)在40℃左右制备亚硝酸叔丁酯,试写出该反应的化学方程式:____________。
(2)制备叠氮化钠(NaN3)按如图所示组装仪器(加热装置略)进行反应,反应的化学方程式为:t-BuNO2+NaOH+N2H4===NaN3+2H2O+t-BuOH。
①装置a的名称是______________;②该反应需控制温度在65℃,采用的实验措施是____________________;③反应后溶液在0℃下冷却至有大量晶体析出后过滤。
所得晶体使用无水乙醇洗涤。
试解释低温下过滤和使用无水乙醇洗涤晶体的原因是____________。
(3)产率计算①称取2.0g叠氮化钠试样,配成100mL溶液,并量取10.00mL溶液于锥形瓶中。
②用滴定管加入0.10mol·L-1六硝酸铈铵[(NH4)2Ce(NO3)6]溶液40.00mL(假设杂质均不参与反应)。
③充分反应后将溶液稀释并酸化,滴入2滴邻菲罗啉指示液,并用0.10mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]为标准液,滴定过量的Ce4+,终点时消耗标准溶液20.00mL(滴定原理:Ce4++Fe2+===Ce3++Fe3+)。
已知六硝酸铈铵[(NH4)2Ce(NO3)6]与叠氮化钠反应生成硝酸铵、硝酸钠、氮气以及Ce(NO3)3,试写出该反应的化学方程式____________________________;计算叠氮化钠的质量分数为________(保留2位有效数字)。
2021届高考化学三轮知识点强化—水溶液中的离子平衡训练1.25℃时,若10体积pH=a 的某强酸溶液与1体积pH=b 的某强碱溶液混合后溶液呈中性,则混合之前两溶液的pH 之间的关系是( )A.a+b=14B.a+b=13C.a+b=15D.a+b=72.已知室温时,0.1mol·L -1某一元酸HA 在水中有0.1%发生电离,下列叙述错误的是( )A.该溶液的pH=4B.升高温度,溶液pH 增大C.此酸的电离平衡常数约为-7110⨯D.由HA 电离出的+()H c 约为水电离出的+()H c 的610倍3.在0.11mol L -的HCN 溶液中存在如下电离平衡:HCNH CN +-+,下列叙述正确的是( )A.加入少量NaOH 固体,平衡正向移动B.加水,平衡逆向移动C.滴加少量0.1 1mol L -的HCl 溶液,溶液中()H c +减小D.加入少量NaCN 固体,平衡正向移动4.某温度下,pH 相同的盐酸和醋酸溶液分别加水稀释,两溶液的pH 随溶液体积变化的曲线如图所示,据图判断,下列说法正确的是( )A.Ⅱ为盐酸稀释时的pH 变化曲线B.b 点溶液的导电性比c 点溶液的导电性强C.a 点溶液与b 点溶液的导电能力相同D.b 点酸溶液的总浓度大于a 点酸溶液的总浓度5.已知:25℃时,K sp [Mg(OH)2]=5.61×10-12,K sp [MgF 2]=7.42×10-11,下列说法正确的是( )A.25℃时,饱和Mg(OH)2溶液与饱和MgF 2溶液相比,前者的c(Mg 2+)大B.25℃时,在Mg(OH)2悬浊液中加入少量的NH 4Cl 固体, c(Mg 2+)增大C.25℃时,Mg(OH)2固体在20mL 0.01 mol/L 氨水中的K sp 比在20mL 0.01mol/L NH 4Cl 溶液中的K sp 小D.25℃时,在Mg(OH)2悬浊液中加入NaF 溶液后,Mg(OH)2不可能转化为MgF 26.下列叙述中正确的是( )A.pH=11的NaOH 和Na 2S 溶液中水的电离程度前者大于后者B.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉C.25℃,Cu(OH)2在水中的溶度积和溶解度比其在Cu(NO 3)2溶液中的大D.向FeCl 3+3KSCN Fe(SCN)3+3KCl 平衡体系中加入少量KCl 固体,溶液血红色变浅7.-10.1mol L ⋅的8种物质的溶液:①3HNO ②24H SO ③3CH COOH ④2Ba(OH)⑤NaOH ⑥3CH COONa ⑦KCl ⑧4NH Cl ,其溶液的pH 由小到大的顺序是( )A.③⑧②①⑥⑤⑦④B.②①③⑧⑦⑥⑤④C.②③⑧①④⑦⑥⑤D.①②③⑧⑦④⑥⑤8.下列有关电解质溶液的说法正确的是( )A.向0.1-13mol L CH COOH ⋅溶液中加入少量水,溶液中+3(H )(CH COOH)c c 减小 B.将3CH COONa 溶液从20℃升温至30℃,溶液中-3-3(CH COO )(CH COOH)(OH )c c c ⋅增大 C.向盐酸中加入氨水至中性,溶液中+4-(NH )1(Cl )c c > D.向AgCl 、AgBr 的饱和溶液中加入少量3AgNO ,溶液中--(Cl )(Br )c c 不变9.25℃时,向20.00mL 的NaOH 溶液中逐滴加入某浓度的CH 3COOH 溶液,滴定过程中,溶液的pH 与滴入CH 3COOH 溶液的体积关系如图所示,点②时NaOH 溶液恰好被中和。
题型七水溶液中的离子平衡1.下列说法中不正确的是()A.pH=a的氨水,稀释至原体积的10倍后,其pH=b,则b<a-1B.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):③<②<①C.某温度下,K sp(Ag2S)=6×10-50,K sp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×1037D.一定浓度的NaHS溶液中:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S)答案A解析NH3·H2O是弱碱,稀释将导致NH3·H2O电离程度增大,原有的NH3·H2O部分电离,pH=b>a-1,A错误。
由于酸性:CH3COOH>H2CO3>HClO,所以浓度相同的CH3COONa、NaHCO3、NaClO溶液,NaClO溶液水解程度最大,碱性最强pH最大,那么要使三种溶液pH相同,则三种溶液中c(Na+):③<②<①,B正确。
K=--=----=6.7×1037,C正确。
对于NaHS溶液,根据电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),根据Na与S元素原子数的等量关系,c(Na+)=c(H2S)+c(HS-)+c(S2-),以第二个式子的c(S2-)=c(Na+)-c(H2S)-c(HS-)代入第一个式子,化简得到c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S),D正确。
2.室温下,浓度均为0.1 mol·L-1、体积均为V0的HA、HB溶液,分别加水稀释至V,pH随lg的变化如图所示,下列说法正确的是()A.HA为强酸,HB为弱酸B.水的电离程度a点大于b点C.当pH=2时,HA溶液中=9-D.等浓度等体积的HB与NaOH溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-)答案C解析由图示可知,室温下浓度相等的HA和HB,HA的溶液pH小,即HA的酸性比HB的强,但0.1 mol·L-1 HA的pH=2,说明HA也为弱酸,A错误。
1.【2018新课标3卷】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【答案】C【解析】分析:本题应该从题目所给的图入手,寻找特定数据判断题目中的沉淀滴定的具体过程。
注意:横坐标是加入的硝酸银溶液的体积,纵坐标是氯离子浓度的负对数。
C.滴定的过程是用硝酸银滴定氯离子,所以滴定的终点应该由原溶液中氯离子的物质的量决定,将50mL0.05mol/L的Cl-溶液改为50mL 0.04mol/L的Cl-溶液,此时溶液中的氯离子的物质的量是原来的0.8倍,所以滴定终点需要加入的硝酸银的量也是原来的0.8倍,因此应该由c点的25mL变为25×0.8=20mL,而a点对应的是15mL,选项C错误。
点睛:本题虽然选择了一个学生不太熟悉的滴定过程——沉淀滴定,但是其内在原理实际和酸碱中和滴定是一样的。
这种滴定的理论终点都应该是恰好反应的点,酸碱中和滴定是酸碱恰好中和,沉淀滴定就是恰好沉淀,这样就能判断溶液发生改变的时候,滴定终点如何变化了。
2.【2018北京卷】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确...的是A.Na2SO3溶液中存在水解平衡:+H2O+OH−B.④的pHC.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的K w值相等【答案】C【解析】分析:A项,Na2SO3属于强碱弱酸盐,SO32-存在水解平衡;B项,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多,说明实验过程中部分Na2SO3被氧化成Na2SO4,①与④温度相同,④与①对比,SO32-浓度减小,溶液中c(OH-),④的pH小于①;C项,盐类水解为吸热过程,①→③的过程,升高温度SO32-水解平衡正向移动,c(SO32-)减小,水解平衡逆向移动;D项,K w只与温度有关。
专题七 水溶液中的离子平衡请同学们根据老师阅卷需要把选择题的答案填入答题栏中。
一、单项选择题(本大题共6小题,每小题4分,共24分。
每小题只有1个选项符合题目要求) 1.(2012·潮州期末)关于0.1mol ·L -1NH 4Cl 溶液,下列说法正确的是( ) A.升高温度,溶液的pH 升高B.向溶液中加适量氨水使混合液的pH=7,则混合液中c(N 4H +)>c(Cl -)C.向溶液中加滴加几滴浓盐酸,c(N 4H +)减小 D.向溶液中加入少量CH 3COONa 固体,c(N 4H +)减小2.(2011·广州二模)在一定条件下Na 2CO 3溶液存在水解平衡C 2-3O +H 2O HC-3O +OH -。
下列说法正确的是( )A.Na 2CO 3溶液中:c(Na +)>c(C2-3O )>c(OH -)>c(H +)B.升高温度,平衡向逆反应方向移动C.稀释溶液,溶液中c(H +)和c(OH -)都减小 D.加入NaOH 固体,溶液pH 减小3.(2012·天津高考)下列有关电解质溶液的叙述正确的是( ) A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 B.在含有BaSO 4沉淀的溶液中加入Na 2SO 4固体,c(Ba 2+)增大 C.含1molKOH 的溶液与1molCO 2完全反应后,溶液中c(K +)=c(HC-3O )D.在CH 3COONa 溶液中加入适量CH 3COOH,可使c(Na +)=c(CH 3COO -)4.(2012·四川高考)常温下,下列溶液中的微粒浓度关系正确的是( ) A.新制氯水中加入固体NaOH:c(Na +)=c(Cl -)+c(ClO -)+c(OH -) B.pH=8.3的NaHCO 3溶液中:c(Na +)>c(HC-3O )>c(C2-3O )>c(H 2CO 3)C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl -)=c(N4H +)>c(OH -)=c(H +)D.0.2mol ·L -1CH 3COOH 溶液与0.1mol ·L -1NaOH 溶液等体积混合: 2c(H +)-2c(OH -)=c(CH 3COO -)-c(CH 3COOH)5.(2012·广州一模)对于0.1mol ·L -1NH 4Cl 溶液,正确的是( ) A.升高温度,溶液的pH 升高B.通入少量HCl,c(N 4H +)和c(Cl -)均增大C.c(N 4H +)+c(OH -)=c(Cl -)+c(H +) D.c(Cl -)>c(H +)>c(N 4H +)>c(OH -)6.(2011·茂名模拟)25℃时,在20mL0.1mol ·L -1氢氧化钠溶液中,逐滴加入0.2mol ·L -1CH 3COOH,溶液pH 的变化曲线如右图所示,有关粒子浓度关系的比较不正确的是( ) A.B 点时,c(Na +)>c(CH 3COO -)>c(OH -)>c(H +) B.C 点时,c(CH 3COO -)=c(Na +)>c(H +)=c(OH -) C.D 点时,c(CH 3COO -)+c(CH 3COOH)=2c(Na +)D.对曲线上A 、B 间任何一点,溶液中都有:c(Na +)>c(CH 3COO -)>c(OH -)>c(H +)二、双项选择题(本大题共2小题,每小题6分,共12分。
专题七水溶液中的离子平衡(时间:40分钟满分:70分)小题限时满分练一、选择题(本题包括7小题,每小题4分,共28分,限时15分钟;每小题只有一个选项符合题意)1.(仿2013上海高考,11)下列离子方程式中,属于水解反应的是()。
A.HCOOH+OH-===HCOO-+H2OB.CO2+H2O HCO-3+H+C.CO2-3+H2O HCO-3+OH-D.HS-+H2O S2-+H3O+答案 C2.(仿2013天津高考,5)下列叙述正确的是()。
A.在常温下,无论是纯水,还是酸性、碱性或中性稀溶液中,c(H+)·c(OH-)=1×10-14B.c(H+)=1×10-7 mol·L-1的溶液一定是中性溶液C.0.2 mol·L-1 CH3COOH溶液中的c(H+)是0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍D.任何浓度的溶液都可以用pH来表示其酸碱性的强弱解析B项,温度不确定c(H+)=1×10-7 mol·L-1的溶液不一定为中性;C项中0.2 mol·L -1CH3COOH溶液中的CH3COOH电离程度比0.1 mol·L-1CH3COOH溶液中的CH3COOH电离程度小,所以,0.2 mol·L-1 CH3COOH溶液中的c(H+)小于0.1 mol·L-1 CH3COOH溶液中的c(H+)的2倍;当c(H+)或c(OH-)大于1 mol·L-1时,用pH表示溶液的酸碱性就不简便了,所以,当c(H+)或c(OH-)大于1 mol·L-1时,一般不用pH表示溶液的酸碱性,而是直接用c(H+)或c(OH-)来表示。
答案 A3.(仿2013上海高考,19)部分弱酸的电离平衡常数如下表:()。
A.2CN-+H2O+CO2===2HCN+CO2-3B.2HCOOH+CO2-3===2HCOO-+H2O+CO2↑C.等浓度的HCOONa和NaCN溶液的pH前者大于后者D.中和等浓度的HCOOH和HCN消耗NaOH的量前者等于后者解析根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO-3,A错误,B正确;等浓度时,NaCN的水解程度大于HCOONa的水解程度,因此NaCN溶液的pH大于HCOONa溶液的pH,C错误;等浓度的HCOONa溶液和NaCN溶液,各自的体积未知,消耗的NaOH的量也就不确定,D错误。
答案 B4.(仿2013重庆高考,2)下列说法不正确的是() A.KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质B.25 ℃时,用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>V NaOHC.向AlCl3溶液中滴加NaHCO3溶液,有沉淀和气体生成D.AgCl沉淀易转化为AgI沉淀且K(AgX)=c(Ag+)·c(X-),故K(AgI)<K(AgCl)解析A项,SO3为非电解质,错误。
B项,若V醋酸=V NaOH,则pH>7,若pH=7,应醋酸过量,V醋酸应大于V NaOH,正确。
C项,向AlCl3溶液中滴加NaHCO3溶液,离子方程式为Al3++3HCO-3===Al(OH)3↓+3CO2↑,正确。
D项,对于同种类型的难溶电解质,沉淀易向K sp小的方向转化,正确。
答案 A5.(仿2012海南高考,8)下列有关问题,与盐类的水解有关的是()。
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al(OH)3固体A.①②③B.②③④C.①④⑤D.①②③④⑤答案 D6.(仿2013天津高考,4)用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)()。
A.酸式滴定管未用标准盐酸润洗B.滴定过程中不慎有液体溅出C.滴定前仰视读数,滴定后读数正确D.碱式滴定管未用待测液润洗解析A项造成标准盐酸浓度变小,所需体积增大,测定结果偏高;B项使消耗盐酸的体积增大,测定结果偏高;C项造成体积小,如果是酸滴定未知浓度的NaOH溶液造成测定结果偏低,如果是未知浓度的NaOH溶液滴定酸,则测定结果偏高。
答案 D7.(仿2013山东高考,13)常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。
则下列各项正确的是()。
A.混合前:pH(CH3COOH)+pH(NaOH)=14B.混合后:c(Na+)=c(CH3COO-)+c(OH-)C.混合前:c(CH3COOH)>c(NaOH)D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)解析混合前,若pH(CH3COOH)+pH(NaOH)=14,则,c(H+)=c(OH-),CH3COOH 为弱电解质,部分电离,c(CH3COOH)比c(NaOH)大得多,混合后不会呈中性而是呈酸性,故A不正确,C正确;混合后溶液呈中性,则c(H+)=c(OH-),根据电荷守恒,c(Na +)=c(CH3COO-),故B、D不正确。
答案 C大题限时争分练二、非选择题(本题包括3小题,共42分,限时25分钟)8.(仿2012北京高考,25)(12分)现有浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸溶液、③氢氧化钠溶液、④氯化铵溶液、⑤醋酸铵溶液、⑥硫酸铵溶液、⑦硫酸氢铵溶液、⑧氨水,请回答下列问题:(1)①、②、③、④四种溶液中由水电离出的H +浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH +4浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
A .c (Na +)=c (Cl -)>c (OH -)>c (NH +4) B .c (Na +)=0.1 mol·L -1C .c (Na +)+c (NH +4)=c (Cl -)+c (OH -) D .c (H +)>c (OH -)解析 (1)①、②、③抑制水的电离,①中c (H +)=0.2 mol·L -1,②中c (H +)<0.1 mol·L-1,③中c (OH -)=0.1 mol·L -1,④促进水的电离,故四种溶液中由水电离出的H +浓度由大到小的顺序是④②③①。
(2)NH 4HSO 4溶液中,H +抑制NH +4水解,CH 3COONH 4溶液中,CH 3COO -促进NH +4的水解,NH 3·H 2O 是弱电解质,电离产生极少的NH +4,故四种溶液中NH +4浓度由大到小的顺序为⑦④⑤⑧。
(3)NaOH 溶液和NH 4Cl 溶液等浓度等体积混合:NaOH +NH 4Cl===NaCl +NH 3·H 2O ,c (Na +)=c (Cl -)=0.05 mol·L -1,c (OH-)=c (NH +4)+c (H +),A 正确,B 错误。
根据电荷守恒,C 错误。
溶液显碱性c (OH -)>c (H +),D 错误。
答案 (1)④②③① (2)⑦④⑤⑧ (3)A9.(仿2013广西高考,12)(13分)下表是不同温度下水的离子积的数据:(1)若25<t 1<t 2,则a ________1×10-14(填“>”、“<”或“=”),做此判断的理由是__________________。
(2)25 ℃时,某Na 2SO 4溶液中c (SO 2-4)=5×10-4 mol·L -1,取该溶液1 mL 加水稀释至10 mL ,则稀释后溶液中c (Na +)∶c (OH -)=________。
(3)在t 2温度下测得某溶液pH =7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH =11的NaOH 溶液a L 与pH =1的H 2SO 4溶液b L 混合,若所得混合液pH =2,则a ∶b =________。
解析 (2)c (Na +)=2×5×10-4 mol·L -1×1 mL 10 mL =1.0×10-4 mol·L -1,而25 ℃时水电离出来的c (OH -)=1.0×10-7 mol·L -1,所以c (Na +)∶c (OH -)=(1.0×10-4)∶(1.0×10-7)=1 000∶1。
(3)t 2温度下,pH =6的溶液呈中性,则pH =7的溶液显碱性。
若所得混合液pH=2,即酸过量,c(H+)=1×10-1 mol·L-1×b L-1×10-121×10-11mol·L-1×a L(a+b) L=1×10-2 mol·L-1,则a∶b=9∶11。
答案(1)>温度升高,水的电离程度增大,离子积增大(2)1 000∶1(3)碱9∶11 10.(仿2013北京高考,10)(17分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。
工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)Sr2+(aq)+SO2-4(aq)K sp=2.5×10-7SrCO3(s)Sr2+(aq)+CO2-3(aq)K sp=2.5×10-9(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是________________。
(用沉淀溶解平衡的有关理论解释)(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率。
判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):①升高温度,平衡常数K将________;②增大CO2-3的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为___。