高中化学芳香烃
- 格式:ppt
- 大小:658.00 KB
- 文档页数:19

第三节芳香烃课标·内容要求课标·学业要求1.认识芳香烃的组成和结构特点,会比较苯与其同系物组成、结构和性质的差异。
2.知道加成、取代、氧化、还原反应等反应类型和芳香烃组成结构特点的关系。
3.结合生产生活了解芳香烃对环境、健康可能产生的影响,知道其在生产、生活中的重要应用1.理解苯及其简单同系物的结构特点及化学性质,能举例说明有机化合物中官能团之间的相互影响。
2.通过实验探究,掌握溴苯和硝基苯的制备原理及注意事项。
3.知道芳香烃组成、结构和性质的差异,认识芳香烃在日常生活、化工生产中的作用教材梳理·概念认知知识点一苯1.芳香烃:在烃类化合物中,含有一个或多个苯环的化合物。
苯是最简单的芳香烃。
2.苯的物理性质与应用(1)物理性质无色,有特殊气味的液体,有毒,不溶于水。
苯易挥发,沸点为80.1 ℃,熔点为5.5 ℃,常温下密度为0.88 g·cm-3。
(2)应用:苯是一种重要的化工原料和有机溶剂。
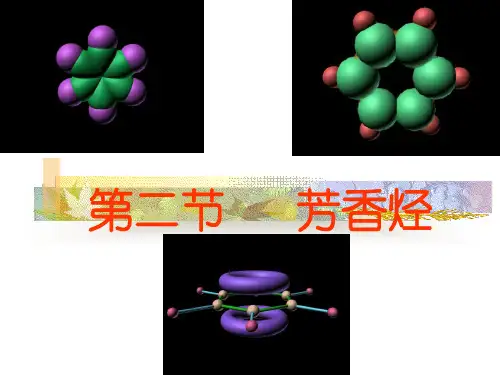
3.苯的分子结构(1)分子组成和结构的不同表示方法:(2)空间结构①苯的空间构型是平面正六边形。
②六个碳原子均采取sp2杂化,分别与氢原子及相邻碳原子以σ键结合,键间夹角均为120°,连接成六元环。
每个碳碳键的键长相等,介于碳碳单键和碳碳双键之间。
③每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
4.苯的化学性质(1)稳定性:苯的结构稳定,苯不与酸性KMnO4溶液、溴水反应,但苯可以萃取溴水中的溴。
(2)氧化反应:燃烧时产生浓重的黑烟,反应方程式:2C6H6+15O212CO2+6H2O。
(3)取代反应①卤代反应:苯与液溴在FeBr3催化条件下的反应。
反应方程式为+Br2+HBr↑。
溴苯():无色液体,有特殊气味,不溶于水,密度比水的大。
②硝化反应:苯在50~60℃的温度下与浓硝酸在浓硫酸催化条件下的反应。


高中化学选修芳香烃教案
目标:学生能够理解芳香烃的基本性质、结构、性质、制备方法和应用,并能够解决相关问题。
一、导入(5分钟)
1. 引导学生回顾已学过的碳氢化合物知识,引出芳香烃的概念。
2. 提问:你知道什么是芳香烃吗?它有什么特点?
二、学习芳香烃的结构(15分钟)
1. 讲解苯环的结构和特点。
2. 介绍芳香烃的一般结构。
3. 展示一些常见的芳香烃分子结构。
三、芳香烃的性质(20分钟)
1. 辅导学生了解芳香烃的物理性质和化学性质。
2. 通过实验示范,展示芳香烃的燃烧性质和化学反应。
四、芳香烃的制备方法(15分钟)
1. 讲解芳香烃的制备方法,包括直接蒸馏、加氢、硝化等方法。
2. 分析各种制备方法的适用性和优缺点。
五、芳香烃的应用(10分钟)
1. 分析芳香烃在日常生活和工业中的广泛应用。
2. 探讨芳香烃在材料制备、化工生产等领域的重要作用。
六、总结与讨论(10分钟)
1. 总结本节课学习的重点内容。
2. 提出问题,进行讨论,激发学生对芳香烃的兴趣。
3. 鼓励学生学习更多关于芳香烃的知识,提出更多问题。
七、作业布置(5分钟)
1. 布置相关阅读作业,加深学生对芳香烃的理解。
2. 提出问题,供学生下节课讨论。
教案结束。


第二节芳香烃第三节李度一中陈海思一、芳香烃1、定义:结构上由苯环和烷基组成的烃叫做芳香烃,包含苯2、苯的同系物:苯的同系物是苯环上的氢原子被烷基所取代的产物,在性质上与苯有相似之处。
芳香烃包含苯的同系物3、苯的同系物的基本概念通式:CnH2n-6结构特点:只含有一个苯环,以苯环为主体,烷基为侧链状态:液体或固体,一般都带有特殊气味4、代表物质:芳香烃:苯苯的同系物:甲苯二、苯1、基本结构化学式:C6H6 结构简式:(凯库勒式)或苯分子中并没有碳碳双键,不饱和度:42、物理性质无色,液体,带有特殊气味,密度比水小,难溶于水,易挥发,有毒3、化学性质1)氧化反应2C6H6+15O2 → 12CO2+6H2O (带浓烟)2)取代反应a、与液溴反应:需要加入少量铁粉,铁与液溴生成溴化铁,溴化铁可以催化苯的溴代(Fe做催化剂)+Br2 → +HBrb、与浓硝酸反应(硝化反应)反应需要浓硫酸催化和吸水(浓硫酸为催化剂和吸水剂)+HO—NO2 → +H2O3)加成反应苯在一定条件下可与氢气加成,生成环己烷(Ni做催化剂)+3H2 →三、甲苯1、基本结构化学式:C7H8,结构简式:不饱和度:42、物理性质无色,液体,无味,密度比水小,难溶于水,有毒3、化学性质1)氧化反应燃烧:C7H8+9O2 → 7CO2+4H2O (带浓烟)KMnO4氧化:侧链上的甲基被氧化为羧基2)取代反应苯环上的取代:与液溴混合反应,FeBr3催化+3Br2 → +3HBr侧链上的取代:与氯气在光照条件下+Cl2 → +HCl硝化反应:在浓硫酸和浓硝酸共热情况下反应+3HO-NO2 → +3H2O2,4, 6 –三硝基甲苯简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色的晶体,不溶于水。
它是一种烈性炸药,广泛用于国防开矿、筑路、兴修利等。
3)加成反应:一定条件下与氢气催化加成+3H2 →四、苯、甲苯的结构以及性质的相似点和不同点苯甲苯结构相同点都含有苯环结构不同点苯环上无取代基含甲基分子间的关系结构相似,组成相差CH2,互为同系物化学性质Br2的CCl4 不反应不反应KMnO4(H+)不反应被氧化溶液褪色浓HNO3、浓H2SO4混合液硝化硝化【素材积累】1、成都,是一个微笑的城市,宁而美丽。

高中化学教案芳香烃
教学目标:
1. 了解芳香烃的定义和结构特点。
2. 掌握芳香烃的命名规则和性质。
3. 理解芳香族化合物的反应类型和应用领域。
教学重点和难点:
重点:芳香烃的结构、命名和性质。
难点:芳烃的反应类型和应用领域。
教学准备:
1. 教学用具:投影仪、幻灯片、化学试剂。
2. 实验器材:试管、试管架、酸碱试剂。
教学过程:
一、导入(5分钟)
通过展示芳烃的结构式引出本节课的主题,让学生了解芳烃的特点和重要性。
二、讲解(15分钟)
1. 讲解芳烃的定义和结构特点。
2. 讲解芳烃的命名规则和性质。
三、实验(20分钟)
进行一些简单的实验,如用溴水测试芳烃和脂肪烃的区别,让学生亲身感受芳烃的性质。
四、讨论(15分钟)
与学生讨论芳烃的反应类型和应用领域,引导学生思考芳烃在日常生活和工业生产中的重要性。
五、总结(5分钟)
总结本节课的重点内容,巩固学生的知识点。
六、作业布置(5分钟)
布置相关练习题,巩固学生所学内容。
教学反思:
通过本节课的教学,学生对芳烃有了更深入的了解,同时也激发了学生对化学的兴趣,提高了他们的学习积极性。
在以后的教学中,可以增加实验环节和案例分析,进一步巩固学生的知识。
同时,要关注学生的学习情况,及时进行反馈和指导。


《芳香烃》说课稿尊敬的各位评委老师:大家好!今天我说课的内容是《芳香烃》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析《芳香烃》是高中化学选修 5《有机化学基础》中的重要内容。
在有机化学的学习中,烃是一类非常重要的有机化合物,而芳香烃则是具有特殊结构和性质的烃类。
通过对芳香烃的学习,学生可以进一步深化对有机物结构与性质关系的理解,为后续学习更复杂的有机化合物奠定基础。
本节课主要介绍了苯的结构、性质以及苯的同系物。
教材首先通过实验引出苯的物理性质和化学性质,然后通过对苯分子结构的探讨,揭示了苯的特殊稳定性。
在介绍苯的同系物时,教材重点强调了其与苯在结构和性质上的相似性和差异性,使学生能够形成对比和归纳的思维方式。
二、学情分析学生在之前的学习中已经掌握了烃的基本概念和一些简单烃类的性质,具备了一定的有机化学基础知识和实验操作能力。
但对于苯这种具有特殊结构和性质的芳香烃,学生可能会感到抽象和难以理解。
因此,在教学过程中,需要通过实验、模型等直观手段帮助学生突破难点,激发学生的学习兴趣。
三、教学目标1、知识与技能目标(1)了解苯的物理性质和化学性质,掌握苯的结构特点。
(2)理解苯的同系物的概念,掌握苯的同系物的性质。
(3)能够书写苯及其同系物的化学反应方程式。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析问题的能力。
(2)通过对苯分子结构的探讨,培养学生的空间想象能力和逻辑思维能力。
3、情感态度与价值观目标(1)通过对芳香烃的学习,让学生感受有机化学的魅力,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和创新精神。
四、教学重难点1、教学重点(1)苯的结构特点和化学性质。
(2)苯的同系物的性质。
2、教学难点(1)苯分子结构的特殊性。
(2)苯的加成反应和取代反应的原理。
五、教法与学法1、教法(1)实验探究法:通过实验让学生直观地感受苯的物理性质和化学性质,激发学生的学习兴趣。

高中化学芳香烃知识点
一、芳香烃
1、芳香烃的概念
芳香烃是指它们在一定条件下具有芳香气味的有机化合物,也称为芳构烃、芳族烃或香豆烃。
芳香烃具有共轭双键环结构,并具有芳香性和固态稳定性。
芳香烃有C6-C14碳数的化合物。
2、芳香烃的特性
1)共轭双键结构。
芳香烃是有机化合物,而共轭双键结构是它
们的特征结构,即一段共轭双键连接在一个含有6个碳原子的环中间,在化学反应过程中,这种结构可以在一定条件下受热而稳定。
2)具有芳香气味。
芳香烃具有芳香气味,这主要是由于它们具
有受热稳定性的共轭双键结构,这使得它们在温度较高时不易分解。
3)具有芳香性。
芳香烃具有芳香性,这主要是由于它们具有受
热稳定性的共轭双键结构,这使得它们在温度较高时不能完全分解,因此它们可以在空气中形成定量的气体混合物。
4、芳香烃的用途
芳香烃主要用于香料、染料、溶剂和防腐剂等行业,并用于制造多种化学制品。
它们还广泛用于农药、香水、医药和消费品等行业。
- 1 -。

一、苯1.芳香烃分子里含有苯环的烃类化合物。
最简单的芳香烃是苯。
2.苯的分子结构(1)分子结构苯分子为平面正六边形结构,分子中12个原子共平面,碳原子均采取sp2杂化,每个碳的杂化轨道分别与氢原子及相邻碳原子的sp2杂化轨道以σ键结合,键间夹角均为120°,连接成六元环状。
每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
(2)分子组成和结构的不同表示方法3.苯的物理性质颜色状态密度熔、沸点溶解性毒性挥发性无色液体比水小较低不溶于水有毒易挥发4.苯的化学性质二、苯的同系物1.组成和结构特点(1)苯的同系物是苯环上的氢原子被烷基取代后的产物。
(2)分子中只有一个苯环,侧链都是烷基。
(3)通式为C n H2n-6(n≥7)。
2.常见的苯的同系物名称结构简式甲苯乙苯二甲苯邻二甲苯间二甲苯对二甲苯3.物理性质一般具有类似苯的气味,无色液体,不溶于水,易溶于有机溶剂,密度比水的小。
4.化学性质苯的同系物与苯都含有苯环,因此和苯具有相似的化学性质,能在一定条件下发生溴代、硝化和催化加氢反应,但由于苯环和烷基的相互影响,使苯的同系物的化学性质与苯和烷烃又有所不同。
(1)氧化反应①苯的同系物大多数能被酸性KMnO 4溶液氧化而使其褪色。
――――――――→酸性高锰酸钾溶液①均能燃烧,燃烧的通式:C n H 2n -6+3n -32O 2――→点燃n CO 2+(n -3)H 2O 。
(2)取代反应(3)加成反应甲苯与氢气反应的化学方程式:+3H 2――→催化剂①。
【归纳总结】1.苯与苯的同系物在分子组成、结构和性质上的异同苯苯的同系物相同点结构组成①分子中都含有一个苯环 ①都符合分子通式C n H 2n -6(n ≥6)化学性质 ①燃烧时现象相同,火焰明亮,伴有浓烟①都易发生苯环上的取代反应①都能发生加成反应,但都比较困难不同点取代反应易发生取代反应,主要得到一元取代产物更容易发生取代反应,常得到多元取代产物氧化反应难被氧化,不能使酸性KMnO 4溶液褪色易被氧化剂氧化,能使酸性KMnO 4溶液褪色差异原因苯的同系物分子中,苯环与侧链相互影响。