人教版高中化学选修5芳香烃
- 格式:doc
- 大小:532.50 KB
- 文档页数:9
第二节芳香烃教学目标:1、掌握苯和苯的同系物的结构及化学性质;2、了解芳香烃的及其应用教学重点:苯和苯的同系物的结构特点和化学性质。
教学难点:苯的同系物的结构和化学性质。
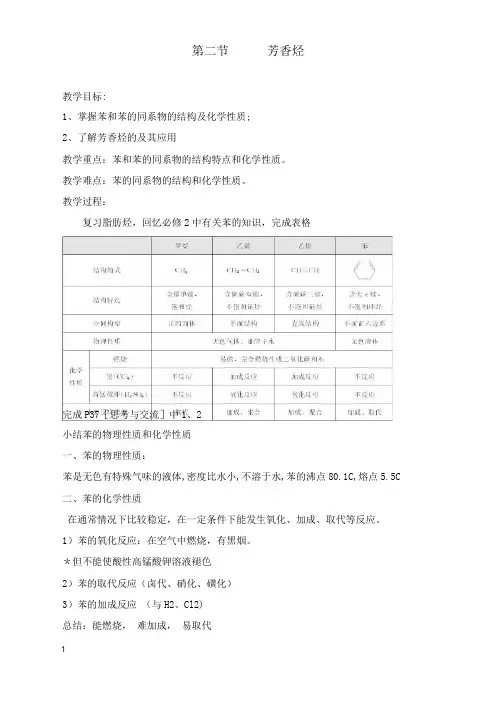
教学过程:复习脂肪烃,回忆必修2中有关苯的知识,完成表格完成P37[思考与交流]中1、2小结苯的物理性质和化学性质一、苯的物理性质:苯是无色有特殊气味的液体,密度比水小,不溶于水,苯的沸点80.1C,熔点5.5C 二、苯的化学性质在通常情况下比较稳定,在一定条件下能发生氧化、加成、取代等反应。
1)苯的氧化反应:在空气中燃烧,有黑烟。
*但不能使酸性高锰酸钾溶液褪色2)苯的取代反应(卤代、硝化、磺化)3)苯的加成反应(与H2、Cl2)总结:能燃烧,难加成,易取代m [课堂练习]:1、能证明苯分子中不存在单双键交替的理由是 ()(导学)(A ) 苯的邻位二元取代物只有一种(B ) 苯的间位二元取代物只有一种(C ) 苯的对位二元取代物只有一种(D ) 苯的邻位二元取代物有二种2 、 苯 环 结 构 中 不 存 在 C-C 单 键 与 C=C 双 键 的 交 替 结 构 , 可 以 作 为 证 据 的 是[]①苯不能使溴水褪色②苯不能使酸性高锰酸钾溶液褪色③苯在一定条件下既能发生取代反应,又能发生加成反应④经测定,邻二甲苯只有一种结构⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10A .①②④⑤3、下列物同一平面B .①②③⑤C .①②③D .①②质中所有原子都有可能在上的是 ( )4、下列关于苯的性质的叙述中,不正确的是A 、苯是无色带有特殊气味的液体B 、常温下苯是一种不溶于水且密度小于水的液体C 、苯在一定条件下能与溴发生取代反应D 、苯不具有典型的双键所应具有的加成反应,故不可能发生加成反应三、P37[思考与交流]中第 3 问。
1、由于制取溴苯需要用剧毒试剂──液溴为原料,因此不宜作为学生操作的实验,只要求学生根据反应原理设计出合理的实验方案。





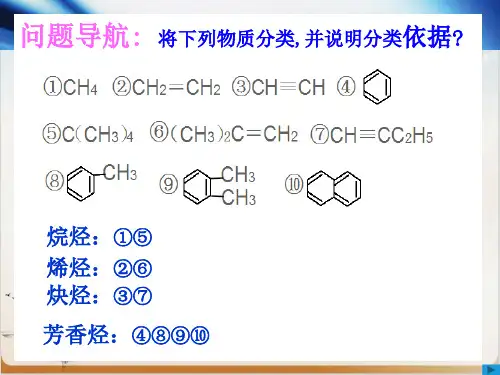
芳香烃复习目标:1.认识芳香烃的组成、结构。
2.了解苯的卤代、硝化及加氢的反应,了解苯与苯的同系物性质的相似及差异。
3.举例芳香烃类物质在有机合成和有机化工中的重要作用。
4、结合生产、生活实际了解某些烃、烃的衍生物的重要作用及对环境和健康可能产生的影响。
复习重点:芳香烃的组成、结构。
复习难点:苯同系物与苯性质的差异。
课时划分:一课时。
教学过程:一、苯的物理性质和用途1、物理性质:颜色气味的体。
密度比水。
溶于水。
2、用途:。
二、苯的结构苯的分子式为,结构式为,结构简式为或。
空间构型为,键角为。
苯分子中的6个碳碳键完全相同,是一种介于和之间的独特的键。
三、苯的化学性质1、苯的稳定性(与烷烃相似):表现在。
2、苯在空气中燃烧:(1)燃烧现象:产生现象的原因。
(2)完全燃烧的方程式。
①溴应是纯溴,而不是溴水。
②加入铁粉起催化作用,实际上起催化作用的是FeBr3③伸出烧瓶外的导管要有足够长度,其作用是导出气体和充分冷凝逸出的苯和溴的蒸气。
④导管未端不可插入锥形瓶内水面以下,因为HBr气体易溶于水,以免倒吸。
⑤导管口附近出现的白雾,是溴化氢遇空气中的水蒸气形成的氢溴酸小液滴。
⑥纯净的溴苯是无色的液体,而烧瓶中液体倒入盛有水的烧杯中,烧杯底部是油状的褐色液体,这是因为溴苯溶有溴的缘故。
除去溴苯中的溴可加入NaOH 溶液,振荡,再用分液漏斗分离。
(2)实验室制取硝基苯,注意以下几点:①混合混酸时,一定要将浓硫酸沿器壁缓缓注入浓硝酸中,并不断振荡使之混合均匀。
切不可将浓硝酸注入浓硫酸中,因混和时要放出大量的热量,以免浓硫酸溅出,发生事故。
②水浴的温度一定要控制在60℃以下,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸反应生成苯磺酸等副反应。
③浓硫酸的作用:催化剂和脱水剂。
④反应装置中的温度计,应插入水浴液面以下,以测量水浴温度。
⑤把反应的混合物倒入一个盛水的烧杯里,烧杯底部聚集淡黄色的油状液体,这是因为在硝基苯中溶有HNO3分解产生的NO2的缘故。



第 1 页 共 9 页 课时跟踪检测(七) 芳香烃
1.下列关于苯的叙述正确的是( ) A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃 B.从苯的凯库勒式看,苯分子中含有碳碳双键,应属于烯烃 C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应 D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同 解析:选D 苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,但不属于饱和烃,A错误;从苯的凯库勒式看,苯分子中含有碳碳双键,但也不属于烯烃,B错误;在催化剂作用下,苯与液溴反应生成溴苯,发生了取代反应,C错误;苯分子为平面正六边形结构,6个碳原子之间的价键完全相同,是一种介于碳碳单键与碳碳双键之间的独特的键,D正确。 2.下列变化中发生取代反应的是( ) A.苯与溴水混合,水层褪色 B.乙烯使溴的四氯化碳溶液褪色 C.甲苯制三硝基甲苯 D.苯和氯气在一定条件下生成六氯环己烷 解析:选C A中苯与溴水不反应,但可萃取溴水中的溴而使之褪色;B、D发生的是加成反应。 3.在下列有机物中,既能跟溴水发生加成反应,又能被KMnO4酸性溶液氧化的是( ) A.乙烯 B.苯 C.乙烷 D.甲苯 解析:选A 苯、乙烷既不能跟溴水发生加成反应,又不能被KMnO4酸性溶液氧化,甲苯只能被KMnO4酸性溶液氧化。 4.对于苯乙烯的下列叙述中,正确的是( ) ①能使酸性KMnO4溶液褪色;②可发生加成反应;③可溶于水;④可溶于苯中;⑤能与浓硝酸在浓H2SO4作用下发生取代反应;⑥所有的原子可能共平面。 A.①②③④⑤ B.①②⑤⑥ C.①②④⑤⑥ D.全部 解析:选C ①因为苯乙烯分子中含有碳碳双键,所以能使酸性KMnO4溶液褪色,正确;②因为苯乙烯分子中含有碳碳双键,所以可发生加成反应,正确;③苯乙烯属于烃,而所有的烃均不溶于水,错误;④根据相似相溶原理,苯乙烯可溶于苯中,正确;⑤苯乙烯分子中含有苯环,能与浓硝酸在浓H2SO4作用下发生取代反应,正确;⑥苯环与碳碳双键均是平面结构,所以所有的原子可能共平面,正确。 第 2 页 共 9 页 5.下列物质属于芳香烃,但不是苯的同系物的是( )
A.③④ B.②⑤ C.①②⑤⑥ D.②③④⑤⑥
解析:选B 含有一个苯环,属于苯的同系物;尽管含有一个苯环,但其中含有其他(N或O)原子,不属于芳香烃;含有碳碳双键,尽管属于芳香烃,但不是苯的同系物;含有两个苯环,属于芳香烃,不是苯的同系物。
6.在分子中,同一平面内的碳原子最多应有( ) A.7个 B.8个 C.9个 D.14个
解析:选D 苯分子是平面正六边形结构,分子中12个原子共平面。分析的结构时,受苯环书写形式的局限而认为至少1~8碳原子共平面,实质上由于4、7、8、11四个碳原子共直线,两个苯环所确定的平面可以绕该直线旋转,故至少有9个碳原子共面;若两平面重合,则所有的碳原子均在同一平面上,即最多有14个碳原子共面。 7.用相对分子质量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( ) A.3 B.4 C.5 D.6 解析:选D 相对分子质量为43的烷基为—C3H7,其结构有两种:—CH2CH2CH3和—CH(CH3)2,可以取代甲苯苯环上的邻、间、对三个位置上的氢原子,故所得芳香烃的产物有2×3=6种。 第 3 页 共 9 页 8.有机物的结构可用“键线式”表示,如CH3—CH===CH—CH3的键线式为。已知有机物X的键线式为,Y是X的同分异构体且属于芳香烃。下列关于Y的说法正确的是( )
A.Y的结构简式为 B.Y能使溴水褪色,且反应后的混合液静置后不分层 C.Y不能发生取代反应 D.Y分子中的所有原子一定共面 解析:选A 根据X的键线式结构,可得其分子式为C8H8,Y是X的同分异构体,并且
属于芳香烃,即分子中含有苯环,则Y的结构简式为,A项正确。苯乙烯能和溴水发生双键上的加成反应,由于生成的有机物不易溶于水,故反应后的混合液静
置后会分为两层,B项错误。苯乙烯可以发生取代反应,C项错误。中苯环上的碳原子与1号碳原子间形成的单键可以发生旋转,使苯环和 构成的平面不重叠,所以苯乙烯分子中所有原子不一定共面,D项错误。 9.(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含三键且无支链链烃的结构简式:________________________。 (2)苯不能使溴水因反应而褪色,性质类似烷烃,但能与溴、浓硝酸等发生取代反应,写出苯的硝化反应的化学方程式:__________________________________________。
(3)烷烃中脱去2 mol氢原子形成1 mol双键要吸热,但1,3环己二烯()脱去2 mol氢原子变成苯却放热,可推断苯比1,3环己二烯________(填“稳定”或“不稳定”)。 (4)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实________(填编号)。 a.苯不能使溴水褪色 b.苯能与H2发生加成反应 c.溴苯没有同分异构体 d.邻二溴苯只有一种 (5)现代化学认为苯分子碳碳之间的键是________________________________________ ________________________________________________________________________。 解析:(1)苯的分子式为C6H6,与同碳原子数烷烃相比少了8个H,故分子式为链烃时 第 4 页 共 9 页 其分子中应含2个—C≡C—或一个—C≡C—和两个 等。
(2)苯发生硝化反应是NO2取代苯环上的一个H而生成和H2O。 (3)化学反应中放热越多生成物的状态越稳定,反之,吸热越多反应物的状态越稳定。 (4)苯分子不具有典型的烯烃的性质,是苯的凯库勒结构所不能解释的事实,若按照苯的凯库勒结构式,邻二溴苯的两个溴原子可以分别在双键或单键两端,而不是只有一种结构。 答案:(1)CH≡C—C≡C—CH2—CH3 (或CH≡C—CH===CH—CH===CH2)
(3)稳定 (4)a、d (5)介于单键和双键之间的独特的键 10.苯和溴的取代反应的实验装置如下图所示,其中A为带支管口的试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。 填写下列空白: (1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):___________________________________________ ________________________________________________________________________。
(2)试管C中苯的作用是_________________________________________________。 反应开始后,观察D和E两试管,看到的现象为_____________________________ ________________________________________________________________________。 (3)反应2 min~3 min后,在B中可观察到的现象是 ________________________________________________________________________ ________________________________________________________________________。 (4)在上述整套装置中,具有防倒吸的仪器有________(填字母)。 解析:苯与液溴剧烈反应生成Br和HBr气体,从导管出来的气体中会混有一定量的溴第 5 页 共 9 页 蒸气,混合气体进入试管C可将气体中的溴蒸气除去(利用相似相溶原理)。气体在经D、E两装置时,分别可以观察到紫色石蕊溶液变红,AgNO3溶液中有浅黄色沉淀生成,装置F是尾气吸收装置,以防环境污染。 答案:(1)2Fe+3Br2===2FeBr3、
(2)除去HBr气体中混有的溴蒸气 D试管中石蕊溶液慢慢变红,且在导管口处有白雾产生,E试管中出现浅黄色沉淀 (3)瓶底有无色油状液体产生 (4)D、E、F
1.下列说法正确的是( ) A.与甲烷性质相似,苯不能使酸性KMnO4溶液褪色,因此苯为饱和烃 B.苯的结构简式为 ,有三个双键,可与溴水发生加成反应 C.苯的邻位二元取代产物只有一种 D.苯的邻位二元取代产物有两种 解析:选C 苯不能使酸性KMnO4溶液褪色,不能与溴水发生加成反应,说明苯分子不是单、双键交替的结构,苯分子中的碳碳键是一种介于碳碳单键和碳碳双键之间的独特的键,六个键完全相同,因此其邻位二元取代产物只有一种,C正确,B、D错误;苯的分子式为C6H6,为不饱和烃,故A错误。 2.只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区别,该试剂可以是( ) A.高锰酸钾酸性溶液 B.溴水 C.溴化钾溶液 D.硝酸银溶液 解析:选B 甲苯和己烯都与酸性高锰酸钾发生氧化还原反应,不能鉴别,A错误;甲苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,加入溴水,颜色层位置不同,己烯与溴水发生加成反应,碘化钾与溴水发生氧化还原反应,溶液颜色加深,可鉴别,B正确;加入溴化钾溶液,不能鉴别甲苯和己烯,二者不与溴化钾溶液反应且密度都比水小,C错误;加入硝酸银溶液,不能鉴别甲苯和己烯,二者与硝酸银不反应,且密度都比水小不能鉴别,D错误。 3.某烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,分子结构中只含有一个烷基,符合条件的烃有( ) A.2种 B.3种 C.4种 D.5种 解析:选B 该烃的分子式为C10H14,符合分子通式CnH2n-6,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,说明它是苯的同系物;因其分子中只含一个烷基,可推知此烷基为