最新人教版高中化学《芳香烃》知识梳理
- 格式:doc
- 大小:11.07 MB
- 文档页数:7

第三节芳香烃课标·内容要求课标·学业要求1.认识芳香烃的组成和结构特点,会比较苯与其同系物组成、结构和性质的差异。
2.知道加成、取代、氧化、还原反应等反应类型和芳香烃组成结构特点的关系。
3.结合生产生活了解芳香烃对环境、健康可能产生的影响,知道其在生产、生活中的重要应用1.理解苯及其简单同系物的结构特点及化学性质,能举例说明有机化合物中官能团之间的相互影响。
2.通过实验探究,掌握溴苯和硝基苯的制备原理及注意事项。
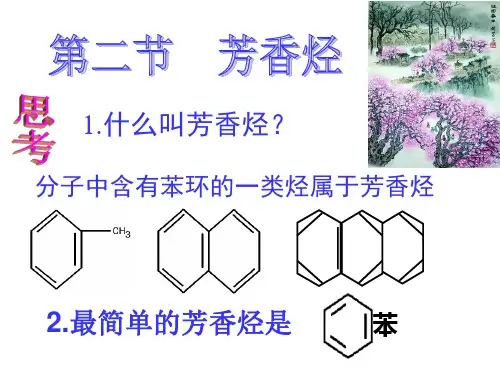
3.知道芳香烃组成、结构和性质的差异,认识芳香烃在日常生活、化工生产中的作用教材梳理·概念认知知识点一苯1.芳香烃:在烃类化合物中,含有一个或多个苯环的化合物。
苯是最简单的芳香烃。
2.苯的物理性质与应用(1)物理性质无色,有特殊气味的液体,有毒,不溶于水。
苯易挥发,沸点为80.1 ℃,熔点为5.5 ℃,常温下密度为0.88 g·cm-3。
(2)应用:苯是一种重要的化工原料和有机溶剂。
3.苯的分子结构(1)分子组成和结构的不同表示方法:(2)空间结构①苯的空间构型是平面正六边形。
②六个碳原子均采取sp2杂化,分别与氢原子及相邻碳原子以σ键结合,键间夹角均为120°,连接成六元环。
每个碳碳键的键长相等,介于碳碳单键和碳碳双键之间。
③每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
4.苯的化学性质(1)稳定性:苯的结构稳定,苯不与酸性KMnO4溶液、溴水反应,但苯可以萃取溴水中的溴。
(2)氧化反应:燃烧时产生浓重的黑烟,反应方程式:2C6H6+15O212CO2+6H2O。
(3)取代反应①卤代反应:苯与液溴在FeBr3催化条件下的反应。
反应方程式为+Br2+HBr↑。
溴苯():无色液体,有特殊气味,不溶于水,密度比水的大。
②硝化反应:苯在50~60℃的温度下与浓硝酸在浓硫酸催化条件下的反应。


第二节芳香烃第三节李度一中陈海思一、芳香烃1、定义:结构上由苯环和烷基组成的烃叫做芳香烃,包含苯2、苯的同系物:苯的同系物是苯环上的氢原子被烷基所取代的产物,在性质上与苯有相似之处。
芳香烃包含苯的同系物3、苯的同系物的基本概念通式:CnH2n-6结构特点:只含有一个苯环,以苯环为主体,烷基为侧链状态:液体或固体,一般都带有特殊气味4、代表物质:芳香烃:苯苯的同系物:甲苯二、苯1、基本结构化学式:C6H6 结构简式:(凯库勒式)或苯分子中并没有碳碳双键,不饱和度:42、物理性质无色,液体,带有特殊气味,密度比水小,难溶于水,易挥发,有毒3、化学性质1)氧化反应2C6H6+15O2 → 12CO2+6H2O (带浓烟)2)取代反应a、与液溴反应:需要加入少量铁粉,铁与液溴生成溴化铁,溴化铁可以催化苯的溴代(Fe做催化剂)+Br2 → +HBrb、与浓硝酸反应(硝化反应)反应需要浓硫酸催化和吸水(浓硫酸为催化剂和吸水剂)+HO—NO2 → +H2O3)加成反应苯在一定条件下可与氢气加成,生成环己烷(Ni做催化剂)+3H2 →三、甲苯1、基本结构化学式:C7H8,结构简式:不饱和度:42、物理性质无色,液体,无味,密度比水小,难溶于水,有毒3、化学性质1)氧化反应燃烧:C7H8+9O2 → 7CO2+4H2O (带浓烟)KMnO4氧化:侧链上的甲基被氧化为羧基2)取代反应苯环上的取代:与液溴混合反应,FeBr3催化+3Br2 → +3HBr侧链上的取代:与氯气在光照条件下+Cl2 → +HCl硝化反应:在浓硫酸和浓硝酸共热情况下反应+3HO-NO2 → +3H2O2,4, 6 –三硝基甲苯简称三硝基甲苯,又叫梯恩梯(TNT),是一种淡黄色的晶体,不溶于水。
它是一种烈性炸药,广泛用于国防开矿、筑路、兴修利等。
3)加成反应:一定条件下与氢气催化加成+3H2 →四、苯、甲苯的结构以及性质的相似点和不同点苯甲苯结构相同点都含有苯环结构不同点苯环上无取代基含甲基分子间的关系结构相似,组成相差CH2,互为同系物化学性质Br2的CCl4 不反应不反应KMnO4(H+)不反应被氧化溶液褪色浓HNO3、浓H2SO4混合液硝化硝化【素材积累】1、成都,是一个微笑的城市,宁而美丽。


芳香烃【学习目标】1、认识芳香烃的组成、结构;2、了解苯的卤代、硝化及加氢的反应,知道苯的同系物的性质、苯的同系物与苯性质的差异;3、结合生产、生活实际了解某些烃、烃的衍生物的重要作用及对环境和健康可能产生的影响,芳香烃类物质在有机合成和有机化工中的重要作用。
【要点梳理】要点一、苯的结构和性质分子中含有一个或多个苯环的碳氢化合物都属于芳香烃。
我们已学习过最简单、最基本的芳香烃——苯。
1.分子结构。
苯的分子式为C 6H 6,结构式为,结构简式为或 。
大量实验表明,苯分子里6个碳原子之间的价键完全相同,是一种介于单键和双键之间的独特的键。
苯分子里的所有原子都在同—平面内,具有平面正六边形结构,键角为120°,是非极性分子。
2.物理性质。
苯是无色有特殊气味的液体,不溶于水,密度比水小,熔点5.5℃,沸点80.1℃,苯用冰冷却可凝结成无色的晶体,苯有毒。
3.化学性质。
【芳香烃#苯的化学性质】苯的化学性质比较稳定,但在一定条件下,如在催化剂作用下,苯可以发生取代反应和加成反应。
(1)取代反应。
(溴苯是无色液体,不溶于水,密度比水大)(硝基苯是无色,有苦杏仁味的油状液体,密度比水大,不溶于水,有毒)(2)加成反应。
(3)氧化反应。
①苯在空气中燃烧发出明亮的带有浓烟的火焰:+15O 2−−−→点燃12CO 2+6H 2O ②苯不能使酸性KMnO 4溶液褪色;苯也不能使溴水褪色,但苯能将溴从溴水中萃取出来。
4.苯的用途。
苯是一种重要的化工原料,它广泛应用于生产合成纤维、合成橡胶、塑料、农药、医药、染料和香料等,苯也常用作有机溶剂。
特别提示 (1并不能反映苯的真实分子结构,只是由于习惯才沿用至今。
实际上苯分子中的碳碳键是完全相同的。
(如与是同种物质)(2)由于苯环结构的特殊性,在判断苯体现什么性质时要特别注意反应条件和反应物的状态。
要点二、苯的同系物【芳香烃#苯的同系物及其性质】1.苯的同系物是苯环上的氢原子被烷基取代的产物,其结构特点是:分子中只有一个苯环,苯环上的侧链全部为烷基。

芳香烃【学习目标】1、认识芳香烃的组成、结构;2、了解苯的卤代、硝化及加氢的反应||,知道苯的同系物的性质、苯的同系物与苯性质的差异;3、结合生产、生活实际了解某些烃、烃的衍生物的重要作用及对环境和健康可能产生的影响||,芳香烃类物质在有机合成和有机化工中的重要作用||。
【要点梳理】要点一、苯的结构和性质分子中含有一个或多个苯环的碳氢化合物都属于芳香烃||。
我们已学习过最简单、最基本的芳香烃——苯||。
1.分子结构||。
苯的分子式为C 6H 6||,结构式为||,结构简式为 或 ||。
大量实验表明||,苯分子里6个碳原子之间的价键完全相同||,是一种介于单键和双键之间的独特的键||。
苯分子里的所有原子都在同—平面内||,具有平面正六边形结构||,键角为120°||,是非极性分子||。
2.物理性质||。
苯是无色有特殊气味的液体||,不溶于水||,密度比水小||,熔点5.5℃||,沸点80.1℃||,苯用冰冷却可凝结成无色的晶体||,苯有毒||。
3.化学性质||。
苯的化学性质比较稳定||,但在一定条件下||,如在催化剂作用下||,苯可以发生取代反应和加成反应||。
(1)取代反应||。
(溴苯是无色液体||,不溶于水||,密度比水大)(硝基苯是无色||,有苦杏仁味的油状液体||,密度比水大||,不溶于水||,有毒)(2)加成反应||。
(3)氧化反应||。
①苯在空气中燃烧发出明亮的带有浓烟的火焰:2 +15O 2−−−→点燃12CO 2+6H 2O ②苯不能使酸性KMnO 4溶液褪色;苯也不能使溴水褪色||,但苯能将溴从溴水中萃取出来||。
4.苯的用途||。
苯是一种重要的化工原料||,它广泛应用于生产合成纤维、合成橡胶、塑料、农药、医药、染料和香料等||,苯也常用作有机溶剂||。
特别提示:(1)苯的结构简式: ||,只是由于习惯才沿用至今||。
实际上苯分子中的碳碳键是完全相同的||。
(如与是同种物质)(2)由于苯环结构的特殊性||,在判断苯体现什么性质时要特别注意反应条件和反应物的状态||。


有机化学芳香烃知识点总结本文将从芳香烃的结构、命名、性质和应用等多个方面展开对芳香烃的知识点进行深入总结。
一、芳香烃的结构芳香烃是由苯环或苯环的衍生物组成的一类化合物。
苯环是一个由六个碳原子构成的六元环结构,其中每个碳原子上都有一个氢原子,化学式为C6H6。
苯环上的每个碳原子都与相邻的两个碳原子形成共轭双键,使得苯环的结构非常稳定。
苯环上的每个碳原子都含有3个σ键和1个π键,由于π键的存在,使得苯环表现出特殊的芳香性质。
芳香烃由一个或多个苯环组成,其结构稳定,常常与其他官能团发生加成反应。
在芳香烃中,苯环上的氢原子可以被其他官能团取代,形成取代芳香烃。
取代芳香烃中的氢原子可以被卤原子、羟基、甲基等官能团取代,从而形成不同的取代芳香烃。
取代芳香烃的命名方法和性质稍有不同,但其基本的结构和化学性质与芳香烃类似。
二、芳香烃的命名芳香烃的命名分为两种情况,一种是直链芳香烃的命名,另一种是取代芳香烃的命名。
直链芳香烃的命名采用正规命名法,根据芳香烃中苯环的个数和所附加的取代基的种类和数目来进行命名。
在正规命名法中,苯环的个数和取代基的种类和数目都要在化合物的名称中进行标注,以便准确地识别化合物的种类和结构。
取代芳香烃的命名是根据取代基的种类和位置来进行命名的,取代基的种类和数量都要在化合物的名称中进行标注,以区分不同的取代芳香烃。
同时,在取代芳香烃的命名中还需注意给出取代基的位置。
芳香烃的命名需要牢记一些规则,比如取代基的优先级,取代基编号的方法等。
只有严格遵守这些规则,才能正确地给出芳香烃的命名。
三、芳香烃的性质1. 燃烧性质芳香烃具有较高的燃烧热,可以在氧气的存在下燃烧。
芳香烃的燃烧产物一般是二氧化碳和水,放出大量的热能。
芳香烃的燃烧反应是一种典型的氧化反应,是芳香烃的一种重要性质。
2. 溶解性在常温下,芳香烃可以溶解在多种有机溶剂中,如醚、醇等。
然而,芳香烃的溶解性随着分子量的增加而减弱,大分子量的芳香烃的溶解性通常较差。

高中化学芳香烃知识点
一、芳香烃
1、芳香烃的概念
芳香烃是指它们在一定条件下具有芳香气味的有机化合物,也称为芳构烃、芳族烃或香豆烃。
芳香烃具有共轭双键环结构,并具有芳香性和固态稳定性。
芳香烃有C6-C14碳数的化合物。
2、芳香烃的特性
1)共轭双键结构。
芳香烃是有机化合物,而共轭双键结构是它
们的特征结构,即一段共轭双键连接在一个含有6个碳原子的环中间,在化学反应过程中,这种结构可以在一定条件下受热而稳定。
2)具有芳香气味。
芳香烃具有芳香气味,这主要是由于它们具
有受热稳定性的共轭双键结构,这使得它们在温度较高时不易分解。
3)具有芳香性。
芳香烃具有芳香性,这主要是由于它们具有受
热稳定性的共轭双键结构,这使得它们在温度较高时不能完全分解,因此它们可以在空气中形成定量的气体混合物。
4、芳香烃的用途
芳香烃主要用于香料、染料、溶剂和防腐剂等行业,并用于制造多种化学制品。
它们还广泛用于农药、香水、医药和消费品等行业。
- 1 -。

高中化学:《芳香烃》知识点总结一、苯的结构和性质(1)苯的结构苯的研究获得的一些事实:1.苯的邻二取代产物只有一种2.苯不能通过化学反应使酸性高锰酸钾溶液、溴的四氯化碳溶液褪色3.苯的1H核磁共振谱图中显示只有一个信号4.碳碳双键加氢时总要放出热量,且热量与双键数目大致成正比。
但苯的结构表示结构猜想:分子式为C6H6,与C6H14相比,少8个H,所以C6H6分子中应该有多个不饱和键:碳碳双键或叁键。
研究事实:见图片研究结论:①在苯分子中不存在独立的碳碳单键和碳碳双键②苯分子中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的碳碳键③苯分子中的6个碳原子和6个氢原子都处于同一个平面上,为平面正六边形。
④碳碳键、碳氢键完全等同,6个C、H完全相同,键角120°苯的结构表示方法:见上图片。
(2)苯的化学性质——卤代反应实验装置:三颈烧瓶、冷凝器、滴液漏斗、干燥管等;实验操作:如上图,三颈烧瓶中加入少量铁粉,向三颈烧瓶中加入苯和液溴的混合物,反应完毕后,向三颈烧瓶中加入NaOH溶液。
实验现象:①三颈烧瓶内:液体沸腾,烧瓶内充满大量红棕色气体。
②管口有白雾出现,滴入AgNO3溶液,出现淡黄色沉淀。
实验问题:①如何检查装置气密性?②冷凝管的作用?——冷凝效果更好③插入锥形瓶的长导管不伸入液面,为什么?——防止倒吸④碱石灰干燥管的作用?——尾气吸收装置,能防止污染⑤加NaOH的作用是什么——NaOH溶液吸收溴苯中的溴和溴化氢⑥能说明此反应是取代反应的依据是什么?——有HBr和一种油状液体生成实验结论:苯和液溴在铁作催化剂的条件下,发生取代反应,生成HBr和溴苯。
(3)苯的化学性质——硝化反应实验操作:1.5mL浓硝酸和2mL浓硫酸混合均匀后,冷却,逐渐滴入约1mL苯,用50-60℃的水浴加热,反应完毕后,将试管中的液体倒入盛水的烧杯中。
实验现象:反应完毕后,将试管中的液体倒入盛水的烧杯中,有油状液体沉于烧杯底部。
第二节芳香垃浓硫岐)~、4-H(>—NO,——一-</一NOz + H?。
(5)2(:出+150:--12C0:+ 6H ;0 (6)只含有一个茶环,笨环上连接烷基(9)QH » 6+ (3L 3)/20L K0:+ (〃-3)40 (10)使高镒酸钾酸性溶液褪色基础知识舄本技能QZ/H ; » rz H n iii j i IIKSJIX F NC1 .笨的结构与性质 (1)苯的结构个碳原子构成一个正六边形;②笨分子中碳碳键键长完全相等,是介于碳碳单键与双键之间的一种独特的键。
如何证明米的分子结构中的碳碳健不是单双键交替排列的?①采分子中的碳碳键键长、键能均相等。
②苯的邻位二元取代物只有一种即不O彳思维导图也.二DAOTU 结构特点,⑴加龙反应(2)取代反应真化反应——想烧(5)芳香烧结构特点, ⑹化学性质加也反住取代反应-(8)武一件」⑼ 九化反"1与%以收勿发!4泣我」业答案: 边形结构.(1)米分子中碳碳键是介于单键与双键之间的一种独特的键,苯分子是平面正六 化学性质笨苯的结构特点:①苯分子是平面结构,分子中的6个碳原子和6个氢原子都在同一平面内,分子中的6存在同分异构体。
③从性质上看,苯不能使KMnO,酸性溶液褪色。
以上事实说明苯分子中的碳碳键不是单双键交替排列的。
(2)苯的物理性质米是最简单的芳香烧。
在常温下,米是无色、有特殊气味的液体,有毒。
熔点5.5 C, 沸点80.1 C;密度比水小,不溶于水,易溶于有机溶剂。
(3)苯的化学性质在通常情况卜.比较稳定,在一定条件卜.能发生氧化、力口成、取代等反应。
①氧化反应米在空气中燃烧,火焰明亮并伴有浓烟产生。
2QH6+15O2-^*12Cd+ 6H9但是,米不能被高钵酸钾酸性溶液氧化,即笨不能使高钵酸钾酸性溶液褪色。
②取代反应a.苯和浜的反应并及时摇匀和冷却:②向冷却后的酸中逐滴加入1 mL 苯,充分振 荡,混合均匀:③将混合物控制在50—60 C 的条件下约10 min将反应后的液体倒入盛冷水的烧杯中,可以看到烧杯底部有黄色 油状物生成(溶有义)二),经过分离得到粗硝基苯①浓硫酸的作用是催化剂和吸水剂;②必须用水溶加I 热,且在水浴中插入温度计测量温度: ③玻璃管的作用是同流冷凝:④粗硝基苯依次用蒸储水和5% \aOH 溶液洗涤,最后再用蒸饲水 洗涤,将用无水CaCk 干燥后的粗硝基米进行蒸馅,得到无色、有 苦杏仁味的油状液体纯硝基苯(3)加成反应在一定条件下,在可以与件、先等发生加成反应。
第三节芳香烃一、苯(一)物理性质:无色、有特殊气味的液体,有毒,不溶于水,密度比水小,易挥发,熔沸点低,是一种重要的化工原料和有机溶剂(二)组成与结构:空间构型:平面正六边形,所有原子共平面。
成键特点:6个碳原子均采取sp2杂化,分别与氢原子及相邻碳原子以σ键结合,键间夹角均为120°,连接成六元环。
每个碳碳键的键长相等,都是139pm,介于碳碳单键和碳碳双键的键长之间。
六个碳原子之间的化学键完全相同,是一种介于单键和双键之间的独特的键。
每个碳原子余下的p轨道垂直于碳、氢原子构成的平面,相互平行重叠形成大π键,均匀地对称分布在苯环平面的上下两侧。
催化剂 △(三)化学性质:苯的大π键比较稳定,“易取代、能加成、难氧化” 1、氧化反应: (1)不会被高锰酸钾等强氧化剂氧化(2)燃烧:2C 6H 6+15O 2−−→−点燃12CO 2+6H 2O 火焰明亮并带有浓重的黑烟 2、加成反应:与H 2加成:用Pt 、Ni 等为催化剂并加热的条件下进行反应。
3、取代反应: (1)卤代反应——与卤素单质的反应: ①现象:导管口有白雾产生——HBr 溶于水水底有油状液体——溴苯不溶于水,且密度比水大锥形瓶中加入AgNO 3溶液,有浅黄色沉淀产生——生成的HBr 与AgNO 3反应,生成AgBr↓ ②说明:I 、苯只与纯卤素反应。
遇到溴水发生萃取分层,下层为水层,上层为橙红色的苯和溴的混合液II、必须有催化剂;反应中加入的催化剂是铁粉,实际起催化作用的是FeBr3III、苯与Br2只发生一元取代反应IV、试剂的加入顺序为:先加苯,再加溴,最后加铁粉V、长导管的作用:a、导气:因为苯和溴都易挥发b、冷凝回流:该反应为放热反应VI、产物的位置:溴苯由于其沸点高不容易挥发,所以留在反应的原烧瓶内;溴化氢由于其易挥发,挥发到锥形瓶中VII、除杂:纯净的溴苯是无色有特殊气味的液体,但因常含有溴而显褐色,为了除去其中的溴,可用NaOH溶液进行除杂。