青海专版2017中考化学命题研究第二编重点题型突破篇专题六常见的化学计算精讲试题
- 格式:doc
- 大小:400.00 KB
- 文档页数:4

(青海专版)中考化学命题研究第二编重点题型突破篇专题五物质的推断题(精讲)试题,中考专题精讲)解题思路推断题的解题关键在于寻找“题眼”,物质的特殊结构、状态、颜色、类别、特性及反应特征、现象等都可作为题眼,应重点掌握。
1.锁定“题眼”:全题兼顾,找到题目的突破口,并把题目的关键信息标注在题中。
2.“顺藤摸瓜”:根据找到的题目突破口,进行顺推或逆推,把推出的关键信息标在题干上,进而全面解答。
3.自我验证:把推出的答案代入原题中进行检验,确保推断和答案的正确性。
中考推断题常见六种题眼或解法(一)以物质的颜色为突破口1.固体的颜色(1)白色固体:白磷、P2O5、MgO、CaO、KClO3、KCl、Na2CO3、NaCl、无水CuSO4、NaHCO3、NaOH、Ca(OH)2。
(2)银白色:镁条、铁丝、锌粒(汞为银白色液体)。
(3)黑色固体:Fe、C、CuO、MnO2、Fe3O4。
(4)红色固体:Fe2O3、红磷。
(5)紫红色:Cu。
(6)暗紫色:KMnO4。
(7)淡黄色:硫。
(8)绿色:Cu2(OH)2CO3。
(9)蓝色:CuSO4·5H2O。
2.溶液的颜色(1)蓝色溶液:CuCl2溶液、__CuSO4溶液__。
(2)浅绿色溶液:__FeCl2溶液__、FeSO4溶液。
(3)黄色溶液:__FeCl3溶液__、Fe2(SO4)3溶液。
(4)紫红色溶液:KMnO4溶液。
3.沉淀的颜色(1)有色沉淀:蓝色沉淀__Cu(OH)2__;红褐色沉淀__Fe(OH)3__。
(2)白色沉淀:BaSO4、AgCl、CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Ag2CO3。
其中不溶于稀硝酸的白色沉淀:__BaSO4__、__AgCl__;溶于酸并有气体放出的白色沉淀:__CaCO3__、__Ag2CO3__、BaCO3;溶于酸但没有气体放出的白色沉淀:__Mg(OH)2__、__Al(OH)3__。


专题一 常见气体的制取、净化与干燥,中考专题精讲)常见气体的制取反应原理(1)实验室制取氧气:①用加热高锰酸钾的方法制取氧气:2KMnO 4=====△K 2MnO 4+MnO 2+O 2↑。
②用加热氯酸钾和二氧化锰的混合物的方法制取氧气:2KClO 3=====MnO 2△2KCl +3O 2↑,其中MnO 2是催化剂。
③用过氧化氢分解的方法制取氧气:2H 2O 2=====MnO 22H 2O +O 2↑,其中MnO 2是催化剂。
(2)实验室制取CO 2气体:实验室常用大理石(主要成分碳酸钙,是块状固体)与稀盐酸反应,制取二氧化碳:CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑。
(3)实验室制取氢气: 实验室常用锌和稀H 2SO 4反应: Zn +H 2SO 4===ZnSO 4+H 2↑ (4)发生装置的选择:常见气体最佳发生装置的选择:根据制取气体的实际需要和反应的具体情况,从上述装置中选择最佳适合需要的装置进行气体的制取。
(5)收集装置的选取:选择收集装置要考虑气体的溶解性、能否与水反应、密度、是否有毒性、能否与空气中的某成分发生化学反应等因素。
气体的净化、干燥、尾气处理1.实验装置洗气瓶、U 形干燥管、球型干燥管如下图所示。
(1)洗气瓶用液体试剂除杂或干燥气体,气体通过的方向是长管进,短管出。
(2)U 形干燥管和球形干燥管用固体除杂或干燥气体。
2.气体的净化将不纯的气体中杂质气体除去,从而得到较纯净的气体过程,就是气体的净化。
气体净化常用的试剂除杂试剂的选择,要根据从某气体中除掉某杂质气体而定,原则是既不能与原气体反应,又能去掉其中的杂质气体,还不能引进新的气体杂质。
3.气体的干燥用干燥剂除去气体中混有的水蒸气的过程就是气体的干燥。
常见的干燥剂选择干燥剂必须只能吸收水蒸气,而不能与被干燥的气体发生反应。
4.多功能瓶的使用5.尾气处理将实验产生的有毒有害气体(或对空气造成污染的气体),用物理或化学方法进行处理,将其消除。


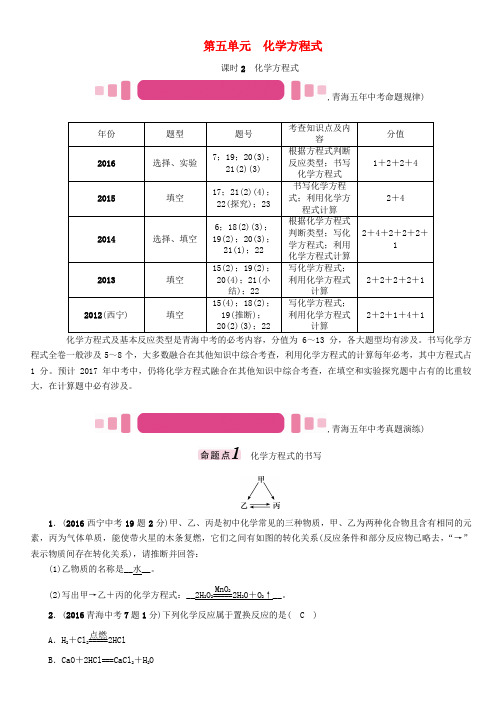
第五单元 化学方程式课时2 化学方程式,青海五年中考命题规律)化学方程式及基本反应类型是青海中考的必考内容,分值为6~13分,各大题型均有涉及。
书写化学方程式全卷一般涉及5~8个,大多数融合在其他知识中综合考查,利用化学方程式的计算每年必考,其中方程式占1分。
预计2017年中考中,仍将化学方程式融合在其他知识中综合考查,在填空和实验探究题中占有的比重较大,在计算题中必有涉及。
,青海五年中考真题演练)化学方程式的书写1.(2016西宁中考19题2分)甲、乙、丙是初中化学常见的三种物质,甲、乙为两种化合物且含有相同的元素,丙为气体单质,能使带火星的木条复燃,它们之间有如图的转化关系(反应条件和部分反应物已略去,“→”表示物质间存在转化关系),请推断并回答:(1)乙物质的名称是__水__。
(2)写出甲→乙+丙的化学方程式:__2H 2O 2=====MnO 22H 2O +O 2↑__。
2.(2016青海中考7题1分)下列化学反应属于置换反应的是( C ) A .H 2+Cl 2=====点燃2HCl B .CaO +2HCl===CaCl 2+H 2OC .C +2CuO=====高温2Cu +CO 2↑ D .CaCO 3=====高温CaO +CO 2↑3.(2015西宁中考17题3分)已知A 、B 、C 三种物质含有同种金属元素,其中C 的溶液常用于检验二氧化碳,D 、E 、F 三种物质含有同种非金属元素,E 是易与血液中血红蛋白结合的有毒气体。
它们之间的转化关系如图所示(有些转化关系、反应条件已略去。
“→”表示物质间的转化关系),试回答:(1)写出B 的化学式__CaO__。
(2)用化学方程式表示常温下A→D 的转化关系__CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑__。
4.(2014西宁中考7题1分)铝在氧气中燃烧生成氧化铝,在这个反应中,铝、氧气、氧化铝的质量比是( C )A .27∶32∶102B .27∶24∶43C .108∶96∶204D .4∶3∶25.(2014青海中考6题1分)下列反应属于置换反应的是( D ) A .CO +CuO=====△Cu +CO 2 B .H 2CO 3===CO 2↑+H 2O C .CH 4+2O 2=====点燃CO 2+2H 2O D .C +H 2O(气)=====高温CO +H 26.(2013西宁中考9题2分)某化学反应的微观示意图如图所示,下列说法正确的是( B )A .该反应属于复分解反应B .该反应的生成物均为化合物C .该反应中,反应物的质量比为1∶1∶1D .该反应前后分子的种类、数目均不变7.(2013青海中考19题4分)(1)现有三瓶无色溶液,分别为氢氧化钠溶液、氯化钡溶液、碳酸钠溶液,只用一种试剂就能将它们鉴别出来,该试剂是__H 2SO 4__(填化学式)。
专题六 常见的化学计算
,中考专题精讲)
有关化学式的计算
此类试题解题时要抓住两个关键量,即相对原子质量和各原子个数。
解题方法如下:
例如:在化合物A x B y 中,已知A 、B 两元素的相对原子质量分别为a 、b ,则有: 1.A x B y 的相对分子质量为ax +by 。
2.A x B y 中A 、B 两种元素的质量比为ax :by 。
3.A x B y 中A 元素的质量分数为ax
ax +by
×100%,B 元素的质量分数为
by
ax +by
×100%。
4.m gA x B y 中A 元素的质量为
max
ax +by
g 。
关于不纯物质的计算
1.有关混合物的计算(混合物中杂质不参加反应或混合物中只有一种物质参加反应)。
2.原理:将不纯物质的质量转化为纯净物质的质量带入化学方程式进行计算。
3.公式
(1)纯净物的质量=混合物的质量×纯度(或质量分数); (2)纯度=纯净物的质量
混合物的质量(样品的质量等)×100%;
(3)纯净物的质量分数=1-杂质的质量分数。
【特别提醒】①化学方程式中每一项都应是纯净的物质; ②化学方程式中每一种物质代入或算出的质量都是纯净物的质量;
③有些参加反应的物质中还要分析是否完全反应,如不完全反应,该未反应部分的质量不能按反应的质量进行计算。
有关溶质质量分数的计算
常用的公式及注意事项:
1.溶质的质量分数=溶质质量溶液质量×100%=溶质质量
溶质质量+溶剂质量×100%
2.溶质的质量分数与溶液的体积和密度之间的换算:
溶液质量(m)=溶液的体积(V)×溶液的密度(ρ);
溶质质量分数=溶质质量
溶液的体积(V)×溶液的密度(ρ)
×100%。
【特别提醒】溶液的质量可以直接相加减,但溶液的体积不能直接相加减。
3.溶液的稀释(用水稀释):
原理:稀释前后溶液中溶质的质量相等
稀释前溶液的质量×稀释前溶液中溶质的质量分数=稀释后溶液的质量×稀释后溶液中溶质的质量分数4.进行溶液中化学方程式的计算时,要注意将溶液质量换算成溶质质量,利用化学方程式所求得的物质质量都是实际参加反应的(或生成的)物质的质量。
,中考题型分类示例)
根据化学式的计算
【例1】(2016广州中考)乙硫醇(化学式为C2H6S)易挥发,有蒜臭味,人对该气体极其敏感,下列有关乙硫醇的说法不正确的是( )
A.乙硫醇的相对分子质量为62
B.乙硫醇中C、H、S三种元素的质量比为2∶6∶1
C.硫元素的质量分数是
32
12×2+1×6+32
×100%
D.在管道煤气中添加微量乙硫醇,目的是及时发现煤气泄漏
【解析】A项,乙硫醇的相对分子质量为:12×2+1×6+32=62,正确;B项,2∶6∶1为乙硫醇中C、H、S 的原子个数比,这三种元素的质量比应为12∶3∶16,故B错;C项,乙硫醇中硫元素的质量分数是
32
12×2+1×6+32
×100%,正确;D项,乙硫醇有蒜臭味,人对该气体极其敏感,可以通过该气体的气味来判断煤气是否泄漏,D正确。
故选B。
【答案】B
1.(2016南昌中考)南昌汉代海昏侯墓出土的文物中,保存完好的玉器非常罕见。
对玉石的主要成分(化学式为NaAlSi2O6)的描述正确的是( D )
A.含有3个氧分子
B.相对分子质量为94
C.钠元素的质量分数为13.4%
D.钠元素与铝元素的质量比为23∶27
2.(2016南充中考)我国科学家屠呦呦发现青蒿素(化学式为C15H22O5)并运用于医学治疗,为人类医学作出巨大贡献,因而获得2015年诺贝尔生理学奖及医学奖。
关于青蒿素的说法正确的是( D ) A.青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的
B.青蒿素的相对分子质量为282g
C.青蒿素中碳、氢、氧元素的质量比为15∶22∶5
D.青蒿素由三种元素组成
【例2】(2016安顺中考)某品牌洁厕灵的成分是硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl 的质量,取20g 该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH 值变化的部分数据如图表所示:(已知BaCl 2溶液的pH =7)
求:
(1)完全反应后生成沉淀的质量为________;
(2)计算该洁厕灵溶液中HCl 的质量分数为多少?(计算结果保留至0.1%) 【答案】(1)由题意可知:H 2SO 4完全反应后产生BaSO 4沉淀的质量是4.66g 。
(2)设与H 2SO 4反应的Ba(OH)2质量为x 。
Ba(OH)2+H 2SO 4===BaSO 4↓+2H 2O 171 233
x 4.66g
171233=x 4.66g
x =3.42g 则与H 2SO 4反应的Ba(OH)2溶液质量为:3.42g
17.1%=20g ,则与HCl 完全反应的Ba(OH)2溶液的质量为:60g -20g
=40g 。
设20g 该品牌洁厕灵溶液中HCl 的质量为y 。
Ba(OH)2+2HCl===BaCl 2+2H 2O 171 73 40g ×17.1% y
17173=40g ×17.1%y
y =2.92g 该洁厕灵溶液中HCl 的质量分数为:2.92g 20g
×100%=14.6%
答:(1)4.66g ;(2)计算该洁厕灵溶液中HCl 的质量分数为14.6%。
3.(2016青海中考)现有含杂质的氢氧化钙样品10g ,向其中加入10%的盐酸溶液73g 恰好完全反
应(杂质不参加反应),求样品中氢氧化钙的质量分数。
解:设样品中Ca(OH)2的质量为x 。
Ca(OH)2+2HCl===CaCl 2+2H 2O 74 73
x 73g ×10%
74
x =7373g ×10%
x =7.4g
样品中Ca(OH)2的质量分数为
7.4g
10g
×100%=74% 答:样品中Ca(OH)2的质量分数为74%。
4.(2015青海中考)某工厂化验室常用10%的氢氧化钠溶液测定工业废水中硫酸的含量。
(1)若配制10%的氢氧化钠溶液200g ,需要称取氢氧化钠的质量是________g 。
(2)取该氢氧化钠溶液40g 恰好能将100g 废水中的硫酸中和,求废水中硫酸的质量分数(写出计算过程)。
解:(1)需要称取NaOH 的质量为200g×10%=20g ; (2)设废水中硫酸的质量为x 。
2NaOH +H 2SO 4===Na 2SO 4+2H 2O 80 98 40g ×10% x 8040g ×10%=98
x
x =4.9g
废水中硫酸的质量分数为4.9g
100g ×100%=4.9%
答:(1)20g ;(2)废水中硫酸的质量分数为4.9%。
1.艾草中含有的黄酮素(C 15H 11O 2)有很高的药用价值,关于黄酮素的说法正确的是( A ) A .是一种有机化合物 B .氧元素的质量分数为9.4% C .由27个原子构成
D .碳、氢、氧三种元素间的质量比为15∶11∶2
2.酸奶中含有的乳酸对健康是有益的,乳酸的化学式为(C 3H 6O 3)。
请计算: (1)乳酸中碳、氢、氧元素的质量比为__6∶1∶8__(填最简整数比)。
(2)18g 乳酸中氧元素的质量为__9.6__g 。
含氧元素的质量分数为__53.3%__。
3.某学习小组为测定某硫酸厂排放的废水中的硫酸含量,进行如下实验:取50g 废水于烧杯中,滴入质量分数为10%的氢氧化钠溶液(假定废水中其他成分不与氢氧化钠反应),当废水pH________(选填“>7”“=7”或“<7”)时恰好完全反应,测得消耗该氢氧化钠溶液8g ,据此计算该废水中硫酸的质量分数。
解:氢氧化钠和稀硫酸发生中和反应时,当废水pH =7时反应恰好完全, 设废水中硫酸的质量分数为x 。
H 2SO 4+2NaOH===Na 2SO 4+2H 2O 98 80
50g ×x 8g ×10%
9850g ×x =80
8g ×10%
x =1.96%
答:pH =7;废水中硫酸的质量分数为1.96%。