睾酮测定试剂盒(磁微粒化学发光法)产品技术要求北京美联泰科
- 格式:docx
- 大小:151.53 KB
- 文档页数:3

睾丸酮定量检测试剂盒(酶联免疫法)说明书目录●产品名称●包装规格●预期用途●检验原理●主要组成成分●储存条件及有效期●适用仪器●样本要求●检验方法●参考值(参考范围)●检验结果的解释●检验方法的局限性●产品性能指标●注意事项●参考文献●生产企业●医疗器械生产企业许可证编号●医疗器械注册证书编号●产品标准编号●说明书批准及修改日期产品名称通用名:睾丸酮定量检测试剂盒(酶联免疫法)英文名称:Testosterone ELISA包装规格96人份/盒预期用途定量检测样品血清或血浆中睾丸酮激素(T)的浓度。
睾丸激素(17β-hydroxy-4-androstene-3-one)是C19类固醇,C-4和C-5不饱和结合,C-3酮和C-17羟基在β的位置。
分子量为288.47。
睾丸激素是血液中非常重要的男性激素,由睾丸莱迪希细胞分泌;女性睾丸激素大约50%来自外围雄烯二酮的交换,约25%来自卵巢,约25%来自肾上腺。
睾丸激素维系男性第二性特征,测量这个激素对检查性腺机能非常重要。
对于女性来说,男性型多毛症、男性化、肾上腺肥大、多囊卵巢等都可以导致睾丸激素水平增高;对于男性来说,下丘脑垂体病变,睾丸瘤,先天性肾上腺增生和前列腺疾病等都可导致睾丸激素升高。
睾丸激素水平低则由于垂体机能减退,Klinefelter综合症,睾丸切除术和隐睾病,酶缺陷及自体免疫疾病等引起。
检验原理特异的T抗体包被在每个微孔表面。
样本中的T在微孔中与特异的单克隆抗体、酶结合物(抗-T抗血清结合辣根过氧化物)一起孵育,形成“三明治”夹心。
孵育过后洗脱未结合的物质。
结合的辣根过氧化与样本中睾丸激素的浓度成反比。
添加底物溶液,血清T浓度与显色强度成反比。
主要组成成分1.单克隆抗体包被的可拆卸的96(12×8)孔微孔板1块2.T标准品(0、0.2、0.5、1、2、6、16ng/ml)1ml/瓶7瓶3.酶结合物25ml1瓶4.底物溶液25ml1瓶5.终止液14ml1瓶6.洗液(40X浓缩)30ml1瓶7.说明书1份注:a)不同批号的试剂盒各组份不可以互换使用。
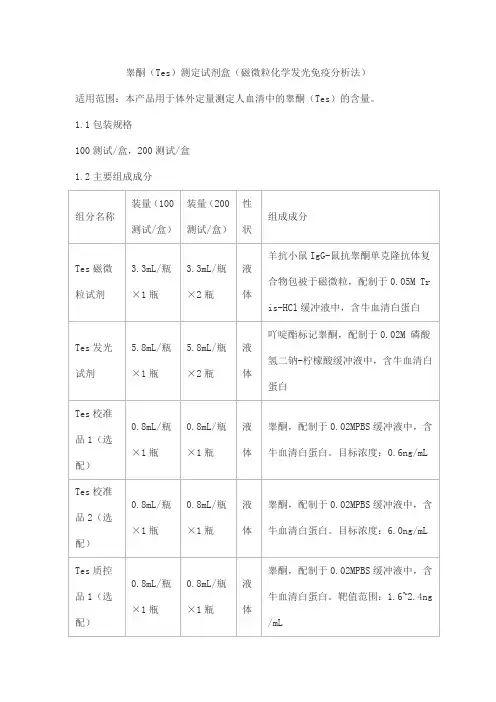
睾酮(Tes)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清中的睾酮(Tes)的含量。
1.1包装规格100测试/盒,200测试/盒1.2主要组成成分注:1.不同批号试剂盒中各组分不可以互换使用。
2. 校准品和质控品具有批特异性,具体浓度见瓶签。
2.1外观试剂盒各组分应齐全、完整、液体无渗漏;磁微粒试剂摇匀后为棕色含固体微粒的均匀悬浊液,无明显凝集;其他液体组分应澄清,无沉淀或絮状物;包装标签应清晰,易识别。
2.2 装量各组分装量应不得低于标示体积。
2.3溯源性根据GB/T21415-2008及有关规定,提供试剂盒内校准品的来源、赋值过程以及测量不确定度等内容,溯源至企业一级校准品,一级校准品用纯品质量赋值,与已上市产品比对验证。
2.4线性在[0.2,20.0 ]ng/mL范围内,相关系数r应不低于0.9900。
2.5空白限应不高于0.1 ng/mL。
2.6准确度回收率应在85.0%~115.0%范围内。
2.7重复性变异系数(CV)应不大于8.0%。
2.8质控品的测定值质控品的测定结果均应在规定的质控范围内。
2.9特异性2.9.1 与孕酮(Prog)浓度不低于100 ng/mL的Prog在本试剂盒上的测定结果应不高于0.25 ng/mL。
2.9.2 双氢睾酮浓度不低于10 ng/mL的双氢睾酮在本试剂盒上的测定结果应不高于0.25 ng/mL。
)2.9.3 与雌二醇(E2浓度不低于10 ng/mL的E在本试剂盒上的测定结果应不高于0.25 ng/mL。
22.10批间差在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.11稳定性试剂盒在2~8℃保存,有效期为12个月,在有效期结束的前后两个月内,检测试剂盒的线性、空白限、准确度、重复性、质控品的测定值,应符合相应的规定。


全自动化学发光免疫分析仪适用范围:该产品采用基于化学发光底物(APS-5)和碱性磷酸酶的间接化学发光法,与配套的检测试剂共同使用,在临床上用于对来源于人体的血清、血浆、全血样本中的被分析物进行定性或定量检测。
1.1 产品型号MS-Fast1.2 结构组成全自动化学发光免疫分析仪主要由直流电源、控制模块、测读模块、温育模块、运动模块、液晶屏、打印机、外壳及软件(软件发布版本:V01)组成。
2.1 正常工作条件2.1.1电源电压:220V±22V,50Hz±1Hz;2.1.2环境温度:10℃~30℃;2.1.3相对湿度:≤70%;2.1.4大气压力:85.0kPa~106.0kPa;2.1.5远离强磁场干扰源;2.1.6避免强光直接照射;2.1.7具有良好的接地环境;2.1.8开机预热时间不小于30min。
2.2 外观外观应满足如下要求:2.2.1 外观应整洁,无裂纹或划痕,文字和标识清晰;2.2.2 分析系统运动部件应平稳,不应卡住突跳;2.2.3 紧固件连接应牢固可靠,不得有松动。
2.3 反应区温度控制的准确性和波动性温度准确性应在设定值的±0.5℃,波动度不超过1.0℃。
2.4 分析仪稳定性分析仪开机处于稳定工作状态后第4小时、第8小时的测试结果与处于稳定工作状态初始时的测试结果的相对偏倚不超过±10%。
2.5 批内测量重复性批内测量重复性(CV,%)≤8%。
2.6 线性相关性在不小于2个数量级的浓度范围内,线性相关系数r≥0.99。
2.7 通道一致性分析仪的通道相对极差应≤10%。
2.8 分析仪主要功能2.8.1 仪器能自动完成不同项目的测试、分析的功能;2.8.2 仪器具备开机自检功能;2.8.3 仪器对门的错误操作有相应的提示功能;2.8.4 仪器具备对测试结果的打印功能。
2.9 安全要求本仪器安全要求应符合以下标准适用条款的要求。
GB4793.1-2007测量、控制和实验室用电气设备的安全要求第1部分:通用要求;GB4793.6-2008 测量、控制和实验室用电气设备的安全要求第6部分:实验室用材料加热设备的特殊要求;GB4793.9-2013测量、控制和实验室用电气设备的安全要求第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求;YY 0648-2008测量、控制和实验室用电气设备的安全要求第2-101部分:体外诊断(IVD)医用设备的专用要求。

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242号)化学发光免疫类体外诊断试剂(盒)产品分类代号为6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第44号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。
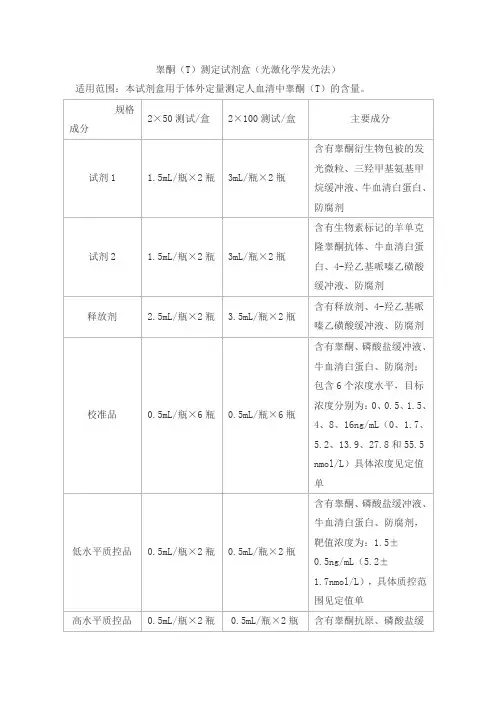
睾酮(T)测定试剂盒(光激化学发光法)
适用范围:本试剂盒用于体外定量测定人血清中睾酮(T)的含量。
说明:
1. 校准品靶值批特异,详见定值单。
2. 质控品质控范围批特异,详见定值单。
2.1 外观
试剂盒组分齐全,内外包装均完整,标签清晰,液体试剂无渗漏。
2.2 检出限
试剂盒的检出限不高于0.10ng/mL(0.35nmol/L)。
2.3 准确度
用国家参考物质GBW09197、GBW09198、GBW09199作为样本进行检测,其测量结果的相对偏差应该在±15%内。
2.4 线性
在[0.1,16]ng/mL([0.35,55.5]nmol/L)区间内,试剂盒的相关系数r应≥0.9900。
2.5 重复性
质控品测定结果的变异系数(CV)应不大于10.0%。
2.6 批间差
在三个不同批次产品之间,质控品测定结果的变异系数(CV)应不大于15.0%。
2.7 质控品测定值
同一套质控品的测定结果应在本试剂盒规定的范围之内。
2.8 特异性
浓度为10ng/mL二氢睾酮、100ng/mL的孕酮、10ng/mL的雌二醇本试剂盒上测定的浓度均应≤0.25ng/mL(0.87nmol/L)。
2.9 稳定性
取2℃~8℃保存至效期末后3个月内的试剂盒,检测2.1、2.2、2.3、2.4、2.5、2.7、2.8项,结果应符合相应规定。
2.10 溯源性
依据GB/T 21415-2008及有关规定提供所用校准品的来源、赋值过程以及测量不确定度等内容,校准品溯源至国家标准物质GBW09199。

核准日期:XXXX年X月X日睾酮定量检测试剂盒睾酮定量检测试剂盒((磁分离酶联免疫法磁分离酶联免疫法))说明书【品名品名】】睾酮定量检测试剂盒(磁分离酶联免疫法) 【用途用途】】本品是为定量测定人血清或血浆内睾酮(T)而设计的。
本方法适用样品浓度范围为0.1-17ng/ml(0.3-59nmol/l)。
【概述和说明概述和说明】】睾酮(17β-羟-4-雄烯3-酮)是含19个碳原子的类固醇激素,分子量288.4道尔顿。
睾酮是由男性睾丸间质(莱迪希)细胞产生的主要雄性激素。
此外,肾上腺和女性卵巢有少量分泌[1,2,3]。
睾酮分泌入血液后,大部分以与蛋白结合的形式存在,占总量98%以上,其中约60%与性激素结合球蛋白(SHBG)结合,这部分与游离型激素间保持一动态平衡;约38%与白蛋白结合,此结合属非特异性结合,比较疏松,易于解离而进入靶组织;另有少量可与皮质醇结合球蛋白(CBG )等结合。
睾丸的功能受两种垂体激素——促卵泡激素(FSH)和促黄体生成激素(LH)调节。
其中LH 直接作用于莱迪希细胞促使其分泌睾酮,对睾酮的生成起主要调控作用。
男性睾酮对胎儿期及青春期的男性性分化和生殖器官的发育,及男性整个生命过程中生殖系统和第二性征的生长、发育和维持起决定性作用[2]。
男性血清睾酮的含量测定,可用于研究和评价下列疾病如性腺机能减退、肾上腺/性腺肿瘤、性早熟和青春期延迟、睾丸雌化以及某些先天性疾病(如:先天性曲细精管发育不良综合症、肾上腺增生症、新生儿两性畸形等)[2,4,5]。
对于女性,血清睾酮含量的测定可用于初步诊断因服用雄激素或雄激素产生过量而引起的男性化、多囊卵巢症和多毛症等[6,7,8]。
【原理原理】】本方法为酶联免疫系统与磁性微粒分离技术相结合的一种测定法,并使用了一种高亲合力的抗体。
标本,质控品和标准品中的T (A)与限量的碱性磷酸酶标T 衍生物(B)同定量荧光素标T 多克隆抗体竞争结合(C)。

睾酮(Tes)化学发光试剂盒使 用 说 明 书济南杏恩生物科技有限公司睾酮(Tes)化学发光试剂盒说明书【检测目的】定量分析人的血清或血浆中睾酮(Testosterone, Tes)的浓度。
孕酮增高见于诊断女性患男性化肿瘤、女性两性畸形、睾丸间质细胞癌、先天性肾上腺皮质增生、肾上腺肿瘤,也可见于部分多囊卵巢综合症、肥胖及注射睾酮和促性腺激素。
降低见于先天性睾丸不发育或发育不全、xlinefelter综合症、睾丸炎或X 照射后、垂体前叶体能减退、性腺功能及甲亢肝硬化肾功能损伤。
评价多囊卵巢综合症的疗效,治疗后睾酮水平下降。
【产品原理】本公司睾酮(Testosterone, Tes)化学发光试剂盒的原理为: 将Tes单抗体包被于96孔微孔板,病人的血清或血浆加入微孔中,再加入睾酮(Tes)抗体和标记的睾酮(Tes)与病人血清或血浆中睾酮(Tes)含量做竞争反应,属于抗原-抗体竞争法。
15分钟后,洗板,去除多余未反应的结合物。
再由机器自动加注发光底物1与结合物氧化反应,5分钟,机器自动加注发光底物2的增敏触酶后,即时于1秒内发出光的讯号 (闪烁发光)。
藉由机器自动控制每加注一孔后立即测读,检测光的强度,并由相对应的标准曲线计算出病人的浓度。
【产品适用范围】本产品适用于检测人体的血清或血浆中睾酮(Testosterone, Tes)的含量浓度【试剂盒组成】1. 睾酮 (Tes) 包被板:可拆板,8×12孔。
2. 睾酮 (Tes) 标准品:6小管,0.2ml/管,各个标准品浓度分别为 0,0.1, 0.5,2.0,6.0和 18.0 ng /ml。
1%BSA, PBS PH7.4-7.53. 睾酮 (Tes) 抗体: 5 ml, 1瓶。
含Anti-Tes 1%BSA, PBS PH7.4-7.54. 睾酮 (Tes) 标记偶合液:1瓶,10ml/瓶。
含Anti-Tes hrpo 1%BSA, PBS PH7.4-7.55. 睾酮 (Tes) 低质控对照品: 0.15ml/管。
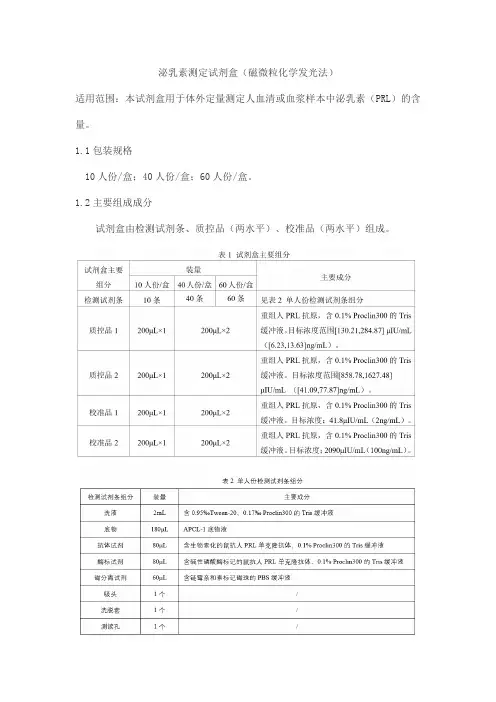
泌乳素测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆样本中泌乳素(PRL)的含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至国际标准品98/580。
2.3准确度在试剂盒规定的剂量反应曲线范围内检测泌乳素国家(或国际)标准品98/580,其测量结果的相对偏差应±10%范围内。
2.4空白限:应不高于5.225μIU/mL(0.25ng/mL)。
2.5线性在[10.45,4180] μIU/mL([0.5,200] ng/mL)的线性区间内,相关系数(r)应不低于0.990。
2.6精密度2.6.1批内精密度CV≤8.0%。
2.6.2批间精密度CV≤15.0%。
2.7质控品赋值有效性同一套质控品的测定结果应在本试剂盒规定的范围内。
2.8 特异性测定浓度为200ng/mL的人生长激素(GH)样本,其测定结果应不高于20μIU/mL(0.96ng/mL)。
2.9校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.10稳定性2.10.1效期稳定性试剂盒2~8℃条件下保存至效期末,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
2.10.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品批内精密度和质控品测定值,应符合2.6.1和2.7的要求。
2.10.3 校准品开瓶稳定性校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确度和线性,应符合2.3和2.5的要求。

睾酮测定试剂盒(化学发光免疫分析法)
适用范围:用于体外定量测定人血清中睾酮的浓度水平。
1.1规格
96T。
1.2 组成
2.1 外观
a)包装标签应清晰、无磨损;
b)试剂盒各组份应齐全、包装完好,液体无渗漏。
2.2 线性
本试剂盒的线性范围为:[0.1 ,32] ng/mL。
线性相关系数r≥0.9900。
2.3空白限
不大于0.1ng/mL。
2.4准确度
回收率应在(85%~115%)范围内。
2.5重复性
重复检测质控品Q1和 Q2各10次,其批内变异系数(CV)应不大于10%。
2.6批间差
用三个批号的试剂盒检测质控品Q1和 Q2,三批号试剂盒之间的批间变异系数(CV)应不大于15%。
2.7质控品赋值有效性
质控品测量值应在质控范围内。
2.8特异性
2.8.1与雌三醇的交叉反应
检测浓度为32ng/mL的雌三醇,交叉反应率应小于1%。
2.8.2与雌二醇的交叉反应
检测浓度为32ng/mL的雌二醇, 交叉反应率应小于1%。
2.9稳定性
规定产品2℃~8℃储存,有效期6个月。
取到效期后的样品检测准确度、空白限、线性、重复性,应符合2.2~2.5的要求。
2.10溯源性
根据《GB/T 21415—2008 体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源,赋值过程以及不确定度等内容,校准品溯源至企业工作校准品。

睾酮Testo测定标准操作规程1 检验目的规范本实验室的检验操作,确保睾酮(Testo)检测结果及报告的准确性、可靠性和有效性。
2 标本采集与处理2.1 标本采集2.1.1 常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
也可采集血浆标本,用肝或EDTA抗凝。
2.1.2 检验申请单和血标本试管标上统一且唯一的标识符(条码)。
2.1.3 急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4 标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1 标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2 对反应吸光度有干扰的标本,包括严重溶血、严重浑浊的标本。
2.1.5.3 无法确认标本与申请单对应关系的。
其他如标识涂改、标本试管破裂等。
2.2 标本保存2.2.1 接收标本后在60min内将标本离心分离出血浆, 避免溶血。
离心必须达到4000rpm×15min,离心后的血清中不能含有颗粒物或微量纤维蛋白。
2.2.2 标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定2d,在-20℃最多可保存4周。
避免反复冻融。
2.2.3 已完成测试的标本保持完整的识别号,置4~8℃冰箱内保存7d。
2.3 标本采集的注意事项采血前使受检者保持平静、松弛、避免剧烈活动。
3 方法原理竞争法酶联免疫发光分析原理。
标本中睾酮与碱性磷酸酶标记的睾酮竞争结合包被在磁性微粒子上的抗睾酮抗体,形成微粒子-鼠抗睾酮抗体-(睾酮或睾酮-ALP)免疫复合物。
经磁性分离,洗涤洗去未结合的物质,加入化学发光底物Lumi-Phos 530,经碱性磷酸酶的作用产生光子,光子的量与标本中睾酮的量成反比,从标准曲线中可计算待测睾酮的量。
4 试剂及其他用品4.1 试剂:Access 睾酮测定试剂包,由美国BECKMAN COULTER公司出品,试剂盒产品号33560。
睾酮(T)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中睾酮的浓度。
1. 产品型号/规格及其划分说明1.1包装规格96人份/盒、48人份/盒。
1.2 主要组成成分注:校准品S0~S5靶值:0ng/mL、0.5ng/mL、2.5ng/mL、5ng/mL、10ng/mL、20ng/mL。
2. 性能指标2.1 外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2 准确度将已知浓度的睾酮加入到正常血清中,其回收率应在85%~115%之间。
2.3 最低检测限最低检测限应不大于0.2ng/mL。
2.4 线性在[0.5,20]ng/mL浓度范围内,相关系数(r)绝对值应不小于0.990。
2.5 重复性用高低两个浓度的样本,各重复检测10次,变异系数(CV)应不大于12.0%。
2.6 批间差用三个批号试剂盒检测同一样本,则三个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.7 特异性特异性符合如下要求:a)含浓度不低于50ng/mL的孕酮的零浓度T样本,检测结果不高于0.4ng/mL;b)含浓度不低于10000pg/mL的雌二醇的零浓度T样本,检测结果不高于0.4ng/mL。
2.8 稳定性2℃~8℃放置8个月后,测定结果应符合2.1~2.5各项要求。
2.9 校准品溯源性本产品校准品依照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求进行溯源,本产品校准品溯源至企业校准品,该校准品通过雅培检测系统比对赋值。
睾酮定量分析酶联免疫检测试剂盒- 仅供科学研究使用 -- For reseach use only -1.简介睾酮(17 Hydroxy-4-Androstene-3-on)是C19类固醇激素,分子量288,是哺乳动物最重要的雄性激素之一。
雄性体内的睾酮主要由睾丸合成;雌性由卵巢和肾皮质合成。
在血浆中的睾酮由β球蛋白负责运输,称为性激素结合球蛋白(SHBG)。
在循环系统中,有多达98%的睾酮以结合形式存在,游离睾酮在靶组织中,通过酶降解形成具有生理学活性的二氢睾酮。
睾酮与雄性第二性征的产生有关,测定其浓度对判断性腺发育不全很有意义。
在雌性,睾酮水平增高多见于多毛症,在人类女性中,睾酮水平增高表现女性男性化,多囊卵巢,卵巢癌,肾上腺肿瘤和肾上腺增生。
在人类男性中,睾酮水平增高与下丘脑垂体病变,睾丸肿瘤,先天性肾上腺增生和前列腺癌有关。
低睾酮水平可见于下列疾病:垂体功能减退、先天性睾丸发育不全、睾丸女性化、睾丸切除术、隐睾病、酶缺陷和一些自身免疫性疾病。
2.检测原理睾酮试剂盒采用竞争法检测原理。
在酶标板预包被了高特异性识别睾酮的抗体,同时加入样本和HRP连接的睾酮结合物,样本中睾酮与睾酮结合物竞争性结合酶标板中包被的抗体。
洗去游离的未结合的睾酮与睾酮结合物,加入TMB底物,与抗体结合的睾酮结合物上带的HRP就会催化底物TMB反应,颜色显蓝色,中止后显黄色。
如果样本中睾酮含量越多,则与包被的抗体结合的睾酮结合物则越少,颜色则越浅,即颜色与样本中的浓度成反比。
本试剂盒主要用于定量检测哺乳动物血清、血浆及细胞上清中的睾酮含量3.试剂盒组成3.1、预包被板 12条/6条(96T/48T);3.2、标准品6管,每管0.5ml/0.25ml(96T/48T),浓度如下表:Standard A B C D E Fng/ml 0.2 0.5 1 2 6 163.3、样本稀释液,1瓶16ml/8ml(96T/48T);标准曲线中0浓度标准品以样本稀释液直接加入。
睾酮(Testosterone)测定试剂盒(电化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人体血清样本中睾酮(Testosterone)的含量。
1.1包装规格:50人份/盒、100人份/盒。
1.2主要组成成分试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(Testosterone-Cal)(选配)组成。
组成及含量见下表:注:1、定标品靶值批特异,详见靶值单。
2、试剂盒条码卡内含主校准曲线。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.025ng/mL。
2.3 准确度将已知浓度的Testosterone标准溶液加入到血清中,其回收率应在(85%~115%)范围内。
2.4 线性在[0.10,15.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 分析内精密度在试剂盒的线性范围内,浓度为(1.0±0.2ng/mL)和(5.0±1.0ng/mL)的样品检测结果的变异系数(CV)应不大于8%。
2.5.2 批间精密度在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为(1.0±0.2ng/mL)和(5.0±1.0ng/mL)的样品,检测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性依据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供睾酮(Testosterone)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至企业工作校准品。
孕酮测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人体血清或血浆中的孕酮(P)含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至本公司的工作校准品。
2.3准确度将已知浓度的孕酮(P)加入到低值样品中,其回收率应在85%~115%范围内。
2.4检出限应≤0.64nmol/L (0.2ng/mL)。
2.5线性范围在[0.64-127.20]nmol/L([0.2,40]ng/mL)的线性范围内,相关系数r 应≥0.9900。
2.6重复性CV≤10%。
2.7批间差CV≤15%。
2.8质控品赋值有效性测定值在质控品质控范围内。
2.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为64nmol/L (20.1ng/mL)(允许相对偏差为±15%),潜在干扰物浓度分别为10ng/mL的皮质酮和10ng/mL的17α-羟孕酮。
各个样本测量结果的均值应在目标浓度平均值(M)±2标准差(SD)范围内。
2.10校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、检出限、线性范围、重复性、质控品赋值有效性和特异性,应符合2.1、2.3、2.4、2.5、2.6、2.8和2.9的要求。
2.11.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
睾酮(T)测定试剂盒(化学发光免疫分析法)适用范围:本产品用于体外定量测定人血清中的T的含量。
1.1 产品规格试剂盒规格为48人份/盒、96人份/盒。
1.2 主要组成成分表1 睾酮(T)测定试剂盒(化学发光免疫分析法)主要组成成分a) 酶结合物以含牛血清白蛋白的缓冲液配制的联接HRP的T,其中含ProClin300做为防腐剂。
b) 反应抗体:以含牛血清白蛋白的缓冲液配制的T单克隆抗体,其中含ProClin300做为防腐剂。
c) 校准品校准品主要是牛血清白蛋白的缓冲液,其中含ProClin300做为防腐剂,校准品A~F中含T的目标浓度分别约为0、0.25µg/L、1.0µg/L、5.0µg/L、10µg/L、50µg/L。
校准品具体浓度详见标签及试剂盒参数IC卡。
d) 发光液发光液A主要成份为鲁米诺,发光液B主要成份为过氧化脲,两者均以pH8.6的Tris-HCl缓冲液配制。
e) 包被微孔板包被有羊抗鼠白色聚苯乙烯微孔板,用铝箔袋真空包装。
f) 质控品(备选)以正常人血清为基质制备的冻干品,其中含ProClin300做为防腐剂,其靶值浓度范围QCⅠ为1.20 µg/L~3.00 µg/L,QCⅡ为8.50 µg/L~24.00 µg/L。
质控品具体浓度详见质控品参数卡。
不同批号试剂盒中的相同组分不能互换。
2.1 外观a)液体组分应澄清,无沉淀或絮状物,实际装量应不小于标示装量;b)冻干组分呈白色或淡黄色疏松体,加水后应在3分钟内完全溶解;c)所有组分均无包装破损,标示清楚。
2.2 准确度按照EP9-A2文件要求与西门子公司化学发光免疫法睾酮试剂进行比对,本试剂和比对试剂测定样本的浓度相关系数大于0.95,回归系数在0.80~1.20之间。
2.3剂量—反应曲线的线性用Logit-Ln数学模型拟合,在[0.15,50] µg/L范围内,剂量-反应曲线相关系数(r)的绝对值应不低于0.9900。
促甲状腺激素测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆样本中促甲状腺激素(TSH)的含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(冻干品,两水平)、校准品(冻干品,两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;冻干组分呈疏松体,复溶后液体均匀(无肉眼可见颗粒、无沉淀);中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至国家标准品150530。
2.3准确性对TSH国家标准品150530进行检测,其测量结果的相对偏差应不高于±15.0%。
2.4空白限应不高于0.1mIU/L。
2.5线性在[0.2, 50] mIU/L区间内,剂量-反应曲线相关系数(r)应不小于0.9900。
2.6精密度2.6.1分析内精密度CV≤8%。
2.6.2批间精密度CV≤20%。
2.7质控品测定值同一套质控品的测定结果应在本试剂盒规定的范围内。
2.8 特异性浓度不低于200IU/L的FSH,在本试剂盒上的测定结果应不高于本试剂盒的最低检出量水平。
浓度不低于200IU/L的LH,在本试剂盒上的测定结果应不高于本试剂盒的最低检出量水平。
浓度不低于1000IU/L的HCG,在本试剂盒上的测定结果应不高于本试剂盒的最低检出量水平。
2.9校准品和质控品瓶间差校准品瓶间差CV≤10%质控品瓶间差CV≤10%2.10稳定性2.10.1效期稳定性试剂盒2℃~8℃条件下保存至效期末,检验结果应符合2.1、2.3、2.4、2.5、2.6.1、2.7的要求。
2.10.2质控品复溶稳定性质控品复溶开瓶后,在2℃~8℃密封避光保存,在3天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
睾酮测定试剂盒(磁微粒化学发光法)
适用范围:本试剂盒用于体外定量测定人体血清或血浆中的睾酮(T)含量。
1.1包装规格
10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分
试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观
试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性
根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度
对睾酮冰冻人血清国家标准品360034进行检测,其测量结果的相对偏差应不高于±15.0%。
2.4空白限
应不高于0.1ng/mL。
2.5线性
在[0.2,16] ng/mL的线性范围内,相关系数r应≥0.9900。
2.6重复性
对质控品1、质控品2各测试10次,CV≤10%。
2.7批间差
用三个批号的试剂盒对质控品1、质控品2各测试10次,其测量结果的变异系数CV≤15%。
2.8质控品赋值有效性
测定值在质控品质控范围内。
2.9 特异性
测定浓度为100ng/mL的孕酮、10ng/mL的双氢睾酮、10ng/mL的雌二醇样本,其测定结果应不高于0.2ng/mL。
2.10校准品和质控品瓶间差
校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.11稳定性
2.11.1效期稳定性
取效期后的试剂盒检测外观、准确度、空白限、线性、重复性和质控品赋值有效性,应符合2.1、2.3、2.4、2.5、2.6和2.8的要求。
2.11.2 质控品开瓶稳定性
质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
2.11.3 校准品开瓶稳定性
校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确度和线性,应符合2.3和2.5的要求。