第四单元分子间作用力分子晶体
- 格式:doc
- 大小:51.00 KB
- 文档页数:2





专题三微粒间作用力与物质性质第四单元分子间作用力分子晶体第1课时范德华作用力一、学习目标1.了解范德华力的概念及其成因。
2.了解范德华力的特点及其对物质物理性质的影响,能用分子的相对分子质量比较判断范德华力的大小,从而强化证据推理与模型认知的学科核心素养。
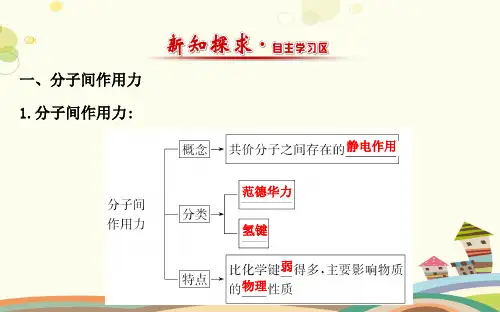
二、学习过程(一)自主学习,梳理内容要点一、分子间作用力1.定义:把聚集在一起的的作用力。
2.实质:是一种,它比化学键。
3.分类:和是最常见的两种分子间作用力。
二、范德华作用力1.范德华作用力的概念:是分子之间普遍存在的一种,它使得许多物质能以一定的凝聚态(固态或液态)存在。
2.范德华力的成因a.取向力当极性分子和极性分子相互接近时,它们的固有偶极的同极相斥而异极相吸,就使得极性分子按一定方向排列,因而产生了分子间的作用力,这种力叫。
分子极性越强,取向力越大。
这种力只存在于极性分子与极性分子之间。
b.诱导力当极性分子和非极性分子相接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,而产生诱导偶极,然后诱导偶极与极性分子固有偶极相互吸引。
这种由于诱导偶极而产生的作用力,称为。
这种力产生于极性分子与非极性分子之间,当然极性分子与极性分子之间也互相诱导,因而也有这种力。
c.色散力从统计观点看,非极性分子没有极性,但组成分子的正、负微粒总是在不断地运动着,在某一瞬间,对多个分子而言总可能有分子出现正、负电荷重心不重合,而成为偶极子,这种偶极叫。
对大量分子,这种瞬时偶极的存在就成为经常性的,这种靠瞬时偶极产生的作用力叫色散力。
3.范德华力的特点①范德华力存在于固态﹑液态﹑气态的任何微粒之间。
无性和性。
②范德华力比化学键得多。
③主要影响物质的等物理性质。
4.范德华力对分子构成的物质性质的影响①分子的物质,其相对分子质量越大,则越大,物质的熔沸点;(如:I2>Br2>Cl2>F2)。
②范德华力对物质的沸点、熔点、气化热、熔化热、溶解度、表面张力、粘度等物理性质有决定性的影响。

专题三第四单元分子间作用力分子晶体第1课时分子间作用力【学习目标】1.熟知常见的分子间作用力(范德华力和氢键)的本质及其对物质性质的影响。
2.会比较判断范德华力的大小,会分析氢键的形成。
【新知导学】一、范德华力1.分析讨论,回答下列问题:(1)液态苯、汽油等发生汽化时,为何需要加热?(2)降低氯气的温度,为什么能使氯气转化为液态或固态?(3)卤素单质F2、Cl2、Br2、I2,按其相对分子质量增大的顺序,物理性质(如颜色、状态、熔点、沸点)有何变化规律?2.上述事实能够说明:(1)固体、液体和气体中分子之间的________叫范德华力。
(2)一般来说,相对分子质量________,范德华力越大。
(3)范德华力一般没有方向性和饱和性,只要分子周围空间允许,当气体分子凝聚时,它总是________________________________________________________________________。
3.范德华力对物质性质的影响(1)对物质熔、沸点的影响①组成和结构相似的分子,相对分子质量________,范德华力________,物质的熔、沸点就越高。
例如熔、沸点:CF4<CCl4<CBr4<CI4。
②组成相似且相对分子质量相近的物质,分子电荷分布越不均匀,范德华力越大,其熔、沸点就越高,如熔、沸点:CO>N2。
③在同分异构体中,一般来说,支链数________,熔、沸点就越低,如沸点:正戊烷>异戊烷>新戊烷。
(2)对物质溶解度的影响溶质分子与溶剂分子之间的范德华力越______,溶解度越大。
【归纳总结】1.范德华力普遍存在于________、________和________分子之间。
2.影响范德华力的因素:主要包括__________、________________以及分子中电荷分布是否均匀等。
3.范德华力______,物质的________越高,______越大。

分子间作用力分子晶体分子晶体(molecular crystal)是由分子间的非共价作用力形成的晶体结构。
这种晶体结构由分散的分子通过弱的相互作用力组成,而不是由金属键或离子键组成的。
分子晶体是一类非常常见的晶体类型,包括有机晶体、冰晶体等。
范德华力是一种由于分子间电子云的偶极瞬时极化而产生的相互作用力。
它是分子晶体中最弱的一种作用力,但也是最普遍和最重要的。
范德华力随着分子间的距离增加而减弱,但随着分子间电荷分布的改变而变化。
范德华力的强度取决于分子的极性和大小。
氢键是另一种重要的分子间作用力。
它是一种特殊的电荷间相互作用力,通常涉及一个氢原子与一个电负性较大的原子(如氮、氧、氟)之间形成的相互作用。
氢键是一种强作用力,能够使分子更紧密地结合在一起。
它在水分子中的作用是形成水的固态结构(冰)的重要原因。
氢键也在很多有机分子晶体中起到关键作用。
π-π相互作用是一种特殊的分子间力,通常涉及芳香环中的π电子云之间的相互作用。
这种相互作用可以使芳香环平行排列并相互叠加,从而增强晶体的稳定性。
π-π相互作用对于一些有机分子晶体,如芳香族化合物晶体,具有重要的作用。
除了这些主要的分子间作用力,还有其他一些较弱的作用力也可以参与分子晶体的形成,例如离域电子的相互作用和疏水作用等。
分子晶体具有一些独特的性质和应用。
首先,它们通常具有较低的硬度和脆性,这是由于它们之间的非共价作用力较弱所致。
其次,分子晶体通常是电绝缘体,因为它们之间没有可以形成导电电子的共价键。
此外,由于分子晶体中分子之间的间隙,它们通常对溶剂和小分子具有较高的吸附能力。
这些特性使得分子晶体在材料科学、化学和生物学等领域具有广泛的应用,如药物晶体工程、分子传感器、光电器件等。
总之,分子间作用力是分子晶体形成的关键因素。
范德华力、氢键和π-π相互作用等主要作用力共同作用,通过将分子组装在一起形成晶体结构。
分子晶体具有一系列特殊性质和应用,成为材料科学和化学研究中的重要主题。

第四单元分子间作用力分子晶体第1课时范德华力氢键目标导航1.了解范德华力的实质及对物质的影响。
2.了解氢键的实质、特点、形成条件及对物质性质的影响。
知识精讲知识点01 范德华力1.分子间作用力(1)概念:将分子聚集在一起的作用力称为分子间作用力。
(2)存在:共价分子间都存在分子间作用力。
(3)特点:分子间作用力本质上是一种静电作用,比化学键弱得多。
(4)分类:范德华力和氢键是两种最常见的分子间作用力。
2.范德华力(1)存在:范德华力是一种普遍存在于固体、液体和气体分子之间的一种作用力。
(2)特点:与共价键相比,范德华力较小,一般没有饱和性和方向性。
(3)影响因素:①分子的大小、空间构型以及分子中电荷分布是否均匀。
②组成和结构相似的分子,其范德华力一般随着相对分子质量的增大而增大。
(4)对物质性质的影响:主要影响物质的熔点、沸点、溶解度等物理性质。
①分子间范德华力越大,物质的熔、沸点越高。
②溶质与溶剂分子间的范德华力越大,物质的溶解度越大。
【即学即练1】HCl、HBr、HI三种物质的热稳定性顺序是__________,熔、沸点高低顺序是_______________,请说明原因。
答案:HCl>HBr>HI HI>HBr>HCl因为键能HCl>HBr>HI,因此热稳定性顺序是HCl>HBr>HI;HCl、HBr、HI是结构相似的3种分子,相对分子质量越大,熔、沸点越高。
知识点02 氢键1.氢键的形成和表示H原子与电负性大、半径较小的原子X以共价键结合时,H原子能够跟另一个电负性大、半径较小的原子Y之间形成氢键,通常用X—H…Y表示。
上述X、Y通常指N、O、F等。
2.氢键的特点(1)氢键可以存在于分子之间,也可以存在于分子内部。
(2)氢键比化学键弱,比范德华力强。
(3)氢键有分子内氢键和分子间氢键两种。
3.氢键对物质物理性质的影响(1)含有分子间氢键的物质具有较高的熔点、沸点。


高二化学范德华力教案 Revised by Petrel at 2021第四单元分子间作用力分子晶体第一课时范德华力【学习目标】1.了解范德华力的类型,把握范德华力大小与物质物理性质之间的辨证关系2.初步认识影响范德华力的主要应素,学会辨证的质量分析法【学习内容】一、分子间作用力1.提出分子间存在作用力的依据气体分子能够凝聚成相应的固体或液体2.分子间作用力的本质存在于分子间的一种较弱的相互作用力。
3.分子间作用力的类型(1)取向力——极性分子之间靠永久偶极与永久偶极作用称为取向力。
仅存在于极性分子之间(2)诱导力——诱导偶极与永久偶极作用称为诱导力。
极性分子作用为电场,使非极性分子产生诱导偶极或使极性分子的偶极增大(也产生诱导偶极),这时诱导偶极与永久偶极之间形成诱导力,因此诱导力存在于极性分子与非极性分子之间,也存在于极性分子与极性分子之间。
(3)色散力——瞬间偶极与瞬间偶极之间有色散力。
由于各种分子均有瞬间偶极,故色散力存在于极性分子与极性分子、极性分子与非极性分子及非极性分子与非极性分子之间。
色散力不仅存在广泛,而且在分子间力中,色散力经常是重要的。
取向力、诱导力和色散力统称范德华力, 它具有以下的共性:(1)它是永远存在于分子之间的一种作用力。
(2)它是弱的作用力(几个——几十个kJ·mol-1)。
(3)它没有方向性和饱和性。
(4)范德华力的作用范围约只有几个pm。
(5)分子间的三种作用力。
其中对大多数分子来说色散力是主要的,水分子除外。
4.影响范德华力的因素阅读下表,分析影响范德华力的因素-1分子取向力诱导力色散力总和ArCOHIHBrHClNH3H2O(1)组成和结构相似的分子,相对分子质量越大,范德华力越大。
(2)分子的极性越大,范德华力越大,一般来说极性分子间的作用力大于非极性分子间的作用力。
5.范德华力对物质熔沸点的影响(1)结构相似,相对分子质量越大,范德华力越大,熔沸点越高(2)相对分子质量相同或相近时,分子的极性越大,范德华力越大, ,其熔沸点越高【科学探究】分子的偶极矩是衡量分子极性大小的物理量,分子偶极矩的数据可由实验测定。
[课堂练习]1.二氧化碳由固体(干冰)变为气体时,下列各项发生变化的是()A、分子间距离B、极性键C、分子之间的作用力D、离子键被破坏2.固体乙醇晶体中不存在的作用力是()A、离子键B、范德华力C、极性键D、非极性键3.SiCl4的分子结构与CH4类似,下列说法中不正确的是()A.SiCl4具有正四面体的构型B.在SiCl4和CCl4晶体中,前者分子间作用力比后者大C.常温下SiCl4是气体D.SiCl4的分子中硅氯键的极性比CCl4中的碳氯键强4.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( ) A.碘和干冰的升华 B.二氧化硅和生石灰的熔化C.氯化钠和铁的熔化 D.苯和已烷的蒸发5.分子间存在着分子作用间力的实验事实是()A.食盐、氯化钾等晶体易溶于水B.氯气在加压、降温时会变成液氯或固氯C.融化的铁水降温可铸成铁锭D.金刚石有相当大的硬度6.有关分子间作用力的说法中正确的是()A、分子间作用力可以影响某些物质的熔、沸点B、分子间作用力可以影响到由分子构成的物质的化学性质C、分子间作用力与化学健的强弱差不多D、电解水生成氢气与氧气,克服了分子间作用力7.根据人们的实践经验,一般来说,极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂,称为“相似相溶原理”,根据“相似相溶原理”判断,下列物质中,易溶于水的是,易溶于CCl4的是。
A、NH3B、HFC、I2D、Br28.下列物质的微粒中:A、氨气B、氯化钡C、氯化铵D、干冰E、苛性钠F、食盐G、冰H、氦气I、过氧化钠J、双氧水K、氢气。
⑴只有非极性键的是;⑵只有离子键的是;⑶只有极性键的是,其中又是非极性分子的是;⑷既有极性键又有非极性键的是;⑸既有离子键又有非极性键的是;⑹既有离子键又有极性键的是;⑺无任何化学键的是;⑻上述物质中存在范德华力的是;(用序号填空)。
氢键的形成练习
[课堂练习]
1.下列物质中不存在氢键的是()
A、冰醋酸中醋酸分子之间
B、一水合氨分子中的氨分子与水分子之间
C、液态氟化氢中氟化氢分子之间
D、可燃冰(CH4·8H2O)中甲烷分子与水分子之间
2.固体乙醇晶体中不存在的作用力是()
A、极性键
B、非极性键
C、离子键
D、氢键
3.下列说法不正确的是()
A、分子间作用力是分子间相互作用力的总称
B、范德华力与氢键可同时存在于分子之间
C、分子间氢键的形成除使物质的熔沸点升高外,对物质的溶解度、硬度等也有影响
D、氢键是一种特殊的化学键,它广泛地存在于自然界中
4.下列有关水的叙述中,可以用氢键的知识来解释的是()
A、水比硫化氢气体稳定
B、水的熔沸点比硫化氢的高
C、氯化氢气体易溶于水
D、0℃时,水的密度比冰大
[课后练习]
1.关于氢键的下列说法中正确的是()
A、每个水分子内含有两个氢键
B、在水蒸气、水和冰中都含有氢键
C、分子间能形成氢键使物质的熔点和沸点升高
D、HF的稳定性很强,是因为其分子间能形成氢键
2.下列各组物质中,熔点由高到低的是()
A、HI HBr HCl HF
B、石英、食盐、干冰、钾
C、CI4CBr4CCl4CF4
D、Li Na K Rb
3.下列变化或数据与氢键无关的是(D)
A.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
B.氨分子与水分子形成一水合氨
C.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大D.SbH3的沸点比PH3高
.D[说明]甲酸在低温时通过氢键形成双聚分子,温度升高时,双聚被破坏;氨分子和水分子易形成氢键;三氟甲烷由于氟强烈吸电子,使三氟甲烷中的氢带明显的正电荷,可以和丙酮形成氢键,放出能量,因此溶解时的热效应较大;SbH3和PH3都不能形成氢键,SbH3的沸点比PH3高是因为SbH3的分子量比PH3大,分子间作用力比PH3大。
4.自然界中往往存在许多有趣也十分有效的现象,下表列出了若干化合物的结构式、化学
00
从它们的沸点可以说明什么问题?
沸点的高低主要取决于分子间作用力,结构式相似的化合物,相对分子量越大沸点越高;结构式不相类似的化合物的沸点与其相对分子量的关系不大,分子间形成氢键的可能性越大沸点越高。
5.氢键可以表示为A—H…B,其产生的条件是A电负性大,它强烈地吸引氢的电子云,受体B具有能与氢原子强烈地相互作用的高电子云密度区(如孤对电子)。
(1)分子间形成的氢键会使化合物的熔、沸点;分子内形成氢键会使化合物的熔、沸点。
(2)在极性溶剂中,溶质和溶剂的分子间形成氢键会使溶质的溶解度(填“增大”或“减小”);溶质的分子内形成氢键时,在极性溶剂中溶质的溶解度将(填“增大”或“减小”);在非极性溶剂中溶质的溶解度将(填“增大”或“减小”)。
(3)IBr在CCl4中的溶解度比Br2,其原因是
(4)二聚甲酸解聚反应(HCOOH)2→2HC OOH,该反应需吸收60kJ·mol-1的能量,吸收能量的原因是。
答案:(1)升高,降低;(2)增大,减小,增大;(3)小,IBr为极性分子,Br2为非极性分子,CCl4为非极性溶剂,根据相似相容原理可知,IBr在CCl4中的溶解度比Br2小;(4)打破二聚甲酸分子内氢键需要吸收能量。