6.氢键对物质性质的影响
(1).氢键对物质溶、沸点的影响
分子间氢键增大了分子间的作用 力使物质的溶、沸点升高。所以 对羟基苯甲酸高于邻羟基苯甲酸
分子内氢键的形成,使分子具有环状 闭合的结构。分子内氢键的形成势必 削弱分子间氢键的形成. 故有分子内氢 键的化合物的沸点、熔点不是很高。 一般会使物质的熔沸点下降,在极性溶 剂中的溶解度降低
分子晶体熔、沸点高低的比较规律 分子晶体要熔化或汽化都需要克服分子间 的作用力。分子间作用力越大,物质熔化 和汽化时需要的能量就越多,物质的熔、 沸点就越高。 因此,比较分子晶体的熔、沸点高低, 实际上就是比较分子间作用力(包括范力 和氢键)的大小。
(1)组成和结构相似的物质, 分子量越大,熔沸点越高。 ___________________________________ 烷烃、烯烃、炔烃、饱和一元醇、醛、 羧酸等同系物的沸点均随着碳原子数的增 加而升高。 分子间有氢键的物质(HF、H2O、 NH3等)熔、沸点反常。形成分子内氢键 的物质,其熔、沸点低于形成分子间氢键 的物质。
(4)、物质类别: 大多数共价型的非金属单质和化合物分子,可形 成分子晶体。室温下所有的气态物质、易挥发的 液体,在一定条件下,都可形成分子晶体。此外, 易熔化、易升华的固体也都是分子晶体。如:卤素、 氧气、氢气、稀有气体、非金属氢化物、多数非 金属氧化物等
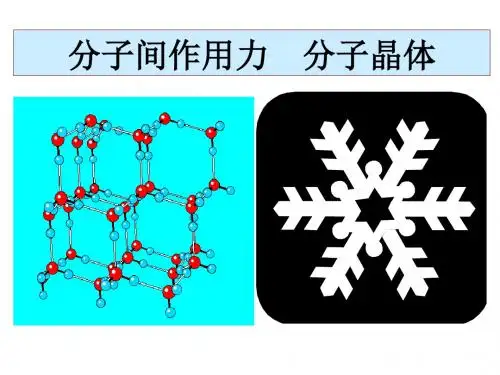
二氧化碳晶体结构模型
一个晶胞中CO2 分子的个数: 8×1/8+6×1/2=4
δ+ H
F δδ+ H
δ-
F
δ δ+ 在HF分子中,由于F原子吸引电子的能力很强, H—F键的极性很强,共用电子对强烈地偏向F原 子,亦即H原子的电子云被F原子吸引,使H原子 几乎成为“裸露”的质子。这个半径很小、带部 分正电荷的H核,与另一个HF分子带部分负电荷 的F原子相互吸引。这种静电吸引作用就是氢键。