4分子间作用力-分子晶体
- 格式:ppt
- 大小:2.19 MB
- 文档页数:40

分子间的作用力上面已经讨论了三种基本类型的化学键,它们都是分子内部原子间较强的结合力,是决定分子化学性质的主要因素。
在分子与分子之间还存在着较弱的作用力,它是决定物质的沸点、熔点、溶解度等物理性质的重要因素。
为了更好地说明分子间作用力,先谈一下分子极化的问题。
一、分子极化任何分子都有正、负电重心,任何分子又都有变形的性能。
因而在外电场的作用下,分子的电荷重心可发生相对的位移,即分子发生变形,这个过程就叫分子的极化(被极化)。
例如非极性分子,正、负电重心是重合的,但在外电场作用下,正负电重心可被拉开,发生变形并产生偶极(图3-59),这叫诱导偶极(外电场除去,偶极也消除)。
对于极性分子,其本身具有偶极这叫固有偶极,在没有外电场作用时极性分子的固有偶极由于热运动,而杂乱排列。
但在外电场作用下杂乱无章的极性分子可按电场方向定向排列起来,同时由于电场的作用而使偶极加大(固有偶极加诱导偶极)产生一定的变形(图3-60)。
由上可看出,无论非极性分子还是极性分子在外电场作用下都可发生极化作用。
二、分子间力的形成如果将外电场换成极性分子自身所产生的电场,这就与上述情况相似,彼此有相互作用,也就产生了分子间力,下面就分别来分析这方面的情况。
1.取向力当极性分子和极性分子相互接近时,它们的固有偶极的同极相斥而异极相吸,就使得极性分子按一定方向排列(图3-61),因而产生了分子间的作用力,这种力叫取向力。
显然,极性分子的偶极矩越大,取向力越大。
这种力只存在于极性分子与极性分子之间。
2.诱导力当极性分子和非极性分子相接近时,非极性分子在极性分子的固有偶极的作用下,发生极化,而产生诱导偶极,然后诱导偶极与极性分子固有偶极相互吸引(图3——62)。
这种由于诱导偶极而产生的作用力,称为诱导力。
这种力产生于极性分子与非极性分子之间,当然极性分子与极性分子之间也互相诱导,因而也有这种力。
3.色散力非极性分子与非极性分子之间有无作用力?实验指出,N2、O2、H2……等气体,只要充分降温,都可以转变成液态和固态。








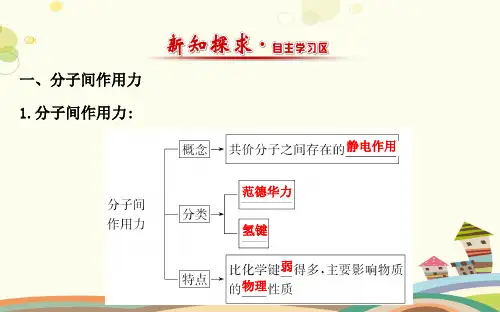
分子间作用力分子晶体分子晶体(molecular crystal)是由分子间的非共价作用力形成的晶体结构。
这种晶体结构由分散的分子通过弱的相互作用力组成,而不是由金属键或离子键组成的。
分子晶体是一类非常常见的晶体类型,包括有机晶体、冰晶体等。
范德华力是一种由于分子间电子云的偶极瞬时极化而产生的相互作用力。
它是分子晶体中最弱的一种作用力,但也是最普遍和最重要的。
范德华力随着分子间的距离增加而减弱,但随着分子间电荷分布的改变而变化。
范德华力的强度取决于分子的极性和大小。
氢键是另一种重要的分子间作用力。
它是一种特殊的电荷间相互作用力,通常涉及一个氢原子与一个电负性较大的原子(如氮、氧、氟)之间形成的相互作用。
氢键是一种强作用力,能够使分子更紧密地结合在一起。
它在水分子中的作用是形成水的固态结构(冰)的重要原因。
氢键也在很多有机分子晶体中起到关键作用。
π-π相互作用是一种特殊的分子间力,通常涉及芳香环中的π电子云之间的相互作用。
这种相互作用可以使芳香环平行排列并相互叠加,从而增强晶体的稳定性。
π-π相互作用对于一些有机分子晶体,如芳香族化合物晶体,具有重要的作用。
除了这些主要的分子间作用力,还有其他一些较弱的作用力也可以参与分子晶体的形成,例如离域电子的相互作用和疏水作用等。
分子晶体具有一些独特的性质和应用。
首先,它们通常具有较低的硬度和脆性,这是由于它们之间的非共价作用力较弱所致。
其次,分子晶体通常是电绝缘体,因为它们之间没有可以形成导电电子的共价键。
此外,由于分子晶体中分子之间的间隙,它们通常对溶剂和小分子具有较高的吸附能力。
这些特性使得分子晶体在材料科学、化学和生物学等领域具有广泛的应用,如药物晶体工程、分子传感器、光电器件等。
总之,分子间作用力是分子晶体形成的关键因素。
范德华力、氢键和π-π相互作用等主要作用力共同作用,通过将分子组装在一起形成晶体结构。
分子晶体具有一系列特殊性质和应用,成为材料科学和化学研究中的重要主题。

分子会形成晶体的具体内容
分子形成晶体的具体内容涉及到分子间相互作用力以及分子在空间中的排列方式。
以下是一些常见的分子形成晶体的方法:
1. 分子间作用力:分子间作用力包括范德华力、氢键和离子键等,这些相互作用力使得分子在空间中形成有序排列。
范德华力是一种普遍存在于分子之间的吸引力,它是由于分子间瞬时电子云的重叠引起的。
氢键是一种较强的相互作用力,常见于含有氢原子的分子。
离子键则是正负离子之间的静电吸引力。
2. 分子晶体类型:根据分子间作用力的不同,分子晶体可以分为不同类型。
范德华力形成的分子晶体称为分子晶体,如氢分子(H2)和二氧化碳(CO2)等。
含有氢键的分子晶体,如水(H2O)和氨(NH3)等。
离子键形成的分子晶体,如氯化钠(NaCl)和氢氧化钠(NaOH)等。
3. 分子晶体结构:分子晶体结构取决于分子间作用力的性质以及分子本身的性质。
常见的分子晶体结构包括层状结构(如石墨
链状结构(如聚合物)和三维网络结构(如冰)。
4. 分子晶体性质:分子晶体的性质取决于其结构和分子间作用力。
常见的性质包括熔点、沸点、密度、溶解性等。
分子晶体的物理性质通常与其分子间作用力、分子大小和形状等因素有关。
通过分子间作用力的作用,分子可以在空间中形成有序排列,从而形成分子晶体。
不同类型的分子晶体具有不同的结构和性质,这使得分子晶体在自然界中具有丰富的多样性和广泛的应用。