物理化学——第10章-电解和极化
- 格式:pdf
- 大小:1.27 MB
- 文档页数:53


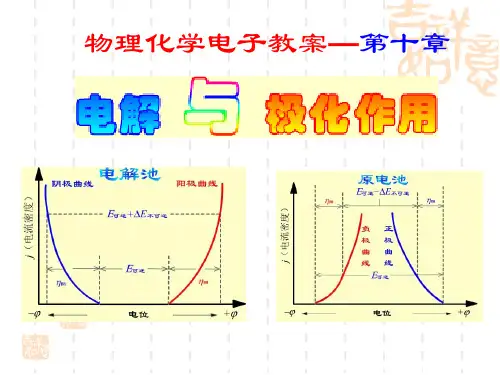

第十章 电解与极化作用一、选择题1、金属活性排在H 2之前的金属离子,如Na +能优先于H +在汞电极上析出,这是由于( )(A )φ(标准)(Na +/Na)<φ(标准)(H +/H 2) (B)φ(Na +/Na)<φ(H +/H 2)(C)η(Na)<η(H 2) (D)H2在汞上析出有很大的超电势, 以至于φ(Na +/Na)>φ(H +/H 2)2、用铜电极电解CuCl 2的水溶液,在阳极上会发生( )(A ) 析出氧气 (B )析出氯气 (C )析出铜 (D )铜电极溶解3、Tafel 公式η=a+blgj 的适用范围是( )(A)仅限于氢超电势 (B)仅限于j 约等于零,电极电势稍有偏差的情况(C)仅限于阴极超电势,可以是析出氢,也可以是其他(D )可以是阴极超电势,也可以是阳极超电势4、极谱分析中加入大量惰性电解质的目的是( )(A ) 增加溶液电导 (B )固定离子强度(C )消除迁移电离 (D )上述几种都是5、当发生极化现象时,两电极的电极电势将发生如下变化( )(A )φ平,阳>φ阳;φ平,阴>φ阴 (B)φ平,阳<φ阳;φ平,阴>φ阴(C)φ平,阳<φ阳;φ平,阴<φ阴 (D)φ平,阳>φ阳φ平,阴<φ阴6、极谱分析的基本原理是根据滴汞电极的( )(A)电阻(B)浓差极化的形成 (C)汞齐的形成 (D)活化超电势二、填空题1、已知φ(标准)(Fe 2+/Fe)=-0.440V,φ(标准)(Cu 2+/Cu)=0.337V,在25℃,标准 大气压时,以Pt 为阴极,石墨为阳极,电解含有FeCl 2(0.01mol.Kg -1)和CuCl 2 (0.02mol.Kg -1)的水溶液,若电解过程中不断搅拌溶液,且超电势可忽略不计,则 最先析出的金属是————2、在锌电极上H 2的超电势为0.75V,电解一含Zn 2+的浓度为1*10-5mol.Kg -1的溶液,为了不使H 2(g)析出,向溶液的pH 值应控制在————已知25℃时φ(标准)(Zn 2+/Zn)=-0.763V3、以Cu 为电极电解1mol.Kg -1CuSO 4溶液(pH=3),则在阴极上的电极反应——-——————————阳极上的电极反应——————————。





第10章电解与极化作用1.要在一面积为100 cm2的薄铁片两面都镀上厚度为0.05 mm的均匀镍层,计算所需的时间。
已知所用电流为 2.0 A,电流效率为:解:根据题意得,在t时间内流过的总电量为,即其中,所以2.在298 K和标准压力下,试写出下列电解池在两电极上所发生的反应,并计算其理论分解电压:解:(1)电解时,阴极反应为阳极反应为=1.22V(2)=1.227V(3)=-0.0866V3.在298 K和标准压力下,用镀铂黑的铂电极电解a H+=1.0的水溶液,当所用电流密度为时,计算使电解能顺利进行的最小分解电压。
已知忽略电阻引起的电位降,H2O(l)的标准摩尔Gibbs生成自由能为-237.129 kJ·mol-1。
解:分解电压可表示为其中可逆电压为则分解电压最小为。
4.在298 K时,使下述电解池发生电解作用:问当外加电压逐渐增加时,两电极上首先分别发生什么反应?这时外加电压至少为若干?(设活度因子均为1,超电势可忽略。
)解:在阳极上可能发生反应的阴离子是Cl-、OH-和SO42-,相应的电势为因电极电势最小的,先在阳极被氧化,所以阳极发生OH-被氧化的反应。
在阴极上,可能发生反应的离子有,各自的电极电势为因Ni2+的电极电势最大,所以阴极上发生的是Ni2+被还原的反应,故分解电压为5.298 K时,用Pb(s)电极来电解H2SO2溶液,已知其浓度为0.10 mol·kg-1,r士=0.265,若在电解过程中,把Pb阴级与另一甘汞电极相连组成原电池,测得其电动势E =1.0685 V。
试求H2(g)在Pb阴级上的超电势(只考虑H2SO4的一级电离)。
已知所用甘汞电极的电极电势=0.2806V。
解:电解时,阴极上为析氢反应,其电势为组成原电池后,甘汞电极为正极,电动势为则阴极的电势为则超电势为6.在锌电极上析出氢气的Tafel公式为在298 K时,用Zn(s)作阴级,惰性物质作阳极,电解浓度为0.1 mol·kg-1的ZnSO4溶液,设溶液pH 为7.0。