乙炔1(PPT)4-4
- 格式:pptx
- 大小:80.87 KB
- 文档页数:3
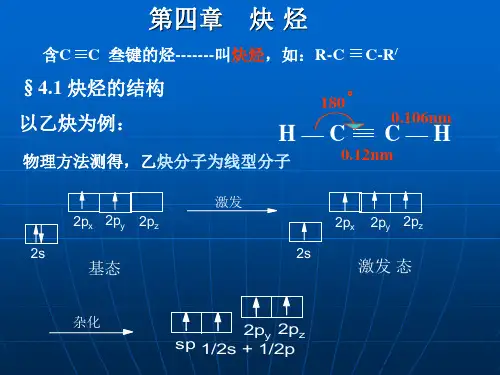



嘴哆市安排阳光实验学校高二化学第四节 乙炔 炔烃人教版【本讲教育信息】 一. 教学内容:第四节 乙炔 炔烃 二. 教学目标:1. 了解乙炔的重要化学性质和主要用途2. 了解炔烃的结构特征、通式和主要性质 三. 教学重点、难点:乙炔的重要性质 四. 知识分析: 1. 乙炔的结构分子式为22H C 、结构式为H C C H -≡-、结构简式为CH HC ≡、电子式为C H :⋅⋅⋅⋅⋅⋅H C :。
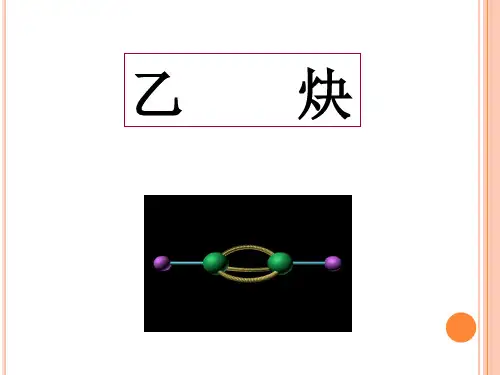
乙炔是直线型分子,键角为︒180,属非极性分子。
2. 乙炔的物理性质纯的乙炔是无色、无味的气体,密度比空气略小,微溶于水,易溶于有机溶剂。
3. 乙炔的化学性质(1)氧化反应:−−→−+点燃22252O H C O H CO 2224+,还可使酸性4KMnO 溶液褪色。
(2)加成反应:CHCl nCH =2−−−→−催化剂---n CHCl CH ][2。
(3)加聚反应:−→−≡FeCH CH3,CH nCH ≡−−−→−催化剂---=n CH CH ][。
4. 乙炔的实验室制法(1)药品:电石与饱和食盐水(2)原理:↑≡+−→−+CH CH OH Ca O H CaC 222)(2 (3)装置:固+液−→−气(有别于制氢气的装置) (4)收集:排水集气法 5. 炔烃(1)概念:分子里含有碳碳叁键的一类链烃,其通式为22-n n H C (2≥n )。
(2)物理性质:炔烃的物理性质一般随着分子里碳原子数的增多而呈现规律性的变化,如沸点随碳原子数的增加而升高,相对密度逐渐增大。
(3)化学性质:与乙炔相似。
能发生:① 氧化反应;② 加成反应;③ 加聚反应。
(4)完全燃烧的化学方程式:222213O n H C n n -+-−−→−点燃O H n nCO 22)1(-+ 6. 烷烃、烯烃、炔烃含碳质量分数的计算及变化规律7. 甲烷、乙烯、乙炔燃烧的对比 (1)化学方程式(完全燃烧) (2)燃烧现象甲烷、乙烯、乙炔的燃烧现象甲烷乙烯乙炔含碳质量分数75%85.7%92.3%火焰亮度淡蓝色火焰,不明亮明亮更明亮火焰伴烟量无烟有黑烟有浓烈的黑烟8. 乙烷、乙烯、乙炔分子结构和化学性质的比较乙烷乙烯乙炔分子式62H C 42H C 22H C结构式H HH C C H HH ---||H C HC H H -=-H C C H -≡-电子式:H ..H C ......H C H :C H :⋅⋅⋅⋅⋅⋅H C :结构特点C C -(单键)碳原子的化合价达“饱和”C C =(双键)碳原子的化合价未达“饱和”C C ≡(叁键)碳原子的化合价未达“饱和”含碳质量分数 %80%1003024=⨯ %7.85%1002824=⨯ %2.92%1002624=⨯化学活动性稳定活泼活泼取代反应卤代乙烷乙烯 乙炔加成反应—溴水或溴的四氯化碳溶液褪色等溴水或溴的四氯化碳溶液褪色等加聚反应不能发生能发生能发生 氧化反应4KMnO 溶液)(+H 不褪色4KMnO 溶液)(+H 褪色4KMnO 溶液)(+H 褪色 燃烧火焰 较明亮 燃烧火焰明亮,带黑烟 燃烧火焰很明亮, 带浓烈的黑烟鉴别溴水不褪色或4KMnO 酸性溶液不褪色溴水褪色或4KMnO 酸性溶液褪色溴水褪色或4KMnO 酸性溶液褪色9. 气态烃完全燃烧的两个公式及妙用气态烃的分子式为n m H C ,{}4,3,2,1∈m ,则有:1体积气态烃完全燃烧生成液态水,总体积减少量必为:14+=∆-nV ① 1体积气态烃完全燃烧生成气态水,总体积增加量必为:14-=∆+nV ② (注:燃烧前后气体的温度、压强相同) 妙用一:由气态烃的体积,根据①,②式可得:-∆V=⎪⎭⎫⎝⎛+14n V 烃……①'+∆V ⎪⎭⎫⎝⎛-=14n V 烃……②'求完全燃烧前后总体积变化量。




第四节 乙炔 炔烃●教学目的:1、 使学生了解乙炔的重要化学性质和主要用途。
2、 使学生了解乙炔的结构特征、通式和主要的性质。
3、培养学生的辨证唯物主义观。
●教学方法:探索推理法●教学重点:乙炔的化学性质。
●教学难点:乙炔的结构以及与化学性质的关系。
教学过程:[提问]对比乙烷、乙烯的结构,乙烯有一个双键,则氢原子数比乙烷少2个H 。
假设比C 2H 4再少2个H ,结构会怎样?应有一根三键。
(H —C ≡C —H )[结论]和烷烃相比,每有一个双键,氢原子就减少2个,每有一个三键,氢原子就减少4。
[提问] 设C n H m 分子中只有单双键,则该有多少个双键? 不饱和度: 222mn -+ == C 数+1—H 数/2, 如C 12H 12中最多有多少个双键?(7)一、乙炔的组成和结构:分子式:C 2H 2电子式:结构式:H —C ≡C —H 结构简式:CH ≡CH [展示]乙炔的球棍模型:直线型,键角180°[例题] CH 3—CH==CH —C ≡C —CF 3分子结构的下列叙述中,正确的是( B C ) A 、6个碳原子有可能都在一条直线上B 、6个碳原子不可能都在一条直线上C 、6个碳原子都在同一平面上D 、6解析:该物质空间结构可表示为:注:该物质并不是所有原子均共面,如—CH 3中的3个氢原子,—CF 3中的3个氟原子均类CH 4中氢原子,是空间的。
甲烷、乙烯、乙炔结构的比较C 中有两个键易断裂。
三键中一个为C —C δ键,两个为π键。
[提问]推测乙炔的性质和哪类物质类似?易发生哪些反应? [回答]类似烯烃,易发生加成、加聚、氧化反应。
[验证实验]1、乙炔通入酸性KMnO 4溶液中2、乙炔通入溴的CCl 4溶液中3、乙炔通入溴水中4、点燃乙炔气流二、乙炔的实验室制法:1、原料:电石(CaC 2中常含CaS 、Ca 3P 2)、饱和食盐水电石来源:CaCO 3==CaO + CO 2↑ CaO + 3C==CaC 2 + CO ↑(电炉中进行)2、反应原理:CaC 2 + 2H 2OCa(OH)2 + C 2H 2↑ 离子型碳化物,与水的反应相当于水解[解释]乙炔为无色、无味气体,常因含有H 2S 、PH 3等杂质而有特殊难闻的臭味。
