经典房室模型理论
- 格式:ppt
- 大小:311.50 KB
- 文档页数:27


药代动力学复习资料第二章药物体内转运(一)药物肠吸收的研究方法和特点(1)在体回肠灌流法:本法能避免胃内容物和消化道固有生理活动对结果的影响。
(2)肠外翻囊法:该方法可根据需要研究不同肠段的药物吸收或分泌特性及其影响因素。
(3)Caco-2(Cancer colon )细胞模型:优点:①可作为研究药物吸收的快速筛选工具;②在细胞水平上研究药物在小肠黏膜中的吸收、转运和代谢;③可以同时研究药物对黏膜的毒性;④由于Caco-2细胞来源于人,不存在种属的差异性;⑤重现性好。
缺点:酶和转运蛋白的表达不完整,此外,来源、培养代数、培养时间对结果都有影响。
(4)整体动物实验法:灌胃,口服后与静注相比。
(二)常用的药物血浆蛋白结合试验方法与注意事项血浆蛋白结合率%100][][][?+=PD D PD (1)平衡透析法equilibrium dialysis原理:平衡透析法是利用与血浆蛋白结合的药物不透过半透膜,药物可以透过,将血浆蛋白置于一隔室内,平衡时两室游离药物浓度相等,可计算相应的血浆蛋白结合率。
平衡透析法注意事项①药物与膜发生结合。
药物与膜结合程度取决于药物的性质,当结合程度高时,会给出不正确的结果,在这种情况下,应更换其他类型半透膜或改用其他方法。
在实验过程中,应设立一对照组。
②空白干扰。
有时从膜中溶解一些成分会干扰药物的测定,尤其是用荧光法。
因此在实验前应对膜进行处理,尽可能降低空白干扰。
③Donnan 效应。
由于膜两侧的电荷特性不同,往往出现Donnan 效应。
可采用高浓度的缓冲液或加中性盐溶液,最大限度地降低这种效应。
④当药物在水中不稳定或易被血浆中酶代谢时,不易用此法。
⑤应防止蛋白质的破坏。
(6)膜完整性实验优点:成本低,简单易行缺点:费时,对不稳定的药物不合适,易被血浆中酶代谢的药不合适(2)超过滤法ultrafiltration注意事项:(1)根据药物分子量大小采用适当孔径的滤膜(2)注意滤膜的吸附问题(3)过滤速度要适当快且过滤量不宜多,以免打破药物和血浆蛋白的原有平衡原理:与平衡透析法不同的是在血浆蛋白室一侧加压力或离心力,将游离药物快速通过滤膜进入另一隔室。
![房室模型[汇总]](https://img.taocdn.com/s1/m/4669a0fc80c758f5f61fb7360b4c2e3f57272582.png)
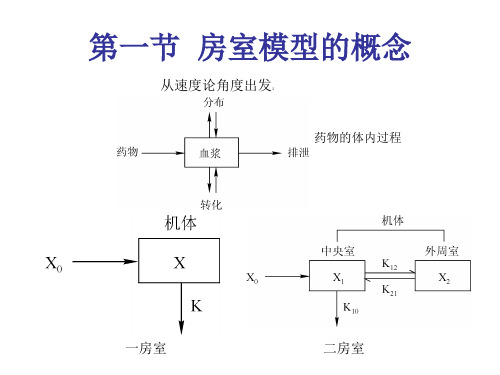
§3 房室模型[问题的提出]药物进入机体后,在随血液输运到各个器官和组织的过程中,不断地被吸收、分布、代谢,最终排出体外.药物在血液中的浓度,即单位体积血液(毫升)中药物含量(毫克或微克),称血药浓度,随时间和空间(机体的各部分)而变化.血药浓度的大小直接影响到药物的疗效,浓度太低不能达到预期的效果,浓度太高又可能导致药物中毒、副作用太强或造成浪费.因此研究药物在体内吸收、分布和排除的动态过程,及这些过程与药理反应间的定量关系,对于新药研制、剂量确定、给药方案设计等药理学和临床医学的发展都具有重要的指导意义和实用价值.这个学科分支称药物动力学.建立房室模型(Compannlent Model)是药物动力学研究上述动态过程的基本步骤之一.所谓房室是指机体的一部分,药物在一个房室内呈均匀分布,即血药浓度是常数,而在不同房室之间则按照一定规律进行药物的转移.一个机体分为几个房室,要看不同药物的吸收、分布、排除过程的具体情况,以及研究对象所要求的精度而定.本节只讨论二室模型,即将机体分为血液较丰富的中心室(包括心、肺、肾等器官)和血液较贫乏的周边室(四肢、肌肉组织等).药物的动态过程在每个房室内是一致的,转移只在两个房室之间以及某个房室与体外之间进行.二室模型的建立和求解方法可以推广到多室模型.显然,将一个机体划分为若干房室是人们为了研究目的所做的简化.值得庆幸的是,这种简化在一定条下已由临床试验证明是正确的,为医学界和药理学界所接受.[模型的假设] 1.机体分为中心室( 室)和周边室( 室),两个室的容积(即血液体积或药物分布容积)在过程中保持不变;2.药物从一室向另一室的转移速率,及向体外的排除速率,与该室的血药浓度成正比;3.只有中心室与体外有药物交换,即药物从体外进人中心室,最后又从中心室排出体外.与转移和排除的数量相比药物的吸收可以忽略.在这些假设下的一种二室模型示意图如下,)(),(t x t c i i 和i V 分别表示第i 室)2,1(=i 的血药浓度、药量和容积,12k 和21k 是两室之间药物转移速率系数,13k 是药物从I 室向体外排除的速率系数.)(0t f 是给药速率,由给药方式和剂量确定.这种速率系数为常数的房室模型称乳突状模型.[模型的建立] 根据假设条件和上图可以写出两个房室中药量)(),(21t x t x 满足的微分方程.)(1t x 的变化率由I 室向Ⅱ室的转移12k -1x ,I 室向体外的排除113x k -,Ⅱ室向I 室的转移是221x k ,及给药)(0t f 组成;)(2t x 的变化率由I 室向Ⅱ室的转移112x k 及Ⅱ室向I 室的转移221,x k -组成.于是有)(t x i 与血药浓度)(t c i 、房室容积i V 之间显然有关系式(2)代人(1)式可得这是线性常系数非齐次方程,它的解由齐次方程的通解和非齐次方程的特解组成.其对应齐次方程的通解为:其中βα,由确定.为了得到非齐次方程的特解从而解出(3),需要设定给药速率)(0t f 和初始条件.我们考察下面几种常见的给药方式.1.快速静脉注射这种注射可简化为在0=t 的瞬时将剂量0D 的药物输入中心室,血药浓度立即上升为10/V D ,于是)(0t f 和初始条件为方程(3)在条件(6)下的解为其中βα,由(5)确定.可以看出当∞→t 时0)(,0)(21→→t c t c .2.恒速静脉滴注 当静脉滴注的速率为常数是0k 时,)(0t f 和初始条件为方程(3)在条件(9)下的解可表示为其中常数11,B A 由初始条件0)0()0(21==c c 确定. 当t 充分大时)(),(21t c t c 将趋向于(10)式右端第3项表示的常值.实际上,若T t =后停止滴注,那么)(),(21t c t c 在T t >以后将按指数规律衰减并趋于零.3.口服或肌肉注射这种给药方式相当于在药物输入中心室之前先有一个将药物吸收人血掖的过程,可以简化为有一个吸收室,如图16.)(0t x 为吸收室的药量,药物由吸收室进人中心室的转移速率系数为01k ,于是)(0t x 满足0D 是给药量.而药物进人中心室的速率为将方程(11)的解代人(12)式得在这种情况下方程(3)的解)(1t c 的一般形式为(设βα,01≠k ).其中系数A ,B ,,E 正由初始条件0)0()0(21==c c 确定.从以上的讨论可以看出,中心室的血药浓度)(1t c 取决于转移速率系数132112,,k k k ,房室容积21,V V 以及输入参数00,k D 等因素,而房室模型的用途恰是通过对)(1t c 的量测,确定对于药理学和临床医学最为重要的参数,如转移速率系数,特别是从中心室向体外排除的速率系数13k .下面介绍在快速静脉注射给药方式下估计诸参数的方法.[参数估计] 在0=t 瞬时快速注射剂量为0D 的药物以后,在一系列时刻),2,1(n i t i ,⋯=从中心室采取血样并获得血药浓度)(1t c ,根据这些数据利用 (7),(5)式估计参数132112,,k k k 的过程可分两步:先计算(7)式中的B A ,,,βα再确定132112,,k k k .1.计算B A ,,,βα 不妨设βα<,于是当t 充分大时(7)式近似为或对于适当大的i t 和相应的)(1t c ,用最小二乘法不难估计出α,1nA 和A .然后计算再利用(7)式得对于较小的i t 和由(17)式算出的)(1i t c ,仍用最小二乘法即可得到β和B .2.确定132112,,k k k因为∞→t 时0)(),(21→t c t c ,进人中心室的药物全部被排除,所以将(7)代人(19)式可得又因为联合(20),(21)式解出再利用(5)式即可确定这就完成了根据中心室血药浓度的量测数据,估计转移和排除速率系数的过程.[ 评注] 建立房室模型的目的是研究体内血药浓度的变化过程,确定诸如转移和排除速率系数等参数,为制订给药方案和剂量大小提供数量依据.建模过程是将机理分析和测试分析相结合,先由机理分析确定方程形式,再由测试数据估计参数.选用几个房室建模是一个重要问题,可以先选择一室模型,其计算非常简单.不满意时再采用二室或多室模型,甚至非线性房室模型.常见的一种非线性模型(以一室为例)是12111.)(c k c k t c +-=,当1c 较小时它近似于线性模型;称为一级排除过程,而当1c 较大时)(1.t c 近似于常数,称为零级排除过程,所以它表示了一种混合型的排除过程.。


08级药代动期末考参考资料名词解释1.清除率CL:单位时间,从体内消除的药物表观分布容积数,总清除率CL等于总消除速率dx/dt对全血或血浆药物浓度c的比值,也就是说消除速率dx/dt=cl*c。
2.稳态坪浓度:为达到稳态后给药间期τ内AUC与τ的比值。
c=AUC/τ,该公式的实质:对稳态各个时间点的浓度的时间长度权重平均。
3.代谢分数:fm,代谢物给药后代谢物的AUC和等mol的原型药物给药后代谢物的AUC的比值。
4.负荷剂量(Loading Dose):凡首次给药剂量即可使血药浓度达到稳态的剂量。
5.非线性药物动力学:药物动力学参数随剂量(或体内药物浓度)而变化,如半衰期与剂量有关,这类消除过程叫非线性动力学过程,也叫剂量依赖性动力学过程。
6.非线性消除:药物在体内的转运和消除速率常数呈现为剂量或浓度依赖性,此时药物的消除呈现非一级过程,一些药动学参数如T1/2,CL,不再为常数,AUC、Cmax等也不再与剂量成正比变化。
7.清洗期(必考):交叉实验设计中两个周期的间隔称为清洗期,至少间隔药物的7~9个清除半衰期。
如果清洗期不够长,第一轮服药在血液中的残留对第二轮产生干扰。
存在不等性残留效应,第二轮数据就无效了。
8.后遗效应(必考):在生物等效性试验交叉设计中,由于清洗期不够长,第一轮服药在血液中的残留对第二轮产生的干扰称为后遗效应。
9.物料平衡:指药物进入体内后的总量与从尿液、粪便中收集到的原型药及代谢物等的总量是相等的。
10.药物转运体:存在与细胞膜上的能将药物向细胞外排的一类功能性蛋白质或者多肽。
11.介质效应:由于样品中存在干扰物质,对响应造成的直接或间接的影响。
12.MAT:mean absorption time即平均吸收时间。
公式为MAT=MRT oral – MRT iv 13.波动系数:FD,研究缓控释剂得到稳态时的波动情况,av/c-c ssminssmaxCFD)(14.平衡透析法:测定药物蛋白结合率的一种方法,该方法是以半透膜将血浆与缓冲液隔开,将药物加入缓冲液中,待药物扩散达到平衡后测定半透膜两侧的药物浓度,并计算出药物的蛋白结合率。
房室模型及其划分的依据
《房室模型及其划分的依据》
房室模型是描述心脏结构和功能的一种常用方法,它通过将心脏分为房室两个腔进行建模,以便更好地了解心脏的运作原理。
房室模型的划分依据主要有以下几个方面。
1. 解剖学划分:
心脏是由四个腔室组成,包括左右心房和左右心室。
心脏的左心室和右心室分别负责将氧合血液和非氧合血液泵送到全身。
心脏的左心房和右心房则接受相应腔室的血液,将其注入相应腔室,维持心血管循环的正常运转。
2. 功能学划分:
心脏的左边和右边在解剖结构上有所不同,也反映在其功能上。
左心室是心脏最大的腔室,主要承担将氧合血液泵送到全身的功能,所以它的肌肉更加强壮,收缩更有力。
右心室则较小,将经肺循环氧合后的血液泵送到肺部。
3. 血液流动的方向:
心脏内部的血液流动方向也成为划分的依据之一。
血液在心脏内外来回流动,其中两个心房接受血液,两个心室将血液泵出。
心房和心室之间通过房室瓣膜相隔开来,控制血液流动的方向。
4. 协同收缩和舒张:
心脏的房室周期性地进行收缩和舒张,以维持正常的心血管功能。
一次收缩和舒张过程称为一个心搏。
房室模型的划分也可以根据心脏收缩的节律和协同进行,从而更好地理解心脏的工作原理。
综上所述,《房室模型及其划分的依据》主要根据心脏的解剖学结构、功能学特点、血液流动方向以及协同收缩和舒张等方面进行了划分,这种模型的建立有助于我们更好地了解心脏的工作原理,并在临床上应用于心血管疾病的诊断和治疗。
房室模型是心脏解剖和心脏电活动的一种简化模型,用于描述心脏内部的结构和电流传导路径。
在房室模型中,心脏被分为两个主要部分:心房和心室。
心房是上部的心腔,其收缩将血液推向心室。
心室是下部的心腔,其主要功能是将血液泵送到全身各个器官。
房室之间有一个称为房室结(AV结)的区域,它位于心房底部和心室之间,起到连接和传导信号的作用。
房室模型还包括其他重要的结构,例如窦房结(SA结)、希氏束和浦肯野纤维等。
窦房结是心脏的起搏点,控制心脏的节律。
希氏束和浦肯野纤维是心室内部的电流传导通路,负责将来自心房的电信号传递到心室肌肉,引发心室收缩。
通过房室模型,可以更好地理解心脏的结构和电活动,为诊断和治疗心脏疾病提供参考和指导。
请注意,房室模型只是心脏解剖和电活动的简化描述,并不能完全涵盖所有细节和复杂性。
在实际的医学和生理学研究中,对心脏功能和电活动的理解还需要更加详细和深入的模型和方法。