宁波工程学院环己酮的制备
- 格式:doc
- 大小:323.00 KB
- 文档页数:4

实验十环己酮的制备一、实验目的1. 学习利用此时历反应合成环己酮的方法。
2. 掌握环己酮的制备工艺流程及实验操作。
3. 培养实验中仔细认真,耐心细致的态度。
二、实验原理环己酮又称己酮,化学式为C6H10O,是一种无色液体,味道有苦涩味。
其具有很多重要的化学用途和工业用途,常用于有机合成和医药化学中。
环己酮可以通过多种途径得到,如加氢反应、羟醛缩合反应以及此时历反应等。
此时历反应,又称为克鲁斯反应(Knoevenagel condensation),是指α位上的活性氢通过消除反应,与羰基化合物中的活泼亚甲基结合,形成新的碳碳共价键的化合物反应。
此时历反应原理如下:(1)弱酸性条件下在弱酸性条件下,羰基中的甲酮成为羧酸,羰基中的羰基酸甲酯则成为羧乙酸酯。
此时历反应条件简单,操作方便,收率较高。
但在弱酸性条件下,如温和酸性的水解、酸性条件下的分解和氧化等都会对产物的稳定性产生影响。
在强碱性条件下,如乙醇钠或乙醇钾的存在下,β-羰基中的活泼亚甲基会与醛、酮中的酸性α-氢发生加成反应,生成的中间产物可以发生消除反应,形成新的碳碳共价键。
不过,与弱酸性条件相比,在强碱性条件下,产物的稳定性受到较大影响,因而容易出现场效应的产生,选择碱性条件制备环己酮需要使用精细的工艺控制条件。
三、实验材料和仪器1. 反应瓶 3个。
2. 圆底烧瓶 1个。
3. 密封瓶 1个。
4. 滴液漏斗 1个。
5. 蒸馏装置 1套。
6. 称量器具。
7. 实验原料:苯乙酮、乙醇、乙醇钠、环己anqian罐tetrony酮四、实验步骤1. 实验前准备称量出10g苯乙酮,加入100mL的乙醇中,加热溶解储备。
称取5.15g环己anqian罐tetrony酮,加入滴液漏斗中备用。
称取1.6g乙醇钠,溶于10mL乙醇中备用。
2. 反应操作取一只干燥的3个口反应瓶,加入100mL的乙醇。
加入浓碱钠水,并用回流冷凝器加热。
约30mL的乙醇将被回收,并存储在密封瓶中备用。

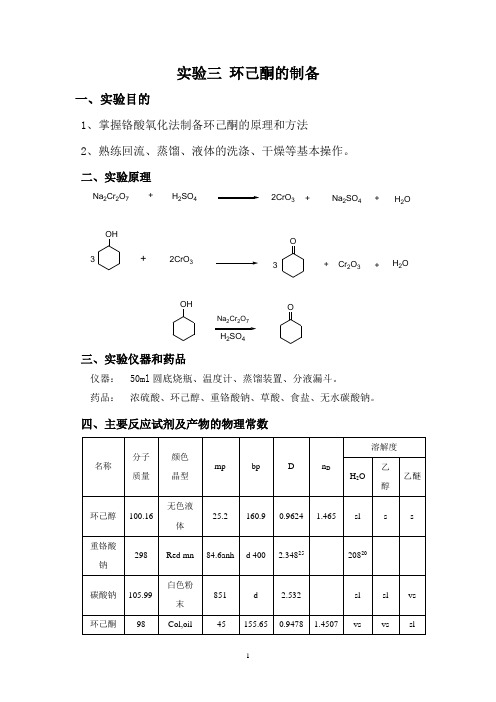
实验三 环己酮的制备一、实验目的1、掌握铬酸氧化法制备环己酮的原理和方法2、熟练回流、蒸馏、液体的洗涤、干燥等基本操作。
二、实验原理Na 2Cr 2O 7+H 2SO 42CrO 3Na 2SO 4H 2O ++OH2CrO 3+3O 3+Cr 2O 3+H 2O OHNa 2Cr 2O 7H 2SO 4O三、实验仪器和药品仪器: 50ml 圆底烧瓶、温度计、蒸馏装置、分液漏斗。
药品: 浓硫酸、环己醇、重铬酸钠、草酸、食盐、无水碳酸钠。
四、主要反应试剂及产物的物理常数五、实验装置图六、实验步骤1、在50ml圆底烧瓶内,放置10ml冰水,在搅拌下慢慢加入2.5mL浓硫酸,充分混匀,小心加入1.92g环己醇(2ml,19.24mmo1)。
在上述混合液内插入一支温度计,将溶液冷至30℃以下。
2、在烧杯中将3.5g重铬酸钠(11.6 mmo1)溶解于2mL水中,取此溶液lml加入圆底烧瓶中,充分振摇,这时可观察到反应温度上升和反应液由橙红色变为墨绿色,表明氧化反应已经发生。
继续向圆底烧瓶中滴加剩余的重铬酸钠溶液,同时不断振摇烧瓶,控制滴加速度,保持烧瓶内反应液温度在55-60℃之间。
若超过此温度时立即在冰水浴中冷却。
滴加完毕,继续振摇反应瓶直至观察到温度自动下降1-2℃以上。
然后再加入少量的草酸(约需0.15g),使反应液完全变成墨绿色,以破坏过量的重铬酸盐。
3、在反应瓶内加入12mL水,再加几粒沸石,装成蒸馏装置,将环己酮与水一起蒸馏出来,环己酮与水能形成沸点为95℃的共沸混合物。
直至馏出液不再混浊后再多蒸约1-2mL,用食盐饱和馏液后移入分液漏斗中,静置后分出有机层,用无水碳酸钾干燥,蒸馏,收集150~156℃馏分。
称重,计算产率七、注意事项1、配置氧化剂溶液时一定要注意加料顺序。
废酸液不要触及皮肤,以防腐蚀。
铬酸现用现配。
2、本实验是一个放热反应,必须严格控制控制重铬酸钠溶液的滴加速度,温度过低反应困难,过高到副反应增多。

实验项目:环己酮的制备一、实验目的1. 学习氧化法制备环已酮的原理与方法;2 •掌握简易水蒸汽蒸馏;3. 掌握萃取、干燥等基本操作。
实验内容1. 将环己醇氧化成环己酮,了解氧化反应的原理,操作技术; 2•利用水蒸汽蒸馏,蒸出环己酮;3.利用萃取分离出环己酮,蒸馏收集馏分。
实验示意图1•水蒸汽发生器(短颈圆底烧瓶;金属制)安全管水蒸汽------- ►短颈圆底烧瓶水蒸汽发生器金属制水蒸汽发生器(G为T形三通管)2.蒸馏装置(单颈、二颈、三颈圆底烧瓶)D:蒸馏瓶,E:水蒸汽导入管,F:水蒸汽导出管,H:接受瓶注:蒸馏瓶也可米用二颈瓶仪器设备名称规格消耗品名称规格烧杯400ml环己醇CP 三口烧瓶250ml (14*19*14) 重铬酸钠AR 分液漏斗250ml浓硫酸AR 水蒸汽发生器定制无水碳酸钾AR 圆底蒸馏烧瓶100ml精盐温度计0-300 C直形冷凝管14#*2空气冷凝管14#*2蒸馏头14#*3尾接管14#接收瓶14#台秤(加砝码)阿贝折光仪五、实验原理及原始计算数据、所应用的公式1 •氧化反应:R CH2 OH [O] a R一CH2—COOHOH OI [O] II—CH R' R—C—R'R环己醇氧化:Z^<°H3+ Na2C「2O7 + 4H2SO4 ------- *3 + C「2(SO4)3 + Na2SO4 + 7H2。
M A、M B为物质A和B的相对分子质量。
因此:m A M A n A M A P AmB MBnBMBPB即两种物质在馏液中的相对质量(就是它们在蒸气中的相对质量)与它们的蒸气压和相对分子质量成正比。
3 •原始数据:原料用量:10g(10.5ml O.lmol) 环己醇,10.5g(0.035mol)重铬酸钠纯粹环己酮沸点:1557C 折光率n=1.4507六、实验数据记录环己醇bp 161C纯粹环己酮bp 155.7C 折光率n=1.4507实验步骤:1. 在400ml烧杯中,溶解10.5g重铬酸钠于60ml水中,然后在搅拌下加入9ml 浓硫酸,得到一橙红溶液,冷却到30C以下备用。

环己酮合成实验报告环己酮合成实验报告引言:环己酮是一种重要的有机化合物,广泛应用于化工、医药和农药等领域。
本实验旨在通过酸催化的氧化还原反应,合成环己酮,并通过对反应条件的调节,探讨其对产率和纯度的影响。
实验部分:1. 实验原理环己酮的合成反应是通过环己醇的氧化还原反应实现的。
在酸性条件下,环己醇经过氧化反应生成环己酮。
本实验中,我们采用酸性催化剂作为氧化剂,如硫酸、磷酸或硫酸铜等。
2. 实验步骤(1)制备反应体系:将一定量的环己醇和催化剂溶解在适量的溶剂中,如乙醇或二甲基甲酰胺。
(2)反应条件调节:探究不同催化剂、溶剂、反应温度和反应时间对产率和纯度的影响。
(3)反应操作:将反应体系加热至设定温度,在搅拌条件下进行反应。
(4)产物分离:将反应混合物进行冷却,然后用水洗涤、干燥和蒸馏等操作,分离出目标产物。
结果与讨论:1. 催化剂的选择我们尝试了不同的催化剂,包括硫酸、磷酸和硫酸铜。
结果显示,硫酸铜催化剂具有较高的催化活性和选择性,能够有效地催化环己醇的氧化反应。
2. 溶剂的影响我们比较了乙醇和二甲基甲酰胺作为溶剂的效果。
结果表明,乙醇作为溶剂时,反应速率较快,产率较高,但纯度稍低。
而二甲基甲酰胺作为溶剂时,反应速率较慢,产率较低,但纯度较高。
因此,在实际应用中,需根据具体需求选择合适的溶剂。
3. 反应温度和反应时间的影响我们分别调节了反应温度和反应时间,观察其对产率和纯度的影响。
结果显示,随着反应温度的升高,反应速率增加,但同时伴随着产物分解和副反应的增加。
而反应时间的延长有助于提高产率和纯度,但过长的反应时间也会导致产物分解和副反应的增加。
结论:通过本实验,我们成功合成了环己酮,并探究了不同条件对产率和纯度的影响。
在实际应用中,可根据需求选择合适的催化剂、溶剂、反应温度和反应时间,以提高产率和纯度。
此外,本实验还为进一步研究环己酮的合成和应用提供了基础。
参考文献:[1] Smith, J. M., & Johnson, R. R. (2010). Organic Chemistry: Principles and Mechanisms. John Wiley & Sons.[2] Li, G., & Wang, Z. (2014). Catalytic oxidation of cyclohexanol to cyclohexanone over copper catalysts. Journal of Molecular Catalysis A: Chemical, 393, 71-78.。

有机化学实验报告实验名称:环己酮的制备学院:化学工程学院专业:化学工程与工艺班级:班姓名:学号指导教师:日期:2011.11.27一、实验目的1、了解氧化法制备环已酮的原理和方法,进一步了解醇和酮的区别和联系。
2、掌握萃取、分离和干燥等实验操作及空气冷凝管的应用。
二、实验原理三、主要试剂及物理性质仪器:250ml三颈烧瓶、搅拌器、滴液漏斗、温度计、冷凝管、接收器、分液漏斗;药品:环己醇5g、冰醋酸、次氯酸钠溶液、沸石、饱和亚硫酸钠溶液、氯化铝、碘化钾淀粉试纸、无水碳酸钠、氯化钠、无水硫酸镁。
四、试剂用量规格250m l三颈烧瓶、环己醇5g、沸石适量、氯化铝3g、10ml饱和氯化钠溶液五、仪器装置(a)环已酮制备装置(b)空气冷凝蒸馏装置六、实验步骤和实验流程时间步骤现象9:08在250mL三颈瓶中加入5.2mL环己醇和25mL冰醋酸,摇匀反应物准备反应物9:20开动搅拌器,滴加38ml次氯酸钠溶液温度计读数为27℃9:3338ml次氯酸钠溶液滴加完毕,继续搅拌溶液无明显变化9:38用玻璃棒蘸取少许溶液与KI淀粉试纸KI淀粉试纸呈紫色9:39继续搅拌30min,使反应完全溶液无明显变化10:09 加入饱和亚硫酸氢钠溶液2-3d,蘸取少许与KI淀粉试纸KI淀粉试纸不变紫色10:13加入30ml水、3g氯化铝和几粒沸石,组装蒸馏装置氯化铝完全溶解再开始蒸馏10:20开始蒸馏溶液无明显变化10:36开始蒸馏出液体温度计读数为96.5℃11:12蒸馏结束蒸馏至流出液无油滴滴出11:50在搅拌下向流出液分批加入无水碳酸钠至中性,再加入精制食盐,倒入分液漏斗取上层有机层12:25称量有机层M锥形瓶=49.07g,M总=50.75g,M=1.68g粗产=1.68/5*100%=33.6% 12:40加入无水硫酸镁干燥有机层被干燥12:54开始蒸馏温度开始上升13:00出现前馏分馏分符合食盐要求13:05开始接受馏分温度计读数为138℃13:18结束蒸馏,计算产率产率=[( 1.68/16.5)*8.94/5]*100%=18.2%七、实验结果处理1、M锥形瓶=49.07g,M总1=50.75g,M产1=1.68g粗产=1.68/5*100%=33.6%2、五组:M总2=16.5g,M产2=8.94g五人总产率=(8.94/16.5)*100%=54.2%个人产率=[(1.68/16.5)*8.94/5]*100%=18.2%八、实验讨论1、38ml次氯酸钠溶液的滴加要缓慢2、反应中控制好温度,温度过低反应困难,过高到副反应增多。
环己酮的制备概述环己酮(Cyclohexanone)是一种无色液体,具有特殊的气味。
它是一种重要的有机化合物,在化学工业中有广泛的应用。
本文将介绍环己酮的制备方法。
方法一:环己酮的氧化原理环己酮可以通过环己烯的氧化反应制备。
该反应的原理是在适当的催化剂的作用下,环己烯经过氧化反应生成环己酮。
实验步骤1.准备实验用具。
–反应釜–搅拌器–气体进出口–温度控制装置2.平衡反应温度和氧气供应。
–将反应釜加热至适宜的温度,保持温度稳定。
–向反应釜中通入氧气,保持适当的氧气供应量。
3.加入催化剂。
–在适量溶剂中溶解催化剂。
–将溶解好的催化剂缓慢加入反应釜中。
4.加入环己烯。
–将环己烯缓慢添加到反应釜中。
–这一步要控制加入速度,避免产生副反应。
5.反应结束。
–观察反应的进程,直到反应结束。
–可通过监测温度的变化和检测反应溶液中环己烯和环己酮浓度的变化来判断反应是否结束。
6.分离环己酮。
–将反应溶液进行蒸馏,将环己酮分离出来。
方法二:环己酮的还原原理环己酮可以通过环己酮的还原反应制备。
该反应的原理是在适当的催化剂的作用下,环己酮经过还原反应生成环己烯。
实验步骤1.准备实验用具。
–反应釜–搅拌器–温度控制装置2.加入催化剂。
–在适量溶剂中溶解催化剂。
–将溶解好的催化剂缓慢加入反应釜中。
3.加入环己酮。
–将环己酮缓慢添加到反应釜中。
–这一步要控制加入速度,避免产生副反应。
4.反应进行。
–观察反应的进行情况,控制反应温度和时间。
–可通过监测温度的变化和检测反应溶液中环己酮和环己烯浓度的变化来判断反应的进行情况。
5.分离环己烯。
–将反应溶液进行蒸馏,将环己烯分离出来。
6.清除催化剂。
–对反应釜进行清洗,将催化剂残留清除。
方法三:环己酮的酰胺加成反应原理环己酮可以通过酰胺加成反应制备。
该反应的原理是环己酮和酰胺在催化剂的作用下发生加成反应生成相应的酰胺产物。
实验步骤1.准备实验用具。
–反应釜–搅拌器–温度控制装置2.加入催化剂。
环己酮的制备(一)传统实验方法(1)实验原理环己酮的制备可采用浓HNO3、KCrO4 或KMnO4氧化法。
其中最常用的方法是将仲醇用铬酸氧化。
铬酸是重要的铬酸盐和40-50%硫酸的混合物。
酮对氧化剂比较稳定,不易进一步氧化。
铬酸氧化醇是一个放热反应,必须严格控制反应的温度,以免反应过于激烈。
OH Na2Cr2O7/ H2SO4O三、参考步骤1、氧化剂的制备。
在搅拌的条件下,向7.5mL 水和1.3g 重铬酸钠的溶液中慢慢加入1.1mL浓H2SO4,得橙红色铬酸溶液,冷至室温备用。
2、环已酮制备。
向2.5g 环己醇中,分三次加入上述铬酸溶液,每加一次都振摇混匀,并控制反应液温度在55-60℃。
反应约0.5h 后温度开始下降,再放置15min,其间不断振摇,使反应液呈墨绿色为止。
向反应液内加入7.5mL 水,进行简易水蒸气蒸馏,将环己酮与水一起蒸出,收集6mL 馏出液。
用食盐饱和后,分出有机相。
水相用7.5mL 乙醚分两次萃取,萃取液并人有机相。
然后经干燥,空气冷凝管蒸馏,收集151-155℃的馏分。
产0.8-1.0g 左右。
(二)改进方法:以30%H2O2 为氧化剂,用FeCl3 催化氧化环己醇可得到产率(基于环己醇)为75%以上的环己酮,反应中无须加入相转移催化剂,考察了用量、催化剂、反应时间及反应温度对产率的影响.所用催化剂价廉易得且具有极佳的水溶性,分离回收容易,是一条绿色合成环己酮的好途径,克服了目前有机化学实验教材中采用浓HNO3、KCrO4 或KMnO4 氧化法存在污染大、反应时间长等缺点.绿色化学在使用化学药品时遵循4R原则:拒用危险品(Reject),减量使用(Reduce),循环使用(Recycle),重新使用(Reuse)[1].在大学化学教育中渗透和灌输绿色化学思想理念是相当有必要的,而用绿色化学的思想来指导和规范化学实验教学也就显得尤为重要.目前国内有机化学实验教材中环己酮的制备是用浓硫酸催化的重铬酸盐氧化法[2~4],该法存在的主要缺点是:严重污染环境(Cr6+是致癌物),药品较贵,操作繁琐,而且催化剂浓硫酸用量较大,废酸难处理,反应时间长,反应的后处理工作较为复杂困难;而以次氯酸钠作为氧化剂,要用到相转移催化剂四丁基碘化铵,也存在反应副产物和催化剂回收利用难解决的问题[5];也有用有机金属配合物为催化剂、过氧化氢为氧化剂的报道,而且产率高达95%[6],但反应时间达12小时,不适合有机化学实验教学.用30% H2O2作为氧化剂,在55℃~60℃的温度下,采用无毒无害的FeCl3催化剂催化氧化环己醇制备环己酮,反应条件温和,容易控制,氧化剂反应完后只留下水,无毒害废弃物产生,反应时间较短,适宜有机实验教学,而且反应后的产物也极易分离.1实验部分1.1)实验试剂及仪器环己醇(CP)、过氧化氢(30%)、氯化铁(CP)、无水乙醚、氯化钠、无水硫酸镁傅立叶变换红外光谱仪Magua Nicolet 550(II)、阿贝折射仪(ZW AJ)1.2)实验步骤实验按四因子三水平正交法进行,参数如表1.表1正交实验因子水平表在带回流冷凝管、温度计、滴液漏斗的250毫升的三颈烧瓶中加入环己醇、催化剂氯化铁,用滴液漏斗慢慢滴加过氧化氢,水浴控制适宜的反应温度,过氧化氢滴加完后继续反应30分钟,其间不时振摇,使反应完全,反应液呈墨绿色.反应完成后在三颈烧瓶中加入60ml水和几粒沸石,改成蒸馏装置,将环己酮和水一起蒸出来,直至流出液不再浑浊后再多15ml~20ml,约收集50ml流出液.流出液用精盐饱和后,转入分液漏斗,静置分出有机层,水层用15ml无水乙醚萃取一次,合并有机层与萃取液,用无水碳酸钠干燥,然后水浴蒸馏除去乙醚,蒸馏收集152℃~158℃的馏分,称量所得产物的质量.1.3)催化剂单项试验正交实验得到的结果显示,催化剂是影响产率的主要因素,但影响趋势不明显,因此在确定其他条件的情况下,单独考察催化剂用量对环己酮收率的影响.1.4)实验结果的可重复性所有反应条件确定后,进行多次重复性实验,以考察实验结果的稳定性能,以确定能否将这一新的反应体系应用到实验教学中去.1.5)产品分析最后产物用Magua Nicolet 550(II)型FT-IR光谱仪测定其红外吸收.用阿贝折射仪(ZW AJ)测定其折光率.用电子天平称量所得产物的重量.2结果与讨论2.1)反应产物的表征经过处理后,蒸馏收集152℃~158℃所得的馏分为无色透明油状液体,产物的红外光谱显示在1705cm-1~1715cm-1范围有特征吸收峰,说明产物的分子结构中存在羰基;在2800cm-1~3000cm-1范围出现亚甲基特征吸收峰;测得产物折光率为1·4500.所得的红外光谱和折光率均与文献给出的环己酮的数据相符.2.2)系列正交实验产率的直观分析表2是按照四因子三水平正交法安排实验的直观分析.从表中各因子对产物平均收率的贡献来看,A1B1C2D1为最优条件,而从单个实验的产率来看则是A3B3C2D1为最高,由于极值Rj表明过氧化氢对产物平均收率的影响不大,而影响最大的是反应温度,其次是催化剂和反应时间,因此按节约原则选取A1B1C2D1或A1B3C2D1进行下一步实验.表2正交实验结果直观分析表2.3)影响环己酮收率的因素2.3.1过氧化氢的影响图1为过氧化氢与环己醇物质的量比对环己酮平均收率的影响.当二者为1∶1时,平均收率最高,虽然随着过氧化氢的量增加,平均产率有一下降过程随后又逐渐增加,但增加幅度缓慢,而且过氧化氢的多少对平均收率的影响很小,所以从节约的角度出发,尽可能选取用最少的过氧化氢.图1过氧化氢用量对环己酮平均收率的影响2.3.2催化剂FeCl3对环己酮收率的影响图2为催化剂对环己酮平均收率的影响,正交实验所得平均收率显示,取1水平时所得反应结果最好,但就单个实验结果却是3水平的反应产率最高.因此,为了确定催化剂的用量而做了相应的单项实验,结果如表3. 图2催化剂对环己酮平均收率的影响表3FeCl3用量对环己酮产率的影响从表3结果来看FeCl3用量为3g时达到最高产率76.6%.如果从教学意义来说,产率达到70%以上时,现象已经非常明显,此时所得产物有7g以上,足以用各种方法进行的处理和测试,完全能达到教学的目的和要求,因此FeCl3用量为2g~3g都能满足教学实验的要求.2.3.3反应时间及反应温度对环己酮收率的影响图3、图4分别显示反应时间和反应温度对环己酮平均收率的影响.从图中看,反应时间取70min,反应温度取55℃~60℃时反应的平均收率最高.3实验结果的稳定性的考察为了考察实验结果的可重复性,在确定的优化条件下做了多次实验,对结果的稳定性进行了考察,结果如表 4.系列重复试验结果显示,实验的重现性非常好,完全可以用于教学实验.4结论建议用于学生实验的最佳条件为:10·5ml环己醇,3.1ml过氧化氢(30%),2g~3gFeCl3,反应时间70min,反应温度55℃~60℃.该反应时间仅用70min,在规定的实验课时内,学生完全能够完成实验,是一种适用于合成环己酮的教学实验.重要的是该实验方法对学生操作及环境无污染和毒害,催化剂FeCl3分离回收容易,这对改善有机化学实验室的环境、改变学生对有机实验的固有看法及将绿色化学的思想渗透到实验教学中很有意义.100[参考文献][1]Anastas P T,Warner J C. Green Chemistry,Theory and Practice[M].Oxford:Oxford University Press,1998.[2]兰州大学、复旦大学有机化学教研室.有机化学实验(第二版) [M]·北京:高等教育出版社,1994.[3]曾昭琼.有机化学实验(第二版)[M].北京:高等教育出版社,1987 .[4]李霁良.微型半微型有机化学实验[M]·北京:高等教育出版社, 2003.[5]张晓勤,郑柳萍.相转移催化法制备环己酮[J]·福建师范大学学报(自然科学版) ,1999,15(2):56-59.[6]魏俊发,石先莹,何地平,等.无有机溶剂、无相转移催化剂条件下H2O2氧化环己醇为环己酮[J]·科学通报,2002,47(12):1628-1630.[责任编辑黄招扬][责任校对黄少梅]Study on the Preparation of CyclohexanoneDIAO Kai-sheng,LI Yan,QIN Zhi-liu(Chemical and Ecoengineering College, Guangxi University for Nationalities, Nanning530006,China)Abstract:Without phrase transfer catalyst, Cyclohexanone was prepared from cyclohexanol and hy-drogen peroxide. The effect on reaction of factors including the amount of oxidant and catalyst, reaction timeand temperature were accounted and the optimum conditions were found. Compared with that of teachingmaterial in organic chemistry, which is pollutant and poisonous, the new way is more feasible and less poison。
环己酮的制备实验报告实验学专班姓指导日机化学实验报告名称:环己酮的制备院:化学工程学院业:化学工程与工艺级:化工12-4班名:王伟杰学号 12402010414 教师:张宗勇杨春风期:有一、实验目的1、学习次氯酸氧化法制环己酮的原理和方法;2、进一步了解醇和酮这件的联系和区别。
二、实验原理用次氯酸钠作氧化剂,讲环己醇氧化成环己酮。
OH[O]O三、主要试剂及仪器试剂:环己醇(有樟脑气味的无色粘性液体,熔点:25.2℃,沸点:160.9 ℃ 相对密度:0.9624)、次氯酸钠、冰醋酸、无水碳酸钠、无水硫酸镁、氯化铝、沸石、氯化钠、碘化钾淀粉试纸。
仪器:搅拌器、滴液漏斗、温度计、250 ml三颈烧瓶、酒精灯、锥形瓶、冷凝管、蒸馏烧瓶、接液管、分液漏斗。
四、试剂用量规格五、实验仪器装置反应装置蒸馏装置分液装置空气冷凝蒸馏装置六、实验步骤及现象七、实验数据处理环己醇的物质的量计算:n=m/M=5g/100g?mol-1=0.05mol 环己酮的物质的量计算:n′=m′/M′理论应该得出的环己酮的物质的量=实际环己醇的物质的量=0.05mol 环己酮产率=实际量/理论量八、实验讨论1、由于在第一次蒸馏时,溶液暴沸,所以将溶液过滤,除去沉积物,使得损失了大量产品;2、加热蒸馏不够充分,而且可能有部分蒸汽逸出,导致产品损失;3、分液静置的时候时间不够长,导致产品损失;4、最后蒸馏的时候时间太短,不够充分,使得环己酮没有完全分离出来。
九、注意事项1、蒸馏时温度不宜升的过快,将导致溶液暴沸;2、加入次氯酸不宜过多,否则中和时加入较多的亚硫酸氢钠,从而造成蒸馏时间过长;3、盐析时,NaCl不宜加入太多,应该慢慢加入。
相关文档:更多相关文档请访问:。
环己酮的制备方法环己酮是一种重要的有机化合物,广泛应用于药物、香料、橡胶和塑料等领域。
本文将介绍环己酮的制备方法。
环己酮的制备方法有多种,下面将分别介绍几种常用的制备方法。
1. 环己酮的氧化还原法制备。
这种方法是通过将环己烯与氧气在催化剂的作用下进行氧化反应,生成环己酮。
常用的催化剂有铜、铁、钴等。
该方法操作简单,反应条件温和,且废气处理相对容易,是一种常用的制备环己酮的方法。
2. 环己酮的羟甲基化反应制备。
这种方法是将环己酮与甲醇在酸性条件下反应,生成羟甲基环己酮。
然后再经过脱水反应,得到环己酮。
这种方法具有反应条件温和,产率较高的优点,但废气处理相对较为复杂。
3. 环己酮的氯甲基化反应制备。
这种方法是通过将环己酮与氯甲烷在碱性条件下反应,生成氯甲基环己酮。
然后再经过脱氯反应,得到环己酮。
这种方法操作简单,废气处理相对容易,但是由于使用了有毒的氯甲烷,对环境有一定的污染。
4. 环己酮的氧化反应制备。
这种方法是通过将环己烷与氧气在高温条件下反应,生成环己酮。
该方法反应条件较为苛刻,操作较为复杂,但产率较高。
5. 环己酮的酮化反应制备。
这种方法是通过将环己醇与氧气在催化剂的作用下进行氧化反应,生成环己酮。
该方法反应条件较为温和,但催化剂的选择和废气处理都需要考虑。
总结起来,环己酮的制备方法有氧化还原法、羟甲基化反应、氯甲基化反应、氧化反应和酮化反应等多种。
不同的方法适用于不同的应用场景,制备过程中需要考虑反应条件、产率和废气处理等因素。
在实际生产中,应根据具体需求选择合适的制备方法。
有机化学实验报告
实验名称:环己酮的制备
学院:化学工程学院
专业:化学工程与工艺
班级:化工10-2班
姓名:张敬文学号12402010620 指导教师:房江华、李颖
日期:2013年11月4日
一、实验目的
1.学习次氯酸氧化法制环己酮的原理及方法。
2.进一步了解醇和酮之间的联系与区别。
二、实验原理
用次氯酸钠作氧化剂,将环己醇氧化成环己酮。
反应式:
三、主要试剂及物理性质
名称分子量性状熔点/℃沸点/℃溶解度(水)
密度(g/ml)
环己醇100.16 无色液体22~25 161.5 5.67g/100ml 1.0171
环己酮98.14 无色液体
-155.65 2.4g/100ml 0.9478
四、试剂用量规格
环己醇5g(5.2ml),冰醋酸,次氯酸钠溶液(约1.8mol/L),饱和亚硫酸钠溶液,氧化铝,KI淀粉试纸,无水碳酸钠,无水硫酸镁。
五、仪器装置
250ml三颈烧瓶,搅拌器,滴液漏斗,温度计,冷凝管,接受器,分液漏斗。
六、实验步骤及现象
步骤现象
5.2ml环己醇,25ml冰醋酸加入150ml
三颈烧瓶
均相,无色
滴加38mlNaClO溶液0.5~1h(搅拌,
冰水冷却后)
26℃,透明无色,未变化搅拌5~10min(30~35℃)
利用淀粉KI试纸检验(未变蓝再加
2ml NaClO)
试纸变蓝紫色在室温下继续搅拌30min
加入适量饱和亚硫酸氢钠溶液至反
应液对碘化钾淀粉试纸不显蓝色为
止
淀粉KI试纸不显蓝色
向反应液中加入30ml水、3g氯化铝和几粒沸石,在石棉网上加热蒸馏至流出液无油珠滴出为止开始有大量油珠流出,直至无油珠滴出(溶液白色,浑浊)
在搅拌下向流出液分批加入无水碳酸钠至反应液呈中性为止大量气泡产生,溶液变浑浊,后溶液澄清,直至PH试纸检测呈中性
加入氯化钠使之变成饱和溶液
将反应液倒入分液漏斗,分出有机层
(三角烧瓶)
上层为油状液体,下层为水层用无水硫酸镁干燥,不结块为止粉状固体在瓶底结块,最后不结块
蒸馏收集150-155℃馏分(空气冷凝
管)第一滴:124℃最后一滴:132℃圆地烧瓶上出现也裂痕
计算产率
七、实验结果
理论环己酮的质量m=98.14×(5.2×1.017)/100.16=5.182g 三角烧瓶m1=61.15g
三角烧瓶+环己酮m2=65.45g
环己酮的总质量m3=4.30g
各组环己酮的平均质量m’=1.075g
产率=(m’/m)×100%=(1.075/5.182) ×100%=20.74%
八、实验讨论
实验产率相对较低原因:
1.操作过程不够精细。
2.可能是加热蒸馏不充分,液面上还漂浮着黄棕色的油状小液滴时就停止蒸馏,导致产率较低。
3.分液静止时间不够长,导致环己酮的损失。