北京地区常见蔬菜中叶黄素_玉米黄素和_胡萝卜素的测定及其含量
- 格式:pdf
- 大小:1.02 MB
- 文档页数:5

叶绿素、类胡萝卜素含量的测定一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量;根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C 和液层厚度L成正比,即A=αCL式中:α比例常数;当溶液浓度以百分浓度为单位,液层厚度为1cm 时,α为该物质的吸光系数;各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得;如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和;这就是吸光度的加和性;今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b及类胡萝卜素在该波长下的吸光系数即可求出其浓度;在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰;二、材料、仪器设备及试剂一材料:新鲜或烘干的植物叶片;二仪器设备:1分光光度计;2电子顶载天平感量;3研钵;4棕色容量瓶; 5小漏斗;6定量滤纸;7吸水纸; 8擦境纸;9滴管;三试剂:195%乙醇或80%丙酮v丙酮:v乙醇=2:1的95%水溶液;2石英砂;3碳酸钙粉; 暗中2h,,25ml三、实验步骤1取新鲜植物叶片或其它绿色组织或干材料,擦净组织表面污物,剪碎去掉中脉,混匀;2将取好的样品放入25ml容量瓶中,加混合浸提液无水乙醇:丙酮=5:520ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用;3把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度;选择波长663 646 和470nm;四、实验结果计算叶绿素a 的浓度 = OD 633 – OD 646叶绿素b 的浓度 = OD 646– OD 663类胡萝卜素浓度=÷229 单位 mg/L Cmg/L 提取液总量ml叶绿体色素含量mg/g= ____________________________ 烟叶重量g1000注意事项:操作避光研磨时间短些。




蔬菜中天然色素的提取、分离和测定一、目的与要求1.进一步熟悉和掌握薄层色谱的原理。
2.掌握薄层层析法分离微量组分的操作技术。
3.了解蔬菜中主要色素的基本性质,通过色素的提取和分离,了解天然物质分离提纯方法及原理。
二、基本原理(一)菠菜中的色素简介菠菜叶中富含多种色素成分,如叶绿素(绿色)、胡萝卜素(橙黄色)和叶黄素(黄色)等多种天然色素。
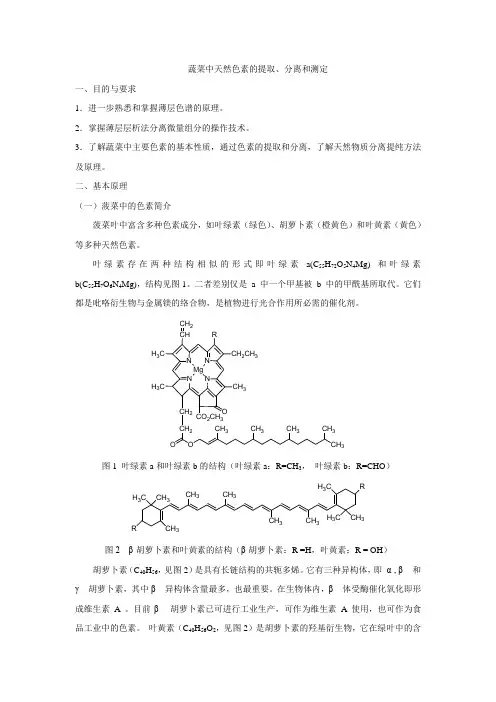
叶绿素存在两种结构相似的形式即叶绿素a(C 55H 72O 5N 4Mg) 和叶绿素b(C 55H 7O 6N 4Mg),结构见图1。
二者差别仅是 a 中一个甲基被 b 中的甲酰基所取代。
它们都是吡咯衍生物与金属镁的络合物,是植物进行光合作用所必需的催化剂。
NN N N H 3C CHCH 2R CH 2CH 3CH 3H 3C O CO 2CH 3CH 2CH 2O O CH 3CH 3CH 3CH 3CH 3Mg图1 叶绿素a 和叶绿素b 的结构(叶绿素a :R=CH 3, 叶绿素b :R=CHO )H 3C CH 3R CH 3H 3C R H 3C CH 3CH 3CH 3CH 3CH 3图2 β-胡萝卜素和叶黄素的结构(β-胡萝卜素:R =H ,叶黄素:R = OH )胡萝卜素(C 40H 56,见图2)是具有长链结构的共轭多烯。
它有三种异构体,即 α-, β - 和γ - 胡萝卜素,其中β - 异构体含量最多,也最重要。
在生物体内,β - 体受酶催化氧化即形成维生素 A 。
目前β - 胡萝卜素已可进行工业生产,可作为维生素 A 使用,也可作为食品工业中的色素。
叶黄素(C 40H 56O 2,见图2)是胡萝卜素的羟基衍生物,它在绿叶中的含量通常是胡萝卜素的两倍。
与β - 胡萝卜素相比,叶黄素较易溶于醇而在石油醚中溶解度较小。
根据这些色素在有机溶剂中的溶解性,可将它们提取出来。
1.菠菜中各色素的理化性质绿色植物中的叶绿体色素在把光能转变为化学能的光和作用中起着重要作用。

0引言玉米是世界上种植面积最大和总产量最高的粮食作物,同时也是我国第一大作物,对保障我国粮食安全具有重要战略意义[1]。
玉米中含有较多的营养成分,其中为人所熟知的是胡萝卜素、叶黄素和玉米黄素[2]。
胡萝卜素有α、β、γ等同分异构体,其中以β-胡萝卜素生理活性最强,是重要的维生素A源[3]。
β-胡萝卜素分子式为C40H56,其化学结构为两边反向对称,分子结构中包含有两个β-紫罗兰酮和4个异戊二烯,中心断裂可产生两个维生素A分子[4]。
因此β-胡萝卜素是动物体内维生素A的重要来源,且具有预防眼疾、保护视力、预防和改善肿瘤、抗衰老的功能[5]。
而对于叶黄素和玉米黄素,经研究发现它们是一组同分异构体,化学结构为C40H56O2,叶黄素是α-胡萝卜素的衍生物,玉米黄素则是β-胡萝卜素的衍生物[6]。
叶黄素和玉米黄素对人体的健康有多种营养功能,如防止视网膜损伤[7]、抗氧化[8]、调节免疫功能[9]以及抑制肿瘤细胞增殖,延缓动脉粥样硬化等[10]。
因此,二者已被认为是重要的营养物质。
通过上述研究成果我们可以大概地了解到叶黄素、玉米黄素、β-胡萝卜素它们有自己的独特的性质,而叶黄素、玉米黄素作为一种同分异构体,对其特性的研究更为人们所重视和感兴趣。
同分异构体虽然是分子式相同,但作用还是有一定区别的。
本次研究收集同一产地不同品种的玉米,测定并筛选出叶黄素、玉米黄素、β-胡萝卜素含量相对较高的优良品种,为后续对叶黄素、玉米黄素、β-胡萝卜素研究提供一些帮助,从不同品种玉米中叶黄素徐从华,马挺军*(北京农学院食品科学与工程学院,北京102206)摘要:对21种玉米中叶黄素、玉米黄素和β-胡萝卜素的含量进行定量分析,从而筛选出含量较高的品种,为农业生产及功能育种提供有效的依据。
采用HPLC检测叶黄素、玉米黄素和β-胡萝卜素的含量。
结果显示,叶黄素与玉米黄素高含量的三个品种是强49、大2和农16,其中含量最高的品种为强49,β-胡萝卜素含量最高的品种是强49,其β-胡萝卜素含量为752.63mg/100g,叶黄素含量为854.40mg/100g,玉米黄素含量为227.80mg/100g。

HPLC法测定保健食品中叶黄素含量周立梅;杨磊;张金秋;高畅;姜文月【摘要】[目的]建立改良的HPLC-C18法测定保健食品中叶黄素含量.[方法]优化样品前处理方法,通过单因素考察对破囊溶剂种类、破囊时间、提取时间、提取溶剂进行优化,采用常规HPLC-C18分析方法进行测定.色谱条件为:流动相甲醇,流速1.0 mL/min,检测波长446 nm,柱温30℃,进样量20μL.[结果]叶黄素在0.1396~2.0940μg/mL与峰面积线性关系良好,平均回收率为99.55%,RSD为2.21%.[结论]改良后的方法操作简便、准确、稳定,所用试剂绿色环保,可用于保健食品中叶黄素含量测定.【期刊名称】《安徽农业科学》【年(卷),期】2018(046)020【总页数】3页(P164-166)【关键词】高效液相色谱;保健食品;叶黄素;含量测定【作者】周立梅;杨磊;张金秋;高畅;姜文月【作者单位】长春康彼达科技有限公司,吉林长春130000;长春康彼达科技有限公司,吉林长春130000;长春康彼达科技有限公司,吉林长春130000;长春康彼达科技有限公司,吉林长春130000;长春康彼达科技有限公司,吉林长春130000【正文语种】中文【中图分类】TS207.3叶黄素属于含氧类胡萝卜素,主要存在于深绿色蔬菜(菠菜、羽衣甘蓝等)、蛋黄、玉米、柑橘类等水果中,人体不能直接合成。
越来越多流行病学和临床试验表明,膳食或血清中较高含量的叶黄素可降低眼部疾病患病风险[1]。
作为生理活性物质,叶黄素在医学和功能食品领域具有广阔的研究开发前景[2]。
目前,利用HPLC法测定保健食品中叶黄素含量的方法有2种,一种是以C30为分离色谱柱的测定方法[3],另一种是党亚敏等[4]以C18为分离色谱柱的测定方法,其中C30分离色谱柱使用不广泛。
测定叶黄素的色谱条件相对成熟,但是样品处理方法很多,如无水乙醇超声提取法[4]、石油醚超声提取法[5]、水提正己烷—乙酸乙酯萃取法[6]等。

新鲜果蔬中β-胡萝卜素的快速测定
陈有根;张蓉;胡琴
【期刊名称】《食品科学》
【年(卷),期】2008(29)3
【摘要】选用胡萝卜、番茄和红辣椒三种常见新鲜果蔬作为供试品,采用无水乙醇匀浆、脱水,丙酮提取-直接定容的方法制备供试品溶液,使用高效液相色谱法测定供试品中β-胡萝卜素的含量。
结果表明:三种供试品中β-胡萝卜素的含量分别为0.841、0.067、0.260mg/100g;平均加标回收率为95.45%(RSD=1.41%,n=5)、97.17%(RSD=0.94%,n=5)、97.54%,(RSD=0.86%,n=5)。
此方法结果准确、方便快捷、重复性好,可用于多种新鲜果蔬中β-胡萝卜素含量的快速测定。
【总页数】3页(P406-408)
【关键词】新鲜果蔬;胡萝卜;番茄;红辣椒;β-胡萝卜素;快速测定
【作者】陈有根;张蓉;胡琴
【作者单位】北京市药品检验所
【正文语种】中文
【中图分类】TS255.7
【相关文献】
1.改良的DNS法测定新鲜果蔬中的糖分 [J], 冯吉
2.一种测定枸杞鲜果中总类胡萝卜素含量的方法 [J], 蔡靳;惠伯棣;蒋继志;吴真真;宫平;关欣
3.催化动力学光度法测定新鲜果蔬中痕量亚硝酸根 [J], 许卉
4.新鲜果蔬中还原型VC含量的测定方法优化 [J], 杨金凤;谢天柱;王凤霞;祁雪梅;呼丽萍
5.对新鲜果蔬中维生素C的测定结果影响因素研究 [J], 张冬梅;汪振立;罗六保;邓通德
因版权原因,仅展示原文概要,查看原文内容请购买。

食品检验实验:蔬菜中胡萝卜素的测定(纸层析法)(一)原理蔬菜的植物色素包括叶绿素、叶黄素及胡萝卜素等,它们能被丙酮石油醚溶液提取出来。
将样品提取液进行纸上层析,由于胡萝卜素极性最小,故被石油醚洗走的速度最快,从而可将胡萝卜素与其他色素分开,然后将胡萝卜素层析带洗脱进行比色定量。
(二)器材1.小乳钵。
2.10ml容量瓶。
3.层析缸。
4.层析纸。
5.分液漏斗50ml或100ml6.光电比色计。
(三)试剂1.石油醚(沸程60~90℃分析纯)。
2.丙酮(分析纯)。
3.丙酮-石油醚液(3:7) 以三份丙酮和七份石油醚振摇混合。
4.经过处理的河沙取河沙置于烧杯中,加10%HCl至高出沙面约1cm煮沸(煮时不断搅动),然后弃去HCl,用蒸馏水洗至无酸为止。
5.无水硫酸钠(分析纯)。
6.β-胡萝卜素标准溶液精确称取纯β-胡萝卜素40mg于几毫升氯仿里,然后以石油醚稀释至100ml容量瓶中定容。
取该溶液5ml用石油醚稀释至50ml容量瓶中定容,即得40μg/ml的胡萝卜素标准应用液,置冷暗处保存。
(四)操作步骤1.在分液漏斗内先放30ml水。
2.称取绿叶蔬菜的均匀样品2g放入乳钵中(备25ml 3:7的丙酮-石油醚溶液)。
加少许河沙和数毫升丙酮-石油醚溶液于乳钵内,将样品研磨成糊状,用滴管吸取提取液至分液漏斗内。
这样,25ml丙酮-石油醚分十数次提取,直至提取液基本无色为止。
3.振摇分液漏斗,使丙酮溶于水中,待分层后,放去水层,加水洗涤3~4次以除尽丙酮。
过滤前,用吸水纸条吸干分液漏斗管口的水分。
4.将提取液通过盛有无水硫酸钠的漏斗,滤入10ml容量瓶内,再加少许石油醚洗涤漏斗及滤纸上附着的色素,并注入容量瓶内,加石油醚至10ml刻度,混匀。
5.层析(1)点样:于滤纸底端距边约3cm处,用铅笔画一基线,以1ml注射器准确吸取石油醚提取液0.5ml,徐徐点在基线的一条(或一点)上。
(2)展开:将点好样的滤纸卷成圆筒状(或呈长条状),两边用线系牢,但不使两边重叠,放人事先以石油醚饱和的层析缸内,层析纸要放正,不接触缸边,层析纸基线下1/3浸入液面以内,进行上行展开。
高效液相色谱法测定15种蔬菜中的β-胡萝卜素郑群雄;杜美霞;徐小强;刘煌【期刊名称】《食品科学》【年(卷),期】2012(033)014【摘要】应用高效液相色谱法测定国内常用的15种蔬菜中β-胡萝卜素含量。
蔬菜中的β-胡萝卜素经超声提取,用KromasilC18(4.6mm×300mm,5μm)色谱柱,甲醇.四氢呋喃(THF).2,6-二叔丁基-4-甲基苯酚(BHT)(9:1:0.01,wy)为流动相,紫外检测器检测,检测波长为448nm。
结果表明,β-胡萝卜素出峰时间短(21min),检出限低(0.075μg/mL),在1~50μg/mL 质量浓度范围内线性关系良好(R2=0.9997),平均加标回收率达97.84%(n=5)。
该方法可避免β-胡萝卜素在预处理过程中被氧化,重复性好、操作简便、结果可靠,可用于多种新鲜蔬菜中β-胡萝卜素含量的测定。
【总页数】4页(P238-241)【作者】郑群雄;杜美霞;徐小强;刘煌【作者单位】浙江工商大学食品与生物工程学院,浙江杭州310035;浙江工商大学食品与生物工程学院,浙江杭州310035;浙江工商大学食品与生物工程学院,浙江杭州310035;浙江工商大学食品与生物工程学院,浙江杭州310035【正文语种】中文【中图分类】R151【相关文献】1.高效液相色谱法测定蔬菜中的类胡萝卜素 [J], 宋曙辉;薛颖2.高效液相色谱法测定蔬菜中β-胡萝卜素的不确定度评定 [J], 王晓婧;曹梦锦;张雪松;王国栋;王竹3.高效液相色谱法分析蔬菜水果及其制品中类胡萝卜素含量的研究 [J], 刘新艳;吕军;刘中笑;李凌云;张延国;郑姝宁;徐东辉4.反相高效液相色谱法测定枸杞干果及枸杞籽油中玉米黄质·β-胡萝卜素和叶黄素[J], 马桂娟;朱捷;汤丽华;谢芳;王紫昕;朱燕燕5.高效液相色谱法测定蔬菜中类胡萝卜素组分 [J], 赵显峰;潘丽莉;孟晶;王茵;江月仙;荫士安因版权原因,仅展示原文概要,查看原文内容请购买。
植物源食品中α-胡萝卜素和β-胡萝卜素的测定及比较分析崔亚娟1,2,孔凡华2,刘国杰1,*,鲁 绯2,李 东2(1.中国农业大学园艺学院,北京 100094;2.北京市营养源研究所,北京市系统营养工程技术研究中心,北京 100069)摘 要:采用高效液相色谱法建立植物源食品中α-胡萝卜素和β-胡萝卜素同时在线分析检测技术,并以胡萝卜冻干粉为样品进行方法学验证。
结果显示,α-胡萝卜素和β-胡萝卜素分别在0.8~20、0.4~8.2 μg /mL 范围内线性良好,精密度的相对标准偏差分别为4.45%、4.71%,加标回收率分别为96%~112%、83.5%~103%,加标回收率的相对标准偏差分别为2.67%~5.83%、4.90%~7.42%,以上结果说明该方法重复性良好、准确可行。
采用该方法测定了多种植物源食品的胡萝卜素含量并进行比较分析,大多数样品中β-胡萝卜素含量高于α-胡萝卜素,只有南瓜中所含的α-胡萝卜素高于β-胡萝卜素。
关键词:高效液相色谱法;胡萝卜素;α-胡萝卜素;β-胡萝卜素;植物源食品Determination and Comparison of α-Carotene and β-Carotene of Plant-Derived FoodsCUI Yajuan 1,2, KONG Fanhua 2, LIU Guojie 1,*, LU Fei 2, LI Dong 2(1. College of Horticulture, China Agricultural University, Beijing 100094, China; 2. Beijing Institute of Nutrition Resources,Beijing System Nutrition Engineering and Technology Research Center, Beijing 100069, China)Abstract: The study was conducted to develop an analytical method for simultaneous online determination of α-carotene and β-carotene in plant-derived foods by high performance liquid chromatography (HPLC). Furthermore, the method was validated with freeze-dried carrot powder. The results showed that the calibration curves for α-carotene and β-carotene were linear in the ranges of 0.8–20 and 0.4–8.2 μg /mL, respectively. The precision expressed as relative standard deviation (RSD) were 4.45% and 4.71%, respectively. The recoveries at three spiked levels were 96%–112% and 83.5%–103% with RSD values of 2.67%–5.83% and 4.90%–7.42%, respectively. These data indicated good repeatability and accuracy. Comparative analysis of various plant-derived foods by this method showed that β-carotene was more abundant than α-carotene in all samples except for pumpkin, which gave the opposite result.Keywords: high-performance liquid chromatography; carotene; α-carotene; β-carotene; plant-derived foods DOI:10.7506/spkx1002-6630-201804029中图分类号:TS201.4 文献标志码:A 文章编号:1002-6630(2018)04-0194-05引文格式:崔亚娟, 孔凡华, 刘国杰, 等. 植物源食品中α-胡萝卜素和β-胡萝卜素的测定及比较分析[J]. 食品科学, 2018, 39(4): 194-198. DOI:10.7506/spkx1002-6630-201804029. CUI Yajuan, KONG Fanhua, LIU Guojie, et al . Determination and comparison of α-carotene and β-carotene of plant-derived foods[J]. Food Science, 2018, 39(4): 194-198. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201804029. 收稿日期:2017-02-20基金项目:首都食品安全科技创优培育专项(Z141100002614013)第一作者简介:崔亚娟(1979—),女,副研究员,博士,研究方向为食物营养与健康。
叶黄素的测定方法
嘿,咱来说说叶黄素的测定方法哈。
有一回啊,我对叶黄素特别好奇,就想知道这玩意儿咋测定呢。
我就开始各种查资料,还问了一些懂行的人。
一般来说呢,可以用高效液相色谱法来测定叶黄素。
这方法听着挺高大上,其实也不难理解。
就是把含有叶黄素的东西,比如食物啊、保健品啊啥的,弄成溶液,然后放到一个仪器里。
这个仪器就像个小侦探一样,能把叶黄素给找出来,还能算出有多少。
我记得有一次,我看到一个实验室的人在测定叶黄素。
他们穿着白大褂,戴着眼镜,看起来可专业了。
他们把一些蔬菜打成汁,然后过滤一下,就放到那个高效液相色谱仪里去了。
我在旁边看着,心里可好奇了。
过了一会儿,仪器上就显示出了一些数据。
他们就根据这些数据,算出了蔬菜里叶黄素的含量。
除了高效液相色谱法,还有分光光度法也可以测定叶黄素。
这个方法就比较简单了,就是用一些化学试剂,让叶黄素变色。
然后根据颜色的深浅,来判断叶黄素的含量。
我觉
得这个方法就像变魔术一样,挺好玩的。
其实啊,测定叶黄素的方法还有很多呢。
不过不管用啥方法,都得小心仔细,不能出错。
不然得出的结果就不准确了。
总之啊,叶黄素的测定方法有很多种,我们可以根据自己的需要选择合适的方法。
这样就能知道我们吃的东西里有多少叶黄素啦。