课题3溶液浓度导学案
- 格式:doc
- 大小:34.50 KB
- 文档页数:1
课题3 溶液的浓度漂市一中钱少锋学习目标1.理解溶液组成的含义。
2.掌握一种溶液组成的表示方法——溶质质量分数能进行溶质质量分数的简单计算。
3. 初步学会根据需要配制一定溶质质量分数的溶液。
重点、难点重点:了解溶质质量分数概念;难点:有关溶质质量分数的计算。
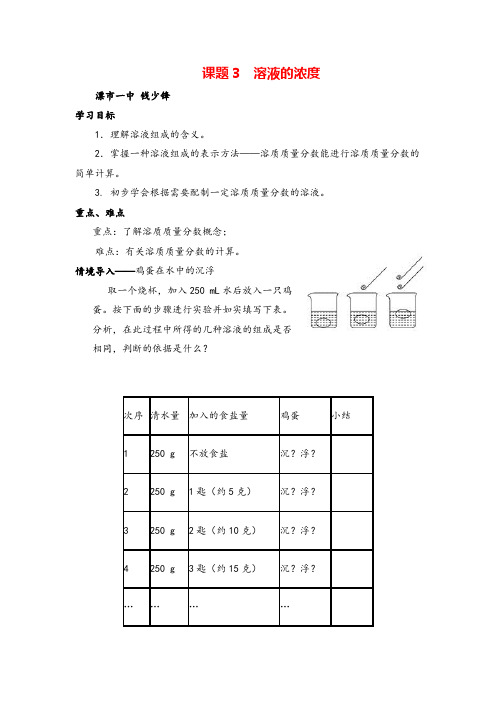
情境导入——鸡蛋在水中的沉浮取一个烧杯,加入250 mL水后放入一只鸡蛋。
按下面的步骤进行实验并如实填写下表。
分析,在此过程中所得的几种溶液的组成是否相同,判断的依据是什么?次序清水量加入的食盐量鸡蛋小结1 250 g 不放食盐沉?浮?2 250 g 1匙(约5克)沉?浮?3 250 g 2匙(约10克)沉?浮?4 250 g 3匙(约15克)沉?浮?…………学习研讨一、溶质的质量分数【自主学习】【活动与探究一】【实验9-7】在三个小烧杯中各加入20 mL水,然后分别加入约0.1 g、0.5 g、2 g无水硫酸铜。
比较三种硫酸铜溶液的颜色。
分析,在这三支试管中溶液的组成是否相同,判断的依据是什么?填写下表【交流讨论】如何区分溶液的浓稀?【归纳小结】即溶质的质量分数。
【自主学习】阅读课本P43,知道表示溶液组成的方法——溶质质量分数。
溶液中的溶质质量分数是 _________________________________________。
表达式:【交流讨论】1、实验9-7中,三种溶液的溶质质量分数分别是多少?2、表达式的几种变形【巩固练习】课后习题1【交流讨论】溶解度与溶质质量分数间的区别和联系【活动与探究二】:【实验9-8】按下表所定的量配制氯化钠溶液(水的密度看作1g/cm3)。
【设问】已知溶质和溶剂的量,这样的溶液,我们会配制了。
那如果告诉你一定量的一定质量分数的溶液,你会配制吗?【交流讨论】欲配制50g质量分数为6%的氯化钠溶液该如何操作?请你试一试。
【活动与探究三】:P47【实验活动5】【小结】1.配制溶液的步骤:、、、、。
2.实验仪器:所需仪器:溶解:;。

人教版九年级化学课题3 溶液的浓度(1)导学案一、导入1. 导入问题- 请问你在日常生活中遇到过哪些溶液?你了解这些溶液的浓度是如何计算的吗?2. 导入概念- 溶液的浓度指的是溶质在溶液中的含量。
- 溶液的浓度可以用不同的表示方法来表示,如质量浓度、体积浓度等。
二、知识讲解1. 溶液的质量浓度 - 溶液的质量浓度是指单位体积(单位为mL)溶液中所溶质的质量。
- 质量浓度(C)的计算公式为:C = (溶质质量(g)/ 溶液体积(mL)) × 100%2. 溶液的体积浓度 - 溶液的体积浓度是指单位体积(单位为L)溶液中所溶质的体积。
- 体积浓度(V)的计算公式为:V = (溶质体积(mL)/ 溶液体积(L)) × 100%3. 溶液的摩尔浓度 - 溶液的摩尔浓度是指单位体积(单位为L)溶液中所溶质的物质的量。
- 摩尔浓度(M)的计算公式为:M = 溶质物质的量(mol)/ 溶液体积(L)三、例题解析例题1若有一瓶体积为250 mL 的盐水溶液,其中含有5 g 的NaCl,求此溶液的质量浓度。
解答:质量浓度(C)的计算公式为:C = (溶质质量(g)/ 溶液体积(mL)) × 100%根据题目,溶质质量为5 g,溶液体积为250 mL,代入公式进行计算: C = (5 g / 250 mL) × 100% = 2%所以,此溶液的质量浓度为2%。
例题2已知一瓶体积为500 mL 的氨水溶液中含有30 mL 的氨气(NH3),求此溶液的体积浓度。
解答:体积浓度(V)的计算公式为:V = (溶质体积(mL)/ 溶液体积(L)) × 100%根据题目,溶质体积为30 mL,溶液体积为500 mL,将溶液体积单位转换为升:溶液体积 = 500 mL = 0.5 L代入公式进行计算:V = (30 mL / 0.5 L) × 100% = 60%所以,此溶液的体积浓度为60%。

人教版九年级化学下册课题3 溶液的浓度导学案一、导入1. 引入问题大家在日常生活中是否遇到过溶液?溶液在生活中的应用有哪些?是否有了解过溶液的浓度是如何计算的呢?2. 预习目标通过本节课的学习,你将能够: - 理解溶液浓度的概念; - 掌握溶液浓度的计算方法; - 分析和解决涉及溶液浓度的实际问题。
3. 激发兴趣通过展示一些溶液在日常生活中的应用,如饮料、盐水、果汁等,让学生了解到溶液与我们的生活息息相关,引发学生的兴趣。
二、概念阐释1. 溶液的定义溶液是指由溶质和溶剂组成的均匀混合物。
其中,溶质是指能被溶解的物质,溶剂是指起溶解作用的物质。
2. 溶液的浓度溶液的浓度是指单位体积(或质量)中所含溶质的数量多少。
常用的表示溶液浓度的单位有质量分数、体积分数、摩尔浓度等。
三、计算方法1. 质量分数(w)质量分数是溶质在溶液中的质量与溶液总质量之比,通常用百分数表示。
质量分数(w)= (溶质的质量 / 溶液的总质量) × 100%2. 体积分数(V)体积分数是溶质的体积与溶液总体积之比,通常用百分数表示。
体积分数(V)= (溶质的体积 / 溶液的总体积) × 100%3. 摩尔浓度(C)摩尔浓度是指溶液中溶质的摩尔数与溶液体积之比,单位为mol/L。
摩尔浓度(C)= (溶质的摩尔数 / 溶液的体积)四、计算示例示例一已知某溶液中NaCl的质量为40g,溶液的总质量为200g,求该溶液的质量分数。
解:质量分数(w)= (溶质的质量 / 溶液的总质量) × 100%代入数值得:质量分数(w)= (40g / 200g) × 100% = 20%因此,该溶液的质量分数为20%。
示例二某溶液中含有NaOH 10mol/L 的溶液,溶液的体积为100ml,求该溶液的摩尔浓度。
解:摩尔浓度(C)= (溶质的摩尔数 / 溶液的体积)代入数值得:摩尔浓度(C)= (10mol / 0.1L) = 100mol/L因此,该溶液的摩尔浓度为100mol/L。

课题3 溶液的浓度学习目标、要求:1、学会配制一定溶质质量分数的溶液的方法与步骤;2、能进行溶质质量分数与化学方程式的综合计算3、初步掌握一定溶质质量分数的溶液配制过程中实验误差的分析。
学习重点、难点:1、学会配制一定溶质质量分数的溶液的方法与步骤;2、能进行溶质质量分数与化学方程式的综合计算学习过程:一、温故知新1.下列说法正确的是( ) A.食盐的溶解度是36克 B.100克水溶解了36克食盐达到饱和,所以食盐的溶解度为36克 C.20℃时,食盐的溶解度为36克D.20℃时,100克食盐溶液中含有36克食盐,所以食盐的溶解度为36克2.20℃时,氯酸钾的溶解度为7.4克,其含义是( )A.20℃时,100克水中最多能溶解氯酸钾7.4克B.20℃时,100克氯酸钾饱和溶液中含有氯酸钾7.4克C.把7.4克氯酸钾溶解在100克水中,恰好制成饱和溶液D.7.4克氯酸钾可以溶解在100克水里。
3.已知硝酸钾的溶解度随温度升高而增大,现有一瓶t℃时的硝酸钾饱和溶液,下面对它的说法正确的是( )A.它一定是浓溶液B.降低温度,有晶体析出,剩余溶液仍为饱和溶液C.升高温度,晶体不析出,溶液的溶质质量分数减少D.在t℃时加入硝酸钾,溶液的溶质质量分数增大4.固体物质溶解度曲线上的任意一点表示( )A.一定温度和一定量溶剂里溶解溶质的质量B.相应温度下,100克溶剂里溶解溶质的质量C.相应温度下,100克溶剂里最多能溶解溶质的质量D.溶液达到饱和状态时溶解溶质的质量5.20℃时,50克水中溶解18克食盐达到饱和,则20℃时,NaCl的溶解度是( )A.18B.18克C.36D.36克二、走进新课1.演示【实验9-7】,三支试管中加入20ml水,分别加入约0.1g、0.5g、2g固体硫酸铜。
比较颜色。
思考三支试管中溶液的组成是否相同?判断溶液浓稀的根据是什么?。

课题3 溶液的浓度学习目标、重点、难点【学习目标】1、掌握一种溶液组成的表示方法——溶质的质量分数,能进行溶质质量分数的简单计算。
2、初步学会配制一定溶质质量分数的溶液。
【本节重点】 溶质的溶质质量分数的概念和简单的计算以及配制一定溶质质量分数的溶液【本节难点】 溶液的溶质质量分数概念的引入。
本节知识概览图m 2.医疗上常用生理盐水给病人补充体液.现有0.9%的生理盐水500 g ,该溶液含溶质氯化钠 g ,可由10%的氯化钠溶液 g 稀释得到.3.制作“叶脉书签”需要100 mL 质量分数为10%的氢氧化钠溶液(密度为1.1 g /cm 3).(1)配制时需要氢氧化钠固体的质量是 g ,水的质量是 g.(2)若用20%的氢氧化钠溶液和水配制,需要20%的氢氧化钠溶液的质量是 g.4 请根据下列实验要求填空.实验室为了配制50 g 5%的NaCl 溶液,需进行如下操作:①计算;②用 称取 g 氯化钠;③用 (填“10 mL ”或“50 mL ”)的量筒量取 mL 水;④将二者置于烧杯中,用 搅拌,使其溶解.5 如图9-41所示为M 、N 两种物质的溶解度曲线,由溶解度曲线得出以下几条信息,你认为正确的是( )A.t 1℃,M 、N 两种物质溶液的溶质质量分数相等 定义:溶质质量与溶液质量之比为溶质的质量分数 公式:100%=⨯溶质质量溶质的质量分数溶液质量E.由t1℃升温到t2℃时,N物质的溶质质量分数不变C.M物质的溶解度大于N物质的溶解度D.N物质的溶解度随温度的升高而减小6.将少量的生石灰加到一定质量的饱和石灰水中,溶液的温度升高,再恢复到室温(不考虑水的蒸发).如图9—42所示的四位同学对变化后溶液的分析错误的是()7 .农业生产中,常需要用质量分数为16%的氯化钠溶液来选种.下列操作不可能配成所需溶液的是()A. 一定量氯化钠固体溶于适量水中B.一定量24%的氯化钠溶液加适量水稀释C.15%的氯化钠溶液和13%的氯化钠溶液按一定比例混合D.18%的氯化钠溶液和l0%的氯化钠溶液按一定比例混合8. (1)汽油与酒精分别加入蒸馏水中,能形成溶液的是 .(2)白糖固体放入口中有清凉感觉.请从溶解现象推测其可能原因是 .(3)图9-43是a、b两种固体物质的溶解度曲线.①当温度低于20℃时,溶解度:a b(填“>”“<”或“=”);②t℃时,将a、b两物质的饱和溶液均加热至 40℃(a、b不分解,水分未蒸发),两种溶液中溶质的质量分数:a b(填“>”“<”或“=”).体验中考1.用固体氯化钠配制100g10%的氯化钠溶液,不需要使用的仪器是 ( )A.436.8 mLB.453.7mLC.456.0 mLD.458.3mL3.下列各项中,前者一定大于后者的是 ( )A.20℃时KN03的溶解度、80℃时KN03的溶解度B.30℃时,NaCl 不饱和溶液的质量分数、NaCl 饱和溶液的质量分数C.10 g 镁与足量盐酸反应生成H 2的质量、10g 铝与足量盐酸反应生成H 2的质量D.NaOH 溶于水后溶液的温度、NH 4N03溶于水后溶液的温度4.将70℃的硝酸钠饱和溶液降温到10℃,有晶体析出(晶体中不含水),下列各量没有发生变化的是 ( )A.硝酸钠的溶解度B.溶液中溶质的质量C.溶液中溶剂的质量D.溶液中溶质的质量分数学后反思附: 课堂检测及体验中考答案 课堂检测1 .答案:D.2. 答案:4.5;453 .答案:(1)11;99 (2)554. 答案:②托盘天平;2.5;③50 mL;47.5;④玻璃棒5 .答案:D.6.答案:D.7.答案:C.8.答案:(1)酒精 (2)白糖溶于水吸热 (3)①<②=体验中考1.答案:B.2.答案:B.3.答案:D.4.答案:C.。

《课题3 溶液的浓度》教案【教学目标】1、知识与技能(1)掌握一种溶液组成的表示方法——溶质的质量分数,并能进行溶质质量分数的简单计算。
(2)初步学会配制一定溶质质量分数的溶液。
2、过程与方法(1)会分析问题、解决问题,提高解题能力。
(2)能找准各量的关系。
3、情感态度与价值观(1)学会严谨求实的科学学习方法。
(2)培养具体问题具体分析的能力。
【教学重、难点】1、教学重点(1)溶质的质量分数的概念及简单计算。
(2)配制溶液的操作步骤。
2、教学难点溶质的质量分数的有关计算。
【教学方法】比较、归纳、练习、对比、活动探究。
【教具准备】教师用具:投影仪。
学生用具:仪器:试管、天平、量筒、药匙、烧杯、玻璃棒;药品:硫酸铜、水、氯化钠。
【课时安排】3课时【教学设计】(第一课时)[学习情境]展示三种不同颜色的CuSO溶液。
4[介绍]以上试管中的液体都是我们以前学过的溶液。
[设问]你观察到了什么?看到这些,你想到了什么? [学生发言]1.三种溶液颜色深浅不同。
2.它们可能是不同物质的水溶液。
3.它们可能是溶质含量不同的同种溶质的水溶液。
[活动探究](投影展示)在三支试管中各加入10 mL(1 mL 水的质量大致为1 g)水,然后分别加入约0.5 g 、1 g 、1.5 g 固体硫酸铜,振荡静置。
比较三种CuSO 4溶液的颜色。
在这三支试管中溶液的组成是否相同?判断溶液浓稀的根据是什么?[学生活动] [交流活动结果] 1.填充上表结果(略)。
2.三种溶液颜色由浅到深,浓度由小到大。
颜色越深,浓度越大。
3.三种溶液所含溶剂质量相同,溶质质量不同,所以组成各不相同。
[引导]浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。
因此需要准确知道溶液的组成。
那如何表明溶液的组成呢?[介绍]表示溶液组成的方法很多,初中主要学习溶质的质量分数。
[板书]一、溶质的质量分数1.定义:溶质的质量与溶液的质量之比。
第九单元溶液课题3 溶液的浓度导学案第1课时[温故知新]1.溶液是由和两个部分组成的物;在碘酒中,是溶质,是溶剂。
[课前导学]1.在三只试管中各加入10mL水,然后分别加入约0.5g、1.0g、1.5g固体硫酸铜。
比较三种硫酸铜溶液的颜色。
分析,在这三支试管中溶液的组成(填“是”或“否”)相同,判断的依据是。
2.溶质的质量分Array数:。
3.配制溶质质量分数一定的溶液的步骤:。
[课堂探索]1.思考:病人在医院挂水时,使用的生理盐水的浓度是多少?能否浓度再大一些或小一些?农业生产上,施用农药时,为什么要准确知道一定量的溶液里含有多少溶质的质量?2.讨论并填空:溶液中溶质的质量分数的定义:。
如:某溶液中溶质的质量分数是a%,则“a%”表示每份质量的该溶液中,含溶质质量份,含水的质量为份。
3.实验与操作:配制溶质质量分数一定的溶液。
(1)计算配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量:氯化钠g,水g。
(2)用托盘天平称量所需的氯化钠,称量时氯化钠应放在托盘天平的盘,砝码应放在托盘天平的盘,称好后倒入烧杯中。
(3)把水的密度近似看作 1 g/cm3。
用量筒量取所需的水,倒入盛有氯化钠的烧杯里,用玻璃棒,使氯化钠溶解。
(4)把配好的溶液装入试剂瓶中,盖好瓶塞并(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
4.典型题例例1.配制150kg质量分数为16%的氯化钠溶液,需要氯化钠和水的质量各是多少?[当堂反馈]1.在农业生产中,有时用质量分数为10%~20%的食盐水来选种。
要配制20kg质量分数为16%的食盐水,所需食盐的质量是()A.2.0kg B.3.2kg C.4.0kg D.32kg2.用食盐晶体配制溶质质量分数一定的食盐水,不需要的仪器是()A.玻璃棒B.试管夹C.药匙D.量筒3.每天补充适量的维生素C,有利于提高人体免疫力。
某维生素C泡腾片,每片含l g维生素C。
将1片该泡腾片投入适量水中,最终得到200 g溶液。
9.3 溶液的浓度导学案1. 引入•现象:我们平时在家中常常使用溶液来完成一些家务活动,比如洗衣、洗碗等等。
为了让洗衣液和洗碗液的效果更好,你们有没有注意到在包装上经常会标有“浓缩”、“高浓度”等字样?•思考:那么,什么是溶液的浓度呢?为什么要使用浓缩的溶液?2. 学习目标•了解溶液的浓度的含义•掌握浓度的计算方法3. 学习重点•溶液的浓度的定义•浓度的计算方法4. 学习内容4.1 溶液的浓度•溶液是由溶质和溶剂组成的。
溶质指的是被溶解的物质,它可以是固体、液体或气体;溶剂指的是用来溶解溶质的物质,通常是液体。
•溶液的浓度是指在一定量的溶液中溶质的质量或溶液中溶质的摩尔数所占的比例。
4.2 浓度的计算方法4.2.1 质量浓度•质量浓度是指在单位体积的溶液中的溶质的质量。
计算公式为:质量浓度 = 溶质质量 / 溶液体积。
•例如:某溶液中溶质的质量为20g,溶液的体积为100mL,那么该溶液的质量浓度为20g / 100mL = 0.2g/mL。
4.2.2 摩尔浓度•摩尔浓度是指在单位体积的溶液中的溶质的摩尔数。
计算公式为:摩尔浓度= 溶质的摩尔数 / 溶液的体积。
•例如:某溶液中溶质的摩尔数为0.5mol,溶液的体积为250mL,那么该溶液的摩尔浓度为0.5mol / 250mL = 2mol/L。
5. 学习要点•溶液是由溶质和溶剂组成的•浓度是指溶质在溶液中所占的比例•浓度的计算方法有质量浓度和摩尔浓度6. 拓展延伸•在生活中,我们经常接触到各种不同浓度的溶液,比如食盐水、饮料等。
为了保证使用的效果和安全性,我们在制作溶液时必须掌握合适的浓度。
•在工业生产中,化学品的浓度也非常重要,不同浓度的化学品在不同的生产过程中具有不同的应用效果,控制和调节浓度可以保证产品的质量和稳定性。
•浓度的计量和控制是化学实验中一个重要的环节,在实验中准确地制备出合适浓度的溶液对于实验结果的准确性和可靠性起着重要的作用。
课题3 溶液的浓度导学案(第一课时)路美邑中学 杨永刚【学习流程】〖情境导入、生成问题〗1.创设情境:投影展示人们在死海里能尽情娱乐的图片引入----2.明确学习目标,解读目标。
〖自主探究、生成能力〗 一、溶质的质量分数 【自主学习】〖活动与探究一〗[实验9-7]在三只试管中各加入10 mL 水,然后分别加入约0.5 g 、1.0 g 、1.5 g 固体硫酸铜。
比较三种硫酸铜溶液的颜色。
分析,在这三支试管中溶[交流讨论1]如何区分溶液的浓稀?[归纳小结] 即溶质的质量分数。
[自主学习]阅读课本第P42,知道表示溶液组成的方法——溶质质量分数。
溶液中的溶质质量分数是 _________________________________________。
表达式: [交流讨论2]1.实验9-5中,三种溶液的溶质质量分数分别是多少?2.表达式的几种变形〖活动与探究二〗[实验9-8]按下表所定的量配制氯化钠溶液(水的密度看作[设问]已知溶质和溶剂的量的溶液,我们会配制了。
那如果告诉你一定量的一定质量分数的溶液,你会配制吗?[交流讨论]欲配制50g 质量分数为6%的氯化钠溶液该如何操作?请你试一试。
【小结】1.配制溶液的步骤: 、 、 、 、 。
2.实验仪器:所需仪器:溶解: ; 。
3.注意事项:【作业布置】课文P45第1题、第2题做在作业本上。
【课堂练习】1.配制90g10%的NaNO 3溶液后,向其中加入10gNaNO 3搅拌至完全溶解,所得溶液中NaNO3质量分数是( )A.19%B.10%C.9%D.无法计算2.把40g5%的CaCl2溶液溶质质量分数增大到10%,应采用的方法是( )A.把溶剂蒸发掉一半B.加入2gCaCl固体2溶液 D.把溶剂蒸发掉20g C.加入40g15%的CaCl2。
课题3 《溶液的浓度》导学案(第一课时)
主备人:武如意班级:九(5)时间:2015年3月17日
一、【学习目标】:1.知道溶液浓度的表示方法——溶质的质量分数。
2.能进行质量分数的简单计算。
二、【自主学习】
【回忆】氯化钠溶液中,溶质是,溶剂是;硫酸铜溶液中,溶质是,溶剂是;稀硫酸中溶质是溶剂是
1、对于有色的溶液,可根据来判断比较溶液的浓稀,但这种方法不能准确地表
明一定量的溶液里究竟含有多少溶质。
2、表示溶液浓度的方法很多,常用表示。
基本概念:溶液中溶质的质量分数是与之比。
计算公式:溶质的质量分数= = 。
公式变形:(1)溶质质量= 。
(2)溶液质量= ÷(或= 质量+ 质量)。
三、【合作探究】
例1.把10g氯化钠放入40g水中,完全溶解后,溶液中氯化钠的质量分数是多少?
例2.生理盐水是质量分数为0.9%的氯化钠溶液,现用1000g生理盐水给某病人输液,进入病人体内的氯化钠质量是多少?
例3.已知60 ℃时硝酸钾的溶解度是110 g,求60 ℃时硝酸钾饱和溶液的溶质的质量分数?
【思考】对于某温度下的饱和溶液,若已知溶解度a g,则该温度下溶液中溶质的质量分数为。
四、【总结梳理】
五、【过关检测】
1、(1)在20℃时,将40g氯化钠放入100g水中,结果有4g固体剩余,求溶液中溶质的质量分数?
2、将20g硝酸钾加入100g水中,硝酸钾全部溶解,求所得溶液中溶质的质量分数。
3、某温度时,蒸干35g氯化钾溶液,得到10g氯化钾,该溶液中溶质的质量分数为。
4、某化学兴趣小组的同学在实验室配制200g质量分数为8%的氢氧化钠溶液。
计算:需要氢氧化钠固体的质量为 g,水的质量为 g
1。