全国通用2018版高考化学考前三个月选择题满分策略第一篇专题三阿伏加德罗常数及应用复习题
- 格式:doc
- 大小:252.00 KB
- 文档页数:15
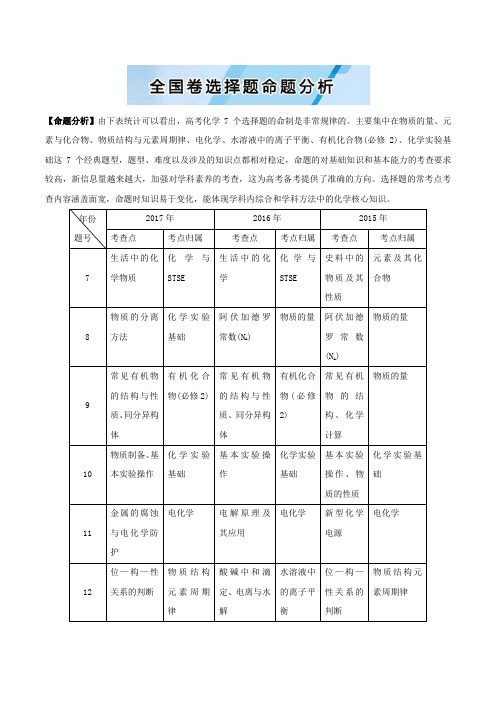
【命题分析】由下表统计可以看出,高考化学7个选择题的命制是非常规律的。
主要集中在物质的量、元素与化合物、物质结构与元素周期律、电化学、水溶液中的离子平衡、有机化合物(必修2)、化学实验基础这7个经典题型,题型、难度以及涉及的知识点都相对稳定,命题的对基础知识和基本能力的考查要求较高,新信息量越来越大,加强对学科素养的考查,这为高考备考提供了准确的方向。
选择题的常考点考查内容涵盖面宽,命题时知识易于变化,能体现学科内综合和学科方法中的化学核心知识。
年份题号2017年2016年2015年考查点考点归属考查点考点归属考查点考点归属7 生活中的化学物质化学与STSE生活中的化学化学与STSE史料中的物质及其性质元素及其化合物8 物质的分离方法化学实验基础阿伏加德罗常数(N A)物质的量阿伏加德罗常数(N A)物质的量9 常见有机物的结构与性质、同分异构体有机化合物(必修2)常见有机物的结构与性质、同分异构体有机化合物(必修2)常见有机物的结构、化学计算物质的量10 物质制备、基本实验操作化学实验基础基本实验操作化学实验基础基本实验操作、物质的性质化学实验基础11 金属的腐蚀与电化学防护电化学电解原理及其应用电化学新型化学电源电化学12 位—构—性关系的判断物质结构元素周期律酸碱中和滴定、电离与水解水溶液中的离子平衡位—构—性关系的判断物质结构元素周期律13弱电解质的电离与盐类的水解、离子浓度大小比较水溶液中的离子平衡位—构—性关系的判断物质结构元素周期律弱电解质的电离水溶液中的离子平衡【题型分析】题型一化学与STSE【解读】化学与生活、化学与科学、科技、社会,环境等STSE知识能充分体现化学特色,试题的命题向深入化、真实情境、最新科技成果等方向发展,充分体现学以致用,淡化死记硬背。
此类题目知识涉及面广,难度不大,复习时注意环境问题、能源问题、材料问题、社会生活问题、传统文化等与基本知识的结合,习惯从化学视角去思考问题。

2018全国卷高考化学知识点2018全国卷高考化学知识点:阿伏加德罗常数(1)条件问题:常温、常压下气体摩尔体积增大,不能使用22.4 L/mol。
(2)状态问题:标准状况时,H2O、N2O4、碳原子数大于4的烃为液态或固态;SO3、P2O5等为固态,不能使用22.4 L/mol。
(3)特殊物质的摩尔质量及微粒数目:如D2O、18O2、H37Cl 等。
(4)某些特定组合物质分子中的原子个数:如Ne、O3、P4等。
(5)某些物质中的化学键数目:如白磷(31 g白磷含1.5 mol P-P键)、金刚石(12 g金刚石含2 mol C-C键)、晶体硅及晶体SiO2(60 g二氧化硅晶体含4 mol Si-O键)、Cn(1 mol Cn含n mol 单键,n/2 mol 双键)等。
(6)某些特殊反应中的电子转移数目:如Na2O2与H2O、CO2的反应(1 mol Na2O2转移1 mol电子;Cl2与H2O、NaOH的反应(1 mol Cl2转移1 mol电子。
若1 mol Cl2作氧化剂,则转移2 mol电子);Cu与硫的反应(1 mol Cu反应转移1 mol电子或1 mol S反应转移2 mol电子)等。
(7)电解质溶液中因微粒的电离或水解造成微粒数目的变化:如强电解质HCl、HNO3等因完全电离,不存在电解质分子;弱电解质CH3COOH、HClO等因部分电离,而使溶液中CH3COOH、HClO浓度减小;Fe3+、Al3+、CO32 、CH3COO 等因发生水解使该种粒子数目减少;Fe3+、Al3+、CO32 等因发生水解反应而使溶液中阳离子或阴离子总数增多等。
(8)由于生成小分子的聚集体(胶体)使溶液中的微粒数减少:如1 mol Fe3+形成Fe(OH)3胶体时,微粒数目少于1 mol。
(9)此外,还应注意由物质的量浓度计算微粒时,是否告知了溶液的体积;计算的是溶质所含分子数,还是溶液中的所有分子(应考虑溶剂水)数;某些微粒的电子数计算时应区分是微粒所含的电子总数还是价电子数,并注意微粒的带电情况(加上所带负电荷总数或减去所带正电荷总数)。


年全国卷高考化学复习专题突破《阿伏加德罗常数》2018一、阿伏加德罗常数相关计算熟记四个基本公式1.VNm1-mol22.4 L·==n(3) =n(2) =cV=n)(4)V,标况下(n(1)mVNM mA ) N·n=N(N→n⇒已知量:基本方法2.A 注意问题3.二、有关阿伏加德罗常数的常见考查角度物质的聚集状态1.、CH、H单质溴、,在标准状况下.物质的聚集状态与所处状况有关ClCCl、苯、HF、O2242以上物质在标准状.为固体CH、;SO均为液体,的烃4CHCl碳原子数大于OH,CHCH、OH33233均不能使用气体摩尔体积迚行计算,况下. 气体摩尔体积的使用条件2.,故在非标准状况下mol;1 气体的物质的量并不是L,22.4 下)如常温、常压(在非标准状况 . 不能用气体摩尔体积计算气体的物质的量物质的组成3. . 物质组成中分子数、原子数或离子数的准确判断是解答这类问题的关键中KO、(O稀有气体、臭氧:(1)高考常涉及的物质有O;(2)Na分子中的原子数)(P、白磷)22243;(3)的阴、阳离子个数比如混合烯烃、环烷烃中碳原子数或氢原.混合气体中原子数的判断 . 子数的判断特殊化学反应中转移电子的数目4. : 高考常涉及的化学反应有或生,的物质的量CO或(与水ONa转移电子的物质的量即为参加反应的,的反应)O(1)Na22222 . 倍2物质的量的O成的2 . 的物质的量Cl转移电子的物质的量即为参加反应的,的反应)或碱(与水(2)Cl22,与变价金属反应时均生成高价态的金属氯化物,Cl的反应S、Cl 与)或铜(变价金属铁(3)22 . 与变价金属反应时生成的是低价态的金属硫化物S而均需要考虑浓度的降低对反,与浓硝酸反应,Cu反应H与浓,Cu与浓盐酸反应SO(4)MnO422 . 从而判断对转移电子数目的影响,应的影响电离、水解对溶液中离子数目的影响5.1-因忽视溶液中某些离子的水解或弱电解质的电离而造成错误的Lmol·1 L 1 如.- 1 L mol;1 1 的物质的量小于COOCH故溶液中,为弱酸COOHCH由于,溶液中COOHCH333122--- 1 mo1. 的物质的量小于CO使溶液中,的水解CO由于,溶液中Na的COLmol·3233 一些物质中化学键的数目6.SiOmol ,1 键H—Cmol 4 中含有mol CH,1 准确判断物质中化学键的数目是解题的关键42苯中不,键P—6 mol P中含有,1 mol P键Si—2 mol Si晶体硅含,1 mol键O—4 mol Si中含有4 .含碳碳双键 1常见的可逆反应或隐含反应7.N⇋ . 、合成氨的反应等2NO 如,仸何可逆反应都不能迚行到底O422特殊物质的摩尔质量或分子中的微粒数8.关注特殊物质的摩尔质量及分子中所含的中子数、质子数是破解这类问题的关键D如.、O211--mol22 g·、12. 、10所含中子数分别为,mol20 g·的摩尔质量分别为OT2物质的存在形态9.-+Na和HCO晶体中只含有NaHCO如,离子的种类、数目不同,注意物质的存在形态不同,332---H的水解产生少量CO的电离产生少量HCO而溶液中还会因为 mol ,1 COHCO由于,32333溶于水电离出离1 mol NaHSO而2 mol,晶体在熔融状态下存在的离子的物质的量为NaHSO44 3 mol. 子的物质的量为真题练习 ) (下列有关叙述正确的.为阿伏加德罗常数值N设 1.A N2乙烯和丙烯混合气体中的氢原子数为14 g.A A N2分子数为NH反应生成的4 mol H与 1 mol N.B322A N2电子转移数为,溶于过量硝酸1 mol Fe.C A N0.4含有的共价键数为 ,2.24 L CCl.标准状况下D4A ) (下列说法正确的是.为阿伏加德罗常数的值N2.A N10中含有的质子数均为O18 g H和O18 g D.A A221+-N2离子数为H亚硫酸溶液中含有的L2 L 0.5 mol·.B A N0.2氧气转移的电子数为0.1 mol生成,.过氧化钠与水反应时C A N2产物的分子数为,充分反应与2 mol NO.密闭容器中D 1 mol O A2 ) (下列叙述正确的是.代表阿伏加德罗常数的值N3.A.A N10丙醇中存在的共价键总数为60 g A12---N0.1离子数之和为CO和HCO溶液中NaHCO的 L1 L 0.1 mol·.B33A3 N1钠充分燃烧时转移电子数为.23 g.钠在空气中燃烧可生成多种氧化物C A裂变11136123590235n)(净产生的中子n,10+Xe+Srn+U収生裂变反应:U核素g235 .D38092 92 0054 N10数为A ) (下列叙述正确.为阿伏加德罗常数的值N4.01-N2水溶液中含有的氧原子数为NaAlO的L1.0 L 1.0 mol·.A02)单层石墨(石墨烯12 g.B N0.5中含有六元环的个数为0-N0.1的数目为OH溶液中含有NaOH的13=pH 时℃25 .C 0 N9的氢氧根离子所含电子数均为1 mol的羟基与1 mol.D0阿伏加德罗常数的应用 1热点题型 ) (下列说法正确的是,为阿伏加德罗常数的数值N1.A N10所含电子数为 ,28 gN.常温常压下A A2N2钠充分燃烧时转移电子数为46 g.B A1--N0.1数为 Cl溶液中Cl NHL0.1 mol·.C A4N2产物的分子数为,充分反应1 mol O与.密闭容器中D 2 mol SO A22 ) (下列说法正确的是,是阿伏加德罗常数的数值N设2.A1+-N2的数目为K溶液中含有 SO KL1 mol·.A A42 N0.3键数目为Cl—C中含有的)(CHCl氯仿,2.24 L.标准状况下B A310重水中所含有的中子数为18 g.C N A N的混合物时转移电子数为Na在一定条件下反应生成 ONa和OO与1 mol Na.D A2222 ) (下列说法正确的是.为阿伏加德罗常数的值N3.A N0.5苯含有的分子数为,11.2 L.标准状况下A A N0.4含有的化学键数为.B 3.2 g CH A4N转移的电子数为,充分反应1 mol Na与O.足量的C A2-N0.2数目为OH 溶液中含有的.D Ba(OH)的,1.0 L 0.2 mol/L时℃25 A2 ) (下列说法正确的是.为阿伏加德罗常数的值N)四川高考 4.(2016·A N0.1转移的电子数为,中燃烧 O在足量2.4 g Mg.A A2 2N0.5气体中含有的氧原子数为 ,5.6 L CO.标准状况下B A2CH的N0.4键数为σ分子中含有的OHN0.4.氢原子数为C3AA+N0.05数为 H溶液中含有的COOH0.1 L 0.5 mol/L CH.D A3 ) (下列说法中正确的是,表示阿伏加德罗常数的值N设5.A N3的混合气体中含有的原子数为N和O46 g NO①A422N0.25中含有的分子数为 ,5.6 L SO标准状况下②3A-N0.01的数目为 OH溶液中由水电离出1.0 L NaClO的12=,pH时℃25 ③A21--N0.1数目小于CO溶液中含有的0.1 mol·④ CO NaL A332N2与水完全反应时转移电子数为O1 mol Na⑤22A①③.B ④⑤.A ①②③.D ②④.C2热点题型以物质的量为中心的计算将甲醛.其结构式如图所示,乌洛托品在合成、医药、染料等工业中有广泛用途1.则甲醛与,若原料完全反应生成乌洛托品.水溶液与氨水混合蒸収可制得乌洛托品) (氨的物质的量之比应为1.A3 ∶2.B 1 ∶ 1 ∶2.D 2 ∶3.C胞嘧啶是2.巯基甲脲嘧啶、浓5-胞嘧啶可由.是精细化工的重要中间体,水解产物之一DNA ) (巯基甲脲嘧啶的物质的量之比为5-和NH则反应时,氨水和氯乙酸在一定条件下合成3 1.A3 ∶2.B 1 ∶ 1 ∶2.D 1 ∶3.C1-的稀硝酸恰好使混合物完全溶L250 mL 4 mol·混合物中加入向质量为3.OFe、Fe的30 g32KSCN所得溶液中再滴加L,)2.24 标准状况NO(放出,解若用与上述混合物.无红色出现,溶液得到的气体在标准状况下的体积为,中铁元素质量相等的铁屑和足量的稀硫酸充分反应) ( 10.08 L .B 15.12 L .A 2.24 L .C3.36 L .D 的混合气NO、N、ONO得到硝酸盐溶液和,一定质量的镁、铝合金与硝酸恰好完全反应4.422 3.36 将这些气体与标准状况下,体所有气体恰好完全被水吸收生成硝,混合后通入水中OL 2向滤,将沉淀滤出,溶液至沉淀最多时停止加入NaOHmol/L 2 若向所得硝酸盐溶液中加入.酸 (此时所得溶液的物质的量浓度为500 mL,液中加水稀释至) 1 mol/L .B 0.5 mol/L .A 2 mol/L .D 1.2 mol/L .C物质的量计算中三个守恒BDCBBCABCBACC :答案 3。

专题03 阿伏加德罗常数1.【2016年高考海南卷】利用太阳能分解制氢,若光解0.02 mol水,下列说法正确的是()A.可生成H2的质量为0.02gB.可生成氢的原子数为2.408×1023个C.可生成H2的体积为0.224L(标准情况)D.生成H2的量理论上等于0.04mol Na与水反应产生H2的量【答案】D【解析】根据方程式2H2O===2H2↑+O2↑,光解0.02 mol水,可产生0.02 mol H2和0.01 molO2。
则可知,A项,可生成H2的质量为0.04g,错误;B项,可生成氢的原子数为2.408×1022个,错误;C项,可生成标准状况下H2的体积为0.448L,错误;D项,0.04mol Na与水反应产生0.02 mol H2,正确,答案选D。
【考点定位】考查水的分解及简单方程式的计算。
【名师点睛】本类题的解题策略:(1)掌握基本概念,找出各化学量之间的关系;(2)加强与原子结构、元素化合物性质、有机物结构性质等相关知识的横向联系;(3)找出解题的突破口,在常规解法和计算技巧中灵活选用。
顺利解答该类题目的关键是:一方面要仔细审题,注意关键字词,熟悉常见的“陷阱”;另一方面是要把各种量转化为物质的量,以此为中心进行计算。
2.【2016年高考江苏卷】下列说法正确的是()A.氢氧燃料电池工作时,H2在负极上失去电子B.0.1mol/LNa2CO3溶液加热后,溶液的pH减小C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个D.室温下,稀释0.1mol/LCH3COOH溶液,溶液的导电能力增强【答案】A【解析】A、氢氧燃料电池工作时,H2发生氧化反应,在负极上失去电子,A正确;B、升高温度,促进碳酸钠的水解,溶液的pH增大,B错误;C、常温常压下,气体的摩尔体积大于22.4L/mol,22.4LCl2中的物质的量小于1mol,含有的分子数小于6.02×1023个,C错误;D、室温下,稀释稀醋酸,虽然电离平衡正向移动,自由移动离子的数目增加,但溶液体积的增大起主导作用,自由移动离子的浓度减小,溶液的导电能力减弱,D错误。

2018高考复习专题一 阿伏加德罗常数的解题技巧【高考动向】以阿伏加德罗常数N A 为载体考查物质状态、分子组成、盐类水解、弱电解质电离、化 学平衡、胶体制备、晶体结构、氧化还原反应等基本概念、基本理论、元素化合物等多方面的知识。
从高考试题看,此类题目多为选择题,且题型、题量保持稳定,命题的形式也都是已知阿伏加德罗常数为N A ,判断和计算一定量的物质所含离子数的多少。
此类试题在注意有关计算关系考查的同时,又隐含对概念的理解的考查。
试题难度不大,概念性强,覆盖面广,区分度好,预计今后会继续保持。
【夯实基础】一、阿伏加德罗常数含义:0.012kg 12C 含有的碳原子数就是阿伏加德罗常数。
1mol 任何物质均含有阿伏加德罗常数个特定微粒或微粒组合。
受客观条件的限制,目前科学界还不能测出阿伏加德罗常数的准确值,通常使用6.02×1023 mol -1这个近似值。
也就是说,1 mol 任何粒子的粒子数约为6.02×1023,如1 mol氧原子中约含有6.02×1023个氧原子。
阿伏加德罗常数与6.02×1023 mol -1是常数与近似值的关系,不能将阿伏加德罗常数与6.02×1023 mol -1等同,就像不能将π与3.14等同一样。
二、阿伏加德罗定律再认识阿伏加德罗定律是同温同压下,相同体积的任何气体都含有相同数目的分子。
关于阿伏加德罗定律要明确三点:(1)使用范围:气体;(2)三个“同”条件下,分子数才能相同;(3)气体的摩尔体积是阿伏加德罗定律的特例。
(4)其推论可用公式进行判断 ①pV =nRT ②pM =ρRT(5)应用气体摩尔体积时的三个注意问题Vm =22.4 L·mol -1,使用时一定注意以下几个方面:一个条件:标准状况;一个对象:只限于气体,可以是单一气体,也可以是混合气体;二个数据:“1 mol”、“约22.4 L”。
有关物质的量的概念、应用以及物质的量浓度的计算仍然是高考高频考点,题型以选择题为主,难度适中。
非选择题多以溶液的配制、实验为载体考查化学实验基本操作、溶液浓度的测定、数据处理方法和化学实验中的定量分析能力。
考点应用规律性强,能提升综合解题能力。
该部分知识的前后关联性极强,应用广泛,尤其是条件性、规律性、结论性的数据快速处理运用,仍为命题的主要方向。
预计2018年有关阿伏加德罗常数的综合应用及气体摩尔体积的考查仍会延续选择题的形式,要注意与氧化还原反应、水解原理、物质结构等知识点的结合,而以物质的量为中心的计算更多体现在它的工具性上。
【例题1】阿伏加德罗常数的值为N A。
下列说法正确的是L NH4Cl溶液中,NH4+的数量为0.1N AA.1 L 0.1 mol·1B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2N AD.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2N A【答案】D【解析】A、NH4+是弱碱根离子,发生水解:NH4++H2O NH3·H2O+H+,因此NH4+数量小于0.1N A,故A错误;B、2.4 g Mg为0.1 mol,与硫酸完全反应后转移的电子的物质的量为2.4×2÷24 mol=0.2 mol,因此转移电子数为为0.2N A,故B错误;C、N2和O2都是分子组成,标准状况下,2.24 L任何气体所含有的分子数都为0.1N A,故C错误;D、H2+I22HI,反应前后系数之和相等,即反应后分子总物质的量仍为0.2 mol,分子数为0.2N A,故D正确。
【名师点睛】本题考查阿伏加德罗常数的应用,是高考的一个热点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。
【母题来源】2018年高考新课标1卷【母题题文】N A是阿伏加德罗常数的值,下列说法正确的是A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 N AB.22.4 L(标准状况)氩气含有的质子数为18 N AC.92.0 g甘油(丙三醇)中含有羟基数为1.0 N AD.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0 N A【答案】B【试题解析】A、16.25g氯化铁的物质的量是16.25g÷162.5g/mol=0.1mol,由于氢氧化铁胶体是分子的集合体,因此水解生成的Fe(OH)3胶体粒子数小于0.1 N A,A错误;B、标准状况下22.4L氩气的物质的量是1mol,氩气是一个Ar原子组成的单质,其中含有的质子数是18 N A,B正确;C、1分子丙三醇含有3个羟基,92.0g丙三醇的物质的量是1mol,其中含有羟基数是3 N A,C错误;D、甲烷与氯气在光照条件下发生取代反应生成的卤代烃不止一种,因此生成的CH3Cl分子数小于1.0 N A,D错误。
答案选B。
【命题意图】本题主要是考查阿伏加德罗常数的有关计算,涉及盐类水解、质子数目计算、化学键数目计算以及甲烷的取代反应计算等。
【命题方向】阿伏加德罗常数是历年高考的“热点”问题。
多年来全国高考化学试题重现率几乎为100%。
考查阿伏加德罗常数的应用的题目,为高考必考题目,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容。
以阿伏加德罗常数为载体,考查物质的量相互转化关系,通常涉及物质结构、氧化还原反应、离子反应、电解质溶液等相关知识。
有关物质的量的概念、应用以及物质的量浓度的计算仍然是高考高频考点,题型以选择题为主,难度适中。
非选择题多以溶液的配制、实验为载体考查化学实验基本操作、溶液浓度的测定、数据处理方法和化学实验中的定量分析能力。
2018年普通高等学校招生全国统一考试考前押题密卷【新课标Ⅰ卷化学部分】含答案8、N A为阿伏加德罗常数的数值,下列说法正确的是()A.7.2 g CaO2晶体中阴离子和阳离子总数为0.3 N AB.0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1 N A C.反应3H2(g)+N2(g) 2NH3(g)ΔH=-92kJ/mol放出热量9.2 kJ时,转移电子0.6 N AD.0.1 mol H2O2分子中含极性共价键数目为0.3 N A9、乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是()①1mol该有机物可消耗3mol H2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1 mol该有机物水解时只能消耗1 mol NaOHA.②③④B.①④⑤C.①②③ D.②③⑤10、利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
下列说法不正确...的是()A.电流从右侧电极经过负载后流向左侧电极B.电极A极反应式为:2NH3-6e-=N2+6H+C.为使电池持续放电,离子交换膜需选用阴离子交换膜D.当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol11.利用如图所示装置进行相关实验能实现目标的是()A .若I 中装过量高锰酸钾溶液,Ⅱ中装澄清石灰水,则能检验SO 2中是否混有CO 2B .若I 中装足量饱和碳酸钠溶液,Ⅱ中装浓硫酸,则能除去CO 2中混有的HClC .若I 中装BaCl 2溶液,Ⅱ中装水,则能证明SO 2和NO 2混合气体中SO 2不与BaCl 2反应D .若I 中装足量澄清石灰水,Ⅱ中装浓硫酸,则能测定CO 2和水蒸气的混合气体中水蒸气的含量 12 .W 、X 、Y 、Z 是原子序数依次增大的短周期主族元素,W 是地壳中含量最多的元素,X 和Z 原子最外层电子数相同,Z 的原子半径是同周期主族元素中最小的,Y 原子的核电荷数是周期数的4倍。
阿伏伽德罗常数高考真题---2019(海南)9.N A 为阿伏加德罗常数的值。
下列叙述错误的是( )A .1 mol 乙烯分子中含有的碳氢键数为4N A C .1 L 0.1 mol·L −1的乙酸溶液中含H +的数量为0.1N AB .1 mol 甲烷完全燃烧转移的电子数为8N A D .1 mol 的CO 和N 2混合气体中含有的质子数为14N A (全国II )8.阿伏加德罗常数的值为N A 。
下列说法正确的是( )A.1L0.1mol·L −1NH 4Cl 溶液中,NH 4+的数量为0.1N AB.2.4gMg 与H 2SO 4完全反应,转移的电子数为0.1N AC.标准状况下,2.24LN 2和O 2的混合气体中分子数为0.2N AD.0.1mol H 2和0.1mol I 2于密闭容器中充分反应后,其分子总数为0.2N A(全国III )10.N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .0.1 mol 的11B 中,含有0.6N A 个中子B .pH=1的H 3PO 4溶液中,含有0.1N A 个H +C .2.24 L (标准状况)苯在O 2中完全燃烧,得到0.6N A 个CO 2分子D .密闭容器中1 mol PCl 3与1 mol Cl 2反应制备 PCl 5(g ),增加2N A 个P-Cl 键 答案:C 、D 、A2019(四川)4. N A 为阿伏伽德罗常数的值。
下列说法正确的是( )A .2.4g 镁在足量的氧气中燃烧,转移的电子数为0.1N AB .标准状况下,5.6L 二氧化碳气体中含有的氧原子数为0.5N AC .氢原子数为0.4N A 的甲醇分子中含有的σ键数为0.4N AD .0.1L0.5mol/LCH 3COOH 溶液中含有的氢离子数为0.05N A(全国I )8.设N A 为阿伏加德罗常数值。
下列有关叙述正确的是( )A .14 g 乙烯和丙烯混合气体中的氢原子数为2N AB .1 molN 2与4 mol H 2反应生成的NH 3分子数为2N AC .1 molFe 溶于过量硝酸,电子转移数为2N AD .标准状况下,2.24 LCCl 4含有的共价键数为0.4N A (海南)9.利用太阳能分解水制氢,若光解0.02 mol 水,下列说法正确的是( )A .可生成H 2的质量为0.02gB .可生成氢的原子数为2.408×1023个C .可生成H 2的体积为0.224L (标准情况)D .生成H 2的量理论上等于0.04mol Na 与水反应产生H 2的量 答案:B 、A 、D2019(广东)10.(4分)设N A 为阿伏加德罗常数的数值,下列说法正确的是( )A. 23gNa 与足量H 2O 反应完全后可生成N A 个H 2分子B. 1molCu 和足量热浓硫酸反应可生成N A 个SO 3分子C. 标准状况下,22.4LN 2和H 2混合气中含N A 个原子D. 3mol 单质Fe 完全转化为Fe 3O 4,失去8N A 个电子 (海南)10.下列指定微粒的数目相等的是( )A .等物质的量的水与重水含有的中子数B .等质量的乙烯和丙烯中含有的共用电子对数C .同温、同压、同体积的CO 和NO 含有的质子数D .等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数(四川)5.设N A 为阿伏加德罗常数,下列说法正确的是( )A.2.0gH 218O 与D 2O 的混合物中所含中子数为N AB.常温常压下4.4g 乙醛所含δ键数目为0.7N AC.标准状况下,5.6LCO 2与足量Na 2O 2反应转移电子数为0.5N AD.50mL12mol/l 盐酸与足量MnO 2共热,转移的电子数为0.3N A(全国II )10.N A 代表阿伏加德罗常数的值。
选择题满分策略第一篇专题三阿伏加德罗常数及应用复习题1.(2017·全国卷Ⅱ,8)阿伏加德罗常数的值为N A。
下列说法正确的是( )A.1 L 0.1 mol·L-1NH4Cl溶液中,NH+4的数量为0.1N AB.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1N AC.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2N AD.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2N A答案 D解析A项,因铵根离子水解,其数量小于0.1N A,错误;B项,2.4 g Mg为0.1 mol,与硫酸完全反应后转移的电子为0.2N A,错误;C项,标准状况下,2.24 L任何气体所含有的分子数都为0.1N A,错误;D项,H2(g)+I2(g) 2HI(g),反应前后气体物质的量不变,正确。
2.(2017·全国卷Ⅲ,10)N A为阿伏加德罗常数的值。
下列说法正确的是( )A.0.1 mol的11B中,含有0.6N A个中子B.pH=1的H3PO4溶液中,含有0.1N A个H+C.2.24 L(标准状况)苯在O2中完全燃烧,得到0.6N A个CO2分子D.密闭容器中1 mol PCl3与1 mol Cl2反应制备PCl5(g),增加2N A个P—Cl键答案 A解析A项,硼原子的质子数为5,11B的中子数为6,故 0.1 mol的11B中含有中子数为0.6N A,正确;B项,未指明溶液体积,无法计算H+的物质的量,错误;C项,标准状况下苯为液体,不能用气体摩尔体积计算苯燃烧生成的CO2分子数,错误;D项,PCl3+Cl2 PCl5,这是一个可逆反应,1mol PCl3与1mol Cl2不可能完全反应生成1 mol PCl5,故增加的P—Cl键数目小于2N A,错误。
3.(2016·全国卷Ⅰ,8)设N A为阿伏加德罗常数值。
下列有关叙述正确的是( )A.14 g乙烯和丙烯混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1 mol Fe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A答案 A解析A项,乙烯和丙烯的最简式均为CH2,14 g乙烯和丙烯混合气体中相当于含有1 mol CH2,则其氢原子数为2N A,正确;B项,合成氨的反应是可逆反应,则1 mol N2与4 mol H2反应生成的NH3分子数小于2N A,错误;C项,铁和过量硝酸反应生成硝酸铁,故1 mol Fe 溶于过量硝酸,电子转移数为3N A,错误;D项,标准状况下CCl4为液态,故2.24 L CCl4的物质的量不是0.1 mol,则其含有的共价键数不是0.4N A,错误。
角度一一定量物质中微粒(共价键)数目的判断1.宏观量(m、V)与微粒数的换算公式物质所含微粒(分子、原子、离子、质子、中子和电子等)数目的计算公式为N=n·N A,因此确定微粒数目(N)的前提是确定目标微粒的物质的量(n),以物质的量为中心的化学计量间的换算关系如下:[说明] ①物质的量、质量、微粒数目的多少均与温度、压强无关。
②物质的量浓度的大小与所取溶液的体积无关。
2.熟悉每摩常考物质中指定微粒(共价键)数目(1)求微粒数目(2)求共价键数3.判断混合物中指定微粒数目的常用技巧——求同存异例 用N A 表示阿伏加德罗常数的值,下列叙述正确的是( ) A .1 mol 的羟基与1 mol 的氢氧根离子所含电子数均为9N A B .12 g 石墨和C 60的混合物中质子总数为6N A C .84 g NaHCO 3晶体中含有N A 个CO 2-3D .标准状况下,0.1 mol 己烷中共价键数目为19N A解析A项,OH-为10电子微粒,A错误;B项,石墨和C60均是由碳原子构成,12 g混合物碳的物质的量为 1 mol,则混合物中质子总数为6N A,B正确;C项,碳酸氢钠晶体中不含CO2-3,C错误;D项,1个己烷中含有5个碳碳键,14个碳氢键,则0.1 mol己烷中共价键数目为1.9N A,D错误。
答案 B1.用N A表示阿伏加德罗常数的值,下列说法不正确的是( )A.1 mol F2和Ar所含质子数均为18N AB.标准状况下,2.24 L甲烷和氨气的混合气,所含电子数是N AC.14 g C n H2n中含有的碳原子数目为N AD.标准状况下,22.4 L空气中含有N A个单质分子答案 D解析甲烷、氨气都是10电子化合物,空气中还含有二氧化碳等气体化合物。
2.设N A为阿伏加德罗常数的值,下列叙述不正确的是( )A.20 g D2O中所含的电子数为10N AB.60 g SiO2晶体中含有Si—O键的数目为2N AC.0.2 mol金属钠与足量的O2反应,产物中离子数为0.3N AD.1 mol OD-中含有的质子、中子数均为9N A答案 B解析重水(D2O)的相对分子质量为20;SiO2晶体中每个硅原子与4个O原子形成共价键,60 g SiO2含有“Si—O”键的数目为4N A,B项错误;C项中无论是生成氧化钠(Na2O),还是过氧化钠(Na2O2),每摩尔物质都含3 mol离子。
3.设N A为阿伏加德罗常数的值,则下列说法不正确的是( )A.3.0 g甲醛和甲酸甲酯的混合物中含有的原子数为4N AB.8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1N AC.常温常压下,1.6 g O2和O3的混合气体中所含电子数为0.8N AD.常温下,4.4 g CO2和N2O混合物中含有的原子数为0.3N A答案 A解析A项中,两物质的最简式都是“CH2O”,含原子数应为0.4N A;B项中,Cu2S的相对分子质量为CuO的2倍;C项,直接计算氧原子的物质的量即可;D项,CO2和N2O的相对分子质量相等,且含原子数相同。
[新题预测]4.设N A为阿伏加德罗常数的值。
下列叙述正确的是( )A .100 g 含氢元素质量分数为12%的乙烯与乙醛的混合气体中氧原子数为N AB .0.1 mol Cl 2与过量稀NaOH 溶液反应,转移电子的数目为0.2N AC .常温下,1 L 0.1 mol·L -1Na 2SO 3溶液中SO 2-3的数目一定等于0.1N A D .标准状况下,22.4 L CHCl 3中含有氯原子数目为3N A 答案 A解析 乙烯和乙醛的分子式分别为C 2H 4、C 2H 4O ,因此混合气体中氢元素和碳元素的质量之比为1∶6,故碳元素的质量分数为72%,则氧元素的质量分数为1-72%-12%=16%,100 g 该混合气体中氧元素的质量为16 g ,氧原子数为N A ,A 项正确;Cl 2与NaOH 溶液反应生成NaCl 、NaClO 和H 2O,0.1 mol Cl 2与过量稀NaOH 溶液反应,转移电子的数目为0.1N A ,B 项错误;Na 2SO 3溶液中SO 2-3会发生水解,1 L 0.1 mol·L -1Na 2SO 3溶液中c (SO 2-3)<0.1 mol·L -1,C 项错误;标准状况下,CHCl 3为液体,22.4 L CHCl 3的物质的量不是1 mol ,D 项错误。
5.用N A 表示阿伏加德罗常数的值,下列有关说法中正确的是( )答案 C解析 A 项缺体积无法计算;B 项为可逆反应;C 项中相同物质的量的乙烯、乙醇的耗氧量相同;D 项3517Cl 中含有18个中子。
角度二 阿伏加德罗常数的综合考查1.常考电子转移数目的判断总结2.常考陷阱总结例 NA 为阿伏加德罗常数的值。
下列说法正确的是( ) A .1 mol I -被氧化为I 2时失去电子数为2N AB .2 L 0.5 mol·L -1亚硫酸溶液中含有的H +的数目为2N AC .过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2N AD .密闭容器中2 mol NO 与1 mol O 2充分反应,产物的分子数为2N A [解题思路]分析目标微粒→注意特殊条件或特殊反应(如:气体、标准状况、可逆反应等) →应用已知量确定目标量→判断选项解析 A 项,1 mol I -只能失去1 mol e -,生成0.5 mol I 2;B 项,H 2SO 3是弱酸,不可能完全电离;C 项,Na 2O 2与水反应时,生成氧气的变化是2O -1―→O 02,因而生成1 mol O 2转移2 mol e -,故C 项正确;D 项,在通常情况下,生成的NO 2还存在平衡2NO 2 N 2O 4。
答案 C1.用N A 表示阿伏加德罗常数的值,下列说法正确的是( ) A .密闭容器中46 g NO 2含有的分子数为N A B .1 mol·L -1碳酸钠溶液中Na +的数目是2N AC .0.1 mol AlCl 3完全水解转化为氢氧化铝胶体,生成0.1N A 个胶粒D .V L a mol·L -1的氯化铁溶液中,若Fe 3+的数目为 6.02×1023,则Cl -的数目大于3×6.02×1023答案 D解析 A 项,在常温下存在2NO 2 N 2O 4的转化,因而分子数小于N A ,故A 错误;B 项,缺少溶液的体积,无法确定1 mol·L -1碳酸钠溶液中Na +的数目,故B 错误;C 项,一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故0.1 mol 氯化铝所形成的胶粒的个数小于0.1N A 个,故C 错误;D 项,铁离子是弱碱阳离子,在溶液中会水解,故当铁离子为1 mol 时,则溶液中的氯离子大于3 mol 即3N A 个,故D 正确。
2.用N A 表示阿伏加德罗常数的值。
下列有关叙述正确的是( ) A .0.5 mol Fe 2+被足量的H 2O 2溶液氧化,转移0.5N A 个电子B .用双氧水分解制取0.1 mol 氧气,转移的电子总数为0.4×6.02×1023C .1 mol 铁粉在1 mol 氯气中充分燃烧,失去的电子数为3N AD .高温下,16.8 g Fe 与足量水蒸气完全反应失去0.9N A 个电子 答案 A解析 A 项,Fe 2+被足量的H 2O 2溶液氧化为Fe 3+,故0.5 mol Fe 2+被足量的H 2O 2溶液氧化,转移0.5N A 个电子,正确;B 项,用双氧水分解制氧气,氧元素的价态由-1价变为0价,故当生成0.1 mol 氧气时,转移0.2 mol 电子即0.2N A 个,错误;C 项,1 mol 氯气与1 mol 铁粉反应,氯气不足,完全反应只能转移2 mol 电子,错误;D 项,n =m M ,n (Fe)=16.8 g 56 g·mol-1=0.3 mol ,结合铁和水蒸气反应生成四氧化三铁和氢气计算电子转移数,3Fe ~Fe 3O 4~8e -,则Fe 与足量水蒸气完全反应失去0.8N A 个电子,错误。