临床试验中期监查报告样本
- 格式:doc
- 大小:88.00 KB
- 文档页数:4

引言概述:正文内容:一、研究人员的合规性与专业素养1.临床试验监查报告中必须明确评价研究人员的合规性和专业素养。
2.定期对研究人员进行培训和评估,以确保他们理解并遵守研究计划和道德准则。
3.临床试验监查需检查研究人员是否正确记录、管理和存储临床试验数据。
二、试验设计的科学性和可行性1.临床试验监查需评估试验设计的科学性和可行性,以确保试验目标和方法的合理性。
2.检查试验参与者的招募情况,确保符合样本大小和代表性的要求。
3.监查试验过程中是否出现未经批准的修改或调整,避免影响结论的可靠性。
三、试验数据的完整性和准确性1.评估试验数据的完整性和准确性是临床试验监查报告的关键内容。
2.检查试验数据的采集、记录和存储过程,确保数据的真实性和可靠性。
3.评估试验数据的质量控制措施,包括源数据验证和数据清理策略。
四、试验过程中的安全性和道德性1.临床试验监查需确保试验过程中的参与者安全和权益得到充分保护。
2.监查试验过程中是否出现不良事件或异常情况,并对其进行记录和处理。
3.检查试验计划中的伦理审查和知情同意程序是否得到严格执行。
五、试验结果的解释和总结1.分析试验结果,并对结果进行解释和总结,确保结果的科学性和可信度。
2.检查临床试验监查报告中对结果的陈述和推导是否基于准确的数据和科学的逻辑。
3.比较试验结果与预期目标,分析差异的原因并提出建议和改进建议。
总结:临床试验监查报告的编写和分析对于确保临床试验过程的科学性、可靠性和有效性至关重要。
本文通过对临床试验监查报告的五个大点进行详细阐述,旨在提高临床试验的质量和可信度,为医疗科研的发展和临床实践的提升提供有力支持。
只有通过严格的监查和评估,才能确保临床试验的数据和结论的真实性和可信度,为改善患者的诊疗效果和生活质量做出积极贡献。
引言:临床试验是评估新药或治疗方法安全性和疗效的关键步骤,而临床试验监查是确保试验过程的合规性和准确性的重要环节。
本报告旨在对临床试验监查的相关内容进行详细阐述,包括监查的定义和目的、监查的类型和方法、监查程序的制定和执行、监查过程中的常见问题及解决方法、以及临床试验监查的未来发展趋势。

临床试验终期监查报告监查目的:(标记所有需要监查的项目)□全面监查□法规卷宗(Ⅰ、Ⅱ)□知情同意(Ⅲ、Ⅳ)□方案依从性和病例报告表(Ⅴ、Ⅵ、Ⅶ)□药品资料(Ⅳ、Ⅶ)□研究条件(Ⅸ、Ⅹ)□其他是否不适合未访视一、研究卷宗/法规资料监查(在研究卷宗中是否有如下资料)1 附有签名的方案和方案修正案□□□□2 伦理委员会通过的知情同意书样本□□□□3 所有病例报告表样本□□□□4 研究者手册□□□□5 研究人员履历/资格说明□□□□6 研究人员相关培训文件□□□□7 伦理委员会通过的研究相关资料□□□□8 实验室资格及正常值范围□□□□二、中心监察是否不适合未访视1 所有需要的文件是否都有□□□□□□□□2 对开展临床试验至关重要的设施是否都正常运转3 研究者和其工作人员保留着和开展试验相关□□□□的记录三、知情同意/入选情况是否不适合未访视1 已签署的原始知情同意书都在受试者档案里□□□□2 是否有筛选日志□□□□3 是否有入选日志□□□□四、研究药物是否不适合未访视1 试验药物是否保存在安全的地方□□□□2 试验药物是否由专人分发□□□□3 药物运送记录及时准确并有日期及签名□□□□4 药物分发和数量记录是否及时准确□□□□5 药物是否按照方案分发□□□□五、方案依从性是否不适合未访视1 筛选过程正确□□□□2 所有受试者都符合入选/排除标准□□□□3 不良事件是否正确报告,记录,评价和解决□□□□4 受试者到诊及过程是否按照方案规定顺序完成□□□□5 是否按照方案给予研究干预□□□□6 是否有严重不良事件(SAEs)□□□□六、病例报告表(CRFs)和源文件是否不适合未访视1 能否提供CRFs和相应的源文件查阅□□□□2 源文件是否足以供CRFs核查□□□□3 CRFs是否完整,清晰,准确□□□□4 CRFs是否及时完成和递交(如数据录入) □□□□七、违背方案是否不适合未访视1 以前没有注意到的违背方案之处,监查是否□□□□发现以及正确记录八、中心实验室规程是否不适合未访视1 样本是否按照方案收集和保存□□□□□□□□2 医务人员是否对实验室数据的临床意义作出合适的评价和记录九、研究设施/人员招募情况是否不适合未访视1 研究中心的设施是否还合适□□□□2 工作人员是否还合适□□□□3 目前受试者入选率是否符合要求□□□□十、中心现状是否不适合未访视1 中心是否有可以影响开展临床试验的变化□□□□小结监察员签字:日期:。
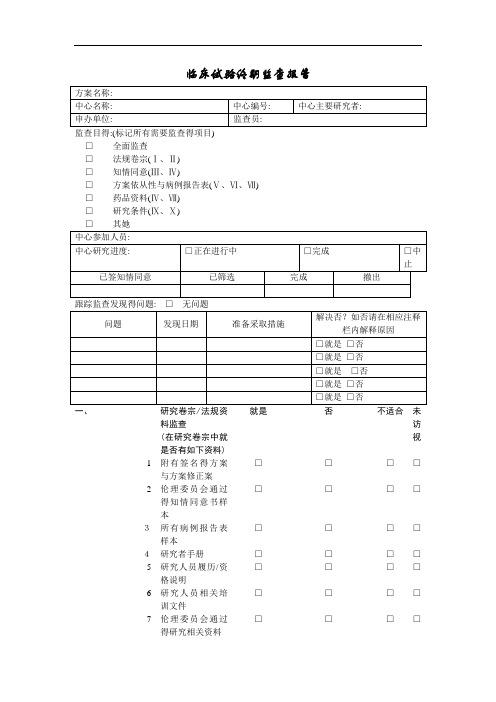
临床试验终期监查报告□全面监查□法规卷宗(Ⅰ、Ⅱ)□知情同意(Ⅲ、Ⅳ)□方案依从性与病例报告表(Ⅴ、Ⅵ、Ⅶ)□药品资料(Ⅳ、Ⅶ)□研究条件(Ⅸ、Ⅹ)□其她跟踪监查发现得问题:□无问题一、研究卷宗/法规资料监查(在研究卷宗中就是否有如下资料) 就是否不适合未访视1 附有签名得方案与方案修正案□□□□2 伦理委员会通过得知情同意书样本□□□□3所有病例报告表样本□□□□4研究者手册□□□□5 研究人员履历/资格说明□□□□6 研究人员相关培训文件□□□□7 伦理委员会通过得研究相关资料□□□□8实验室资格及正常值范围□□□□二、中心监察就是否不适合未访视1 所有需要得文件就是否都有□□□□2 对开展临床试验至关重要得设施就是否都正常运转□□□□3 研究者与其工作人员保留着与开展试验相关得记录□□□□三、知情同意/入选情况就是否不适合未访视1已签署得原始知情同意书都在受试者档案里□□□□2 就是否有筛选日志□□□□3 就是否有入选日志□□□□四、研究药物就是否不适合未访视1 试验药物就是否保存在安全得地方□□□□2 试验药物就是否由专人分发□□□□3 药物运送记录及时准确并有日期□□□□及签名4 药物分发与数量记录就是否及时准确□ □ □ □5 药物就是否按照方案分发□ □ □ □ 6 过期得药物就是□□□□五、方案依从性就是 否不适合 未访视1 筛选过程正确□ □ □ □ 2 所有受试者都符合入选/排除标准□ □ □ □ 3 不良事件就是否正确报告,记录,评价与解决 □ □ □ □ 4 受试者到诊及过程就是否按照方案规定顺序完成□□□□5 就是否按照方案给予研究干预□ □ □ □ 6 就是否有严重不良事件(S AEs) □ □ □ □六、病例报告表(CRFs)与源文件 就是 否不适合 未访视1 能否提供CRFs与相应得源文件查阅□ □□ □2 源文件就是否足以供CR Fs 核查 □ □ □ □ 3 CRFs 就是否完整,清晰,准确□ □ □ □ 4 CRF s就是否及时完成与递交(如数据录入) □□□□七、 违背方案 就是 否不适合 未访视1 以前没有注意到得违背方案之处,监查就是否发现以及正确记录 □ □□ □八、中心实验室规程就是 否不适合 未访视1 样本就是否按照方案收集与保存 □ □ □ □ 2 医务人员就是否对实验室数据得临床意义作出合适得评价与记录 □□□□九、研究设施/人员招募情况就是 否不适合 未访视1 研究中心得设施就是否还合适 □ □ □ □ 2 工作人员就是否还合适□ □ □ □ 3 目前受试者入选率就是否符合要求 □□□□十、中心现状就是 否不适合 未访视1 中心就是否有可以影响开展临床试验得变化 □ □□ □小结监察员签字:日期:。

临床试验监查报告一、背景介绍临床试验是在病人或健康人身上进行的,用以评价医疗产品性能和安全性的方法。
监查是指对临床试验过程中的各个环节及数据的检查和评估的过程。
本报告是对临床试验进行的监查工作的总结和总结。
二、监查过程1.设计监查计划:在试验开始之前,制定详细的监查计划,包括所需监查的项目和时间节点。
2.建立监查档案:按照监查计划,建立试验相关的监查档案,包括试验协议、医疗产品使用记录、试验过程记录等。
3.进行现场监查:根据监查计划,对临床试验现场进行监查。
主要内容包括试验药物的合理保存和使用、试验过程的符合试验方案要求、试验数据的准确性和完整性等。
4.数据监查和评估:对试验数据进行监查和评估,包括数据录入的准确性、试验数据的可靠性等。
5.编写监查报告:根据监查结果,编写监查报告,对试验过程中存在的问题和不足进行分析和总结,并提出改进方案。
三、监查结果1.试验药物使用:监查发现试验药物的保存和使用符合规定,未发现贮存不当、过期使用等问题。
2.试验过程符合要求:监查发现试验过程符合试验方案要求,试验操作人员操作规范,没有发现偏离试验方案的行为。
3.试验数据准确性:在数据监查中,发现试验数据录入准确,符合试验方案的要求。
4.数据完整性:从监查的试验记录中,发现试验数据的完整性良好,没有发现数据丢失或不全的情况。
四、问题分析和改进措施1.试验数据管理不规范:在试验数据管理中,发现一些试验记录存在组织不规范、记录不清晰等问题。
为此,提出改进方案,包括加强对试验操作规范的培训、完善试验数据管理制度等。
2.监查过程中的漏项:监查结果显示存在一些监查过程中的漏项,如单个监查员无法全面监查试验现场。
为此,提出改进方案,增加监查人员的数量,确保全面监查试验过程。
3.试验记录保存不规范:在试验记录保存中发现,部分试验记录保存不规范,没有按照要求进行记录保存。
提出改进方案,加强对试验记录保存制度的培训和监督,并建立相关的记录保存制度。

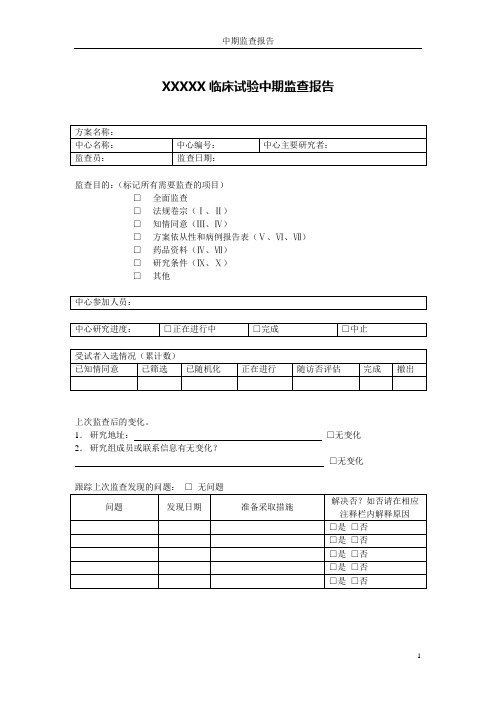
XXXXX临床试验中期监查报告监查目的:(标记所有需要监查的项目)□全面监查□法规卷宗(Ⅰ、Ⅱ)□知情同意(Ⅲ、Ⅳ)□方案依从性和病例报告表(Ⅴ、Ⅵ、Ⅶ)□药品资料(Ⅳ、Ⅶ)□研究条件(Ⅸ、Ⅹ)□其他上次监查后的变化。
1.研究地址:□无变化2.研究组成员或联系信息有无变化?□无变化跟踪上次监查发现的问题:□无问题一、研究卷宗/法规资料监查是否不适合未访视(在研究卷宗中是否有如下资料)1 附有签名的方案和方案修正案□□□□2 伦理委员会通过的知情同意书样本□□□□3 所有病例报告表样本□□□□4 研究者手册□□□□5 研究人员履历/资格说明□□□□6 研究人员相关培训文件□□□□7 伦理委员会通过的研究相关资料□□□□8 实验室资格及正常值范围□□□□二、中心监察是否不适合未访视1 所有需要的文件是否都有□□□□2 对开展临床试验至关重要的设施是否都正常□□□□运转□□□□3 研究者和其工作人员保留着和开展试验相关的记录三、知情同意/入选情况是否不适合未访视1 已签署的原始知情同意书都在受试者档案里□□□□2 是否有筛选日志□□□□3 是否有入选日志□□□□四、研究药物是否不适合未访视1 试验药物是否保存在安全的地方□□□□2 试验药物是否由专人分发□□□□3 药物运送记录及时准确并有日期及签名□□□□4 药物分发和数量记录是否及时准确□□□□5 药物是否按照方案分发□□□□6 过期的药物是否回收□□□□7 药物和随机信封是否充足□□□□8 是否破盲□□□□9 盲信封是否有说明以及是否完整□□□□五、方案依从性是否不适合未访视1 筛选过程正确□□□□2 所有受试者都符合入选/排除标准□□□□3 随机过程是否正确□□□□4 不良事件是否正确报告,记录,评价和解决□□□□5 受试者到诊及过程是否按照方案规定顺序完成6 受试者漏诊是否正确处理和记录□□□□7 是否按照方案给予研究干预□□□□8 严重不良事件(SAEs)(1) 所有SAEs都按照程序报告和记录□□□□(2) 是否有SAEs随访报告□□□□(3) 是否有SAEs需要随访□□□□(4) SAEs是否呈报伦理委员会□□□□(5) 是否有未报告的SAEs □□□□六、病例报告表(CRFs)和源文件是否不适合未访视1 能否提供CRFs和相应的源文件查阅□□□□2 源文件是否足以供CRFs核查□□□□3 CRFs是否完整,清晰,准确□□□□4 CRFs是否及时完成和递交(如数据录入)□□□□5 数据质疑是否完成及正确递交□□□□七、违背方案是否不适合未访视□□□□1 以前没有注意到的违背方案之处,这次监查是否发现以及正确记录八、中心实验室规程是否不适合未访视1 样本是否按照方案收集和保存□□□□2 样本运送记录和过程是否正确□□□□最后一次运送时间:年月日□□□□3 医务人员是否对实验室数据的临床意义作出合适的评价和记录九、研究设施/人员招募情况是否不适合未访视1 研究中心的设施是否还合适□□□□2 工作人员是否还合适□□□□3 目前受试者入选率是否符合要求□□□□十、中心现状是否不适合未访视1 中心是否有可以影响开展临床试验的变化□□□□小结预计下次监察时间:年月日监察员签字:日期:。
临床试验监查计划为了保证本次临床试验的受试者权益受到保障、试验遵循已批准的方案和相关法规进行以及试验记录与报告的数据准确、完整无误,制定本次临床试验的监查计划:- 1 -临床试验监查报告✧监查阶段:□准备阶段□进行阶段□完成阶段✧监查内容(在需要监查的项目上标记)✧跟踪上次监查发现的问题□无问题✧小结:监查员签字:参与研究者签字:日期:日期:- 1 -临床试验监查记录一、临床试验文件监查(是否有如下资料)1.签字和盖章完全的方案□是□否□不适合□未访视2.伦理委员会批件□是□否□不适合□未访视3.临床试验协议或者合同□是□否□不适合□未访视4.伦理委员会通过的知情同意书样本□是□否□不适合□未访视5.病例报告表样本□是□否□不适合□未访视6.研究者相关培训资料□是□否□不适合□未访视二、相关法规遵循情况的监查1.临床试验单位是否符合法规要求□是□否□不适合□未访视2.临床试验是否已在地方药监局备案□是□否□不适合□未访视三、知情同意/入选情况1.已入选的受试者是否签署了知情同意书□是□否□不适合□未访视2.是否有受试者筛选/入选记录□是□否□不适合□未访视3.是否有受试者鉴认代码记录□是□否□不适合□未访视四、试验单位监查1.人员,试验设备是否有任何问题或改变□是□否□不适合□未访视2.试验试剂是否充足□是□否□不适合□未访视3.试验是否按照相关法规要求进行、有试验记录□是□否□不适合□未访视4.是否有不良事件发生如是,是否已按相关法规要求记录在案□是□否□不适合□未访视□是□否□不适合□未访视五、样品保存情况是否严格遵循方案要求□是□否□不适合□未访视六、病例报告表及原始数据等1. 病例报告表核对是否与原始数据一致□是□否□不适合□未访视2. 病例报告表填写是否完整、清晰、准确□是□否□不适合□未访视- 1 -。
临床试验监查报告标准化管理处编码[BBX968T-XBB8968-NNJ668-MM9N]临床试验终期监査报告监查目的: (标记所有需要监查的项U)□全面监查□法规卷宗(I、II)□知情同意(III、IV)□方案依从性和病例报告表(V、VI、VII)□药品资料(IV、VII)□研究条件(IX、X)□其他跟踪监查发现的问题:□无问题的知情同总书样3所有病例报告表样本□□□□4研究者手册□□□□5研究人员履历/资格说明□□□□6研究人员相关培训文件□□□□7伦理委员会通过的研究相关资料□□□□8实验室资格及正□□□□二、中心监察1所有需要的文件是否都有2对开展临床试验是注释:至关重要的设施常值□ □四、研究不适是否都正常运转3研究者和其工作口人员保留着和开展试验相关的记录注释:三、知情同意/入选情况是否不适合未访视1已签署的原始知情同意书都在受试者档案里□□□□2是否有筛选日志□□□□3是否有入选日志□□□□注释:1试验药物是否保□□□□存在安全的地方试验药物是否山□□□□2专人分发药物运送记录及3□□□□时准确并有日期及签名药物分发和数量4□□□□记录是否及时准确5药物是否按照方□□□□案分发6□□□□过期的药物是否回收注释:五、方案依从性是否不适合未1筛选过程正确六、是2所有受试者都符合入选/排除标准□□□□3不良事件是否正确报告,记录,评价和解决□□□□4受试者到诊及过程是否按照方案规定顺序完成□□□□5是否按照方案给予研究干预□□□□6是否有严重不良事件(SAEs)□□□□注释:供CRFs核查七、违背方案 是 不适合未□ □ □3 CRFs 是否完整, □ □ □ □清晰,准确4 CRFs 是否及时完 口 口 □口成和递交(如数 据录入)注释:1以前没有注意到 口的违背方案之 处,监查是否发 现以及正确记录注释:八、中心实验室规程是否 不适合未访视1样本是否按照方 □□ □ □案收集和保存2医务人员是否对实验室数据的临床意义作出合适的评价和记录□ □注释:九、研究设施/人员招募情况是否不适合未访视1研究中心的设施是否还合适□□□□2工作人员是否还合适□□□□3U前受试者入选率是否符合要求□□□□注释:十、中心现状是否不适合未访视1中心是否有可以□□□ □影响开展临床试验的变化小结监察员签字:日期:。
临床试验总结监察模板摘要:一、临床试验概述二、临床试验目标三、临床试验方法四、临床试验结果五、临床试验结论六、临床试验建议正文:临床试验总结监察模板一、临床试验概述在本临床试验中,我们旨在研究(试验药物/器械/干预措施)在(疾病领域)患者中的疗效和安全性。
试验于(试验起始时间)开始,至(试验结束时间)完成。
共有(受试者人数)名患者参与了本试验。
二、临床试验目标1.评估(试验药物/器械/干预措施)在(疾病领域)患者中的疗效指标,如(疗效指标1)、(疗效指标2)等。
2.分析(试验药物/器械/干预措施)在(疾病领域)患者中的安全性,如(安全性指标1)、(安全性指标2)等。
3.探讨(试验药物/器械/干预措施)的剂量、给药方式及疗程等方面的优化方案。
三、临床试验方法1.随机、双盲、安慰剂对照试验设计:确保试验结果的可靠性和准确性。
2.纳入标准与排除标准:确保受试者具有相似的病情背景,排除不符合条件的患者。
3.试验过程:详细描述试验步骤、评估指标及数据收集方法。
4.数据分析:采用统计学方法对试验数据进行处理和分析。
四、临床试验结果1.疗效结果:描述试验药物/器械/干预措施在(疾病领域)患者中的疗效表现,如(疗效指标的改善情况)、(症状缓解率)等。
2.安全性结果:分析试验药物/器械/干预措施在患者中的安全性,如(不良事件发生率)、(严重不良事件发生率)等。
3.剂量、给药方式及疗程优化方面的发现:探讨并总结最佳剂量、给药方式及疗程方案。
五、临床试验结论根据试验结果,本研究认为(试验药物/器械/干预措施)在(疾病领域)患者中具有较好的疗效和安全性。
此外,通过剂量、给药方式及疗程的优化,可进一步改善患者病情,提高生活质量。
六、临床试验建议1.基于试验结果,为临床医生提供(试验药物/器械/干预措施)的治疗建议。
2.针对试验中出现的不良事件,提出预防、监测和处理措施。
3.进一步完善和推广(试验药物/器械/干预措施)在(疾病领域)患者中的应用。
临床试验终期监查报告
监查目的:(标记所有需要监查的项目)
□全面监查
□法规卷宗(Ⅰ、Ⅱ)
□知情同意(Ⅲ、Ⅳ)
□方案依从性和病例报告表(Ⅴ、Ⅵ、Ⅶ)
□药品资料(Ⅳ、Ⅶ)
□研究条件(Ⅸ、Ⅹ)
□其他
是否不适合未访视一、研究卷宗/法规资料监查
(在研究卷宗中是否有如下资料)
1 附有签名的方案和方案修正案□□□□
2 伦理委员会通过的知情同意书样本□□□□
3 所有病例报告表样本□□□□
4 研究者手册□□□□
5 研究人员履历/资格说明□□□□
6 研究人员相关培训文件□□□□
7 伦理委员会通过的研究相关资料□□□□
8 实验室资格及正常值范围□□□□
二、中心监察是否不适合未访视
1 所有需要的文件是否都有□□□□
□□□□
2 对开展临床试验至关重要的设施是否都正常
运转
3 研究者和其工作人员保留着和开展试验相关
□□□□的记录
三、知情同意/入选情况是否不适合未访视
1 已签署的原始知情同意书都在受试者档案里□□□□
2 是否有筛选日志□□□□
3 是否有入选日志□□□□
四、研究药物是否不适合未访视
1 试验药物是否保存在安全的地方□□□□
2 试验药物是否由专人分发□□□□
3 药物运送记录及时准确并有日期及签名□□□□
4 药物分发和数量记录是否及时准确□□□□
5 药物是否按照方案分发□□□□
五、方案依从性是否不适合未访视
1 筛选过程正确□□□□
2 所有受试者都符合入选/排除标准□□□□
3 不良事件是否正确报告,记录,评价和解决□□□□
4 受试者到诊及过程是否按照方案规定顺序完成□□□□
5 是否按照方案给予研究干预□□□□
6 是否有严重不良事件(SAEs)□□□□
六、病例报告表(CRFs)和源文件是否不适合未访视
1 能否提供CRFs和相应的源文件查阅□□□□
2 源文件是否足以供CRFs核查□□□□
3 CRFs是否完整,清晰,准确□□□□
4 CRFs是否及时完成和递交(如数据录入)□□□□
七、违背方案是否不适合未访视
1 以前没有注意到的违背方案之处,监查是否
□□□□发现以及正确记录
八、中心实验室规程是否不适合未访视
1 样本是否按照方案收集和保存□□□□
□□□□
2 医务人员是否对实验室数据的临床意义作出
合适的评价和记录
九、研究设施/人员招募情况是否不适合未访视
1 研究中心的设施是否还合适□□□□
2 工作人员是否还合适□□□□
3 目前受试者入选率是否符合要求□□□□
十、中心现状是否不适合未访视
1 中心是否有可以影响开展临床试验的变化□□□□
小结
监察员签字:
日期:。