肠系膜血管损伤的诊断与治疗
- 格式:doc
- 大小:30.50 KB
- 文档页数:3


《2020中国急性肠系膜缺血诊断与治疗专家共识》要点急性肠系膜缺血(AMI)常被定义为小肠部分血液供应的突然中断,引起的局部缺血、细胞损伤和肠道病变。
如果未经及时治疗,该过程将迅速进展为危及生命的肠坏死。
AMI有非闭塞性(NOMI)和闭塞性两种类型,闭塞性肠系膜缺血又可进一步细分为肠系膜动脉栓塞(EAMI)、肠系膜动脉血栓形成(TAMI)及肠系膜静脉血栓形成(VAMI)。
该病总体发病率较低,但在全部急诊就诊患者中,其比例仍能达到0.09~0.20%。
快速诊断和干预AMI,对于降低病死率至关重要。
但长久以来,AMI诊断困难且缺乏有效的治疗手段。
1 定义本共识参考2016年欧洲肠系膜缺血指南,对AMI的定义进行了更新:即急性肠系膜动脉、静脉栓塞或循环压力降低,导致肠系膜内血流减少,难以满足其相应脏器的代谢需求。
不包括孤立性肠缺血,以及由于粘连性肠梗阻、疝等外压因素造成的局灶性、节段性缺血。
慢性肠系膜缺血(CMI)及缺血性结肠炎是单独的病例,亦不属此列。
2 流行病学3 肠系膜循环系统的解剖及生理学特点4 病理生理学4.1 急性肠系膜动脉栓塞(EAMI)4.2 急性肠系膜血栓形成(TAMI)4.3 急性非闭塞性肠系膜缺血(NOMI)4.4 肠系膜静脉血栓形成(VAMI)5 临床表现与危险因素5.1 AMI的一般临床表现主诉与查体不符的剧烈腹痛是AMI早期的经典表现。
【推荐意见1】:主诉与查体不符的剧烈腹痛是AMI早期的经典表现,但不足以作为诊断标准。
而漏诊所导致的后果十分严重。
故无明确病因的急性腹痛患者(特别是合并有心血管方面疾病的老年人)应疑诊为AMI 直至被推翻。
(推荐等级:1B)5.2 各类型AMI的危险因素(见表2)【推荐意见2】:房颤患者突发剧烈腹痛时,应考虑EAMI;动脉粥样硬化患者,特别是近期患有餐后综合征的患者,应考虑TAMI;高凝状态的患者则应怀疑VAMI;临床症状出现预期外恶化的危重患者应考虑NOMI。

急性肠系膜血管缺血性疾病的诊断及介入治疗综述吴卫平审校李选1 概述急性肠系膜血管缺血性病多发生于患有心血管疾病的老年病人,系因肠系膜血管(动脉或静脉)闭塞或血流锐减而引起的严重缺血性损害或肠坏死。
该组疾病发展较快,肠管短期内出现广泛坏死,死亡率极高。
只有在肠管坏死前,尽早诊断,尽快恢复肠系膜血管血流,才能治愈.[12]而过去临床诊断和治疗上要做到这一点都较困难,外科血管重建和被动切除坏死肠管为其经典治疗方法,该组疾病总死亡率达60-100%[]。
直到上世纪70年代,Boley等人报告对肠系膜动脉缺血采用较积极主动诊治方案???,早期识别肠缺血原因,尽快恢复肠系膜血管血流,使急性肠系膜缺血(AMI)存活率由20%上升到55%。
[3]随着对肠道缺血性疾病认识的深入,螺旋CT、CTA、MDCT、MRA、多普勒血流成像等无创影像诊断技术的发展,缺血性肠病早期诊断成为可能。
而介入治疗包括:经导管灌入血管扩张药、经导管溶栓、取栓、血管成形(PTA)及内支架植入(PTAS)在缺血性肠病治疗中扮演越来越重要的角色。
病理解剖及病理生理:不论血管栓塞、血栓形成、收缩狭窄等原因导致的肠系膜血管闭塞或非闭塞性缺血,最终预后取决于1、全身循环系统状况;2、血管受累程度;3、受累血管数量和口径;4、血管床对血流减少的反应;5、侧支循环状况;6、缺血持续时间;7、受累肠段代谢情况。
[29]短暂轻度缺血只引起肠管粘膜损害,恢复血流后约两周均可愈合。
中度缺血深及肠壁肌层,治愈后可形成瘢痕性狭窄.重度缺血则肠壁全层坏死,呈现不可逆性变化。
动脉性缺血,肠壁坏死进程较快。
静脉血栓形成时肠管血流回流受阻,首先肠壁充血、出血,继而动脉亦栓塞,肠管坏死,病程进展较缓慢,肠壁坏死出血,腹水呈血性。
急性肠系膜血管缺血性疾病通常分为:①、急性肠系膜上动脉栓塞;②、急性肠系膜上动脉血栓形成;③、急性非闭塞性系膜血管缺血;④、肠系膜静脉血栓形成。
[9]2性肠系膜上动脉闭塞(栓塞、血栓形成)急性肠系膜上动脉闭塞是肠缺血最常见的原因,可由于栓子栓塞和动脉血栓形成。

2020中国急性肠系膜缺血诊断与治疗专家共识(完整版)急性肠系膜缺血(ac u te me se nt eri c i sc h e mi a,A MI)常被定义为小肠部分血液供应的突然中断,引起的局部缺血、细胞损伤和肠道病变。
如果未经及时治疗,该过程将迅速进展为危及生命的肠坏死。
AMI有非闭塞性(n on-o c cl u siv e me s e nt eri c i sc he mi a,N OMI)和闭塞性两种类型,闭塞性肠系膜缺血又可进一步细分为肠系膜动脉栓塞(me s e nt eri c ar te ry e m boli s m,E AMI)、肠系膜动脉血栓形成(mes e nt eri c ar te ri al t hr o mbo s i s,T AMI)及肠系膜静脉血栓形成(m e se nt eri c ve no u s th r o mbo si s,V AMI)。
该病总体发病率较低,但在全部急诊就诊患者中,其比例仍能达到0.09%~0.20%。
快速诊断和干预A MI,对于降低病死率至关重要。
但长久以来,A MI诊断困难且缺乏有效的治疗手段。
且由于较低的总体发病率,单个组织或机构很难对其进行系统的临床研究,一些经典的医学著作对该病的描述及诊治方式在近年更新的版本中几乎没有发生过大的变化。
目前,仍缺乏足够的高质量循证数据来指导A MI的评估和治疗。
已发表的文献主要为某些医学机构的回顾性研究、相关病例的讨论分析及专家的个人建议等。
故为了积极应对我国AMI的发病情况,我们采用国内外最新的人群流行病学研究数据,并结合相关临床文献,由多学科专家组成联合委员会共同制定了《中国急性肠系膜缺血诊断与治疗专家共识》,旨在指导我国AMI的诊断、评估与临床治疗等工作。
该专家共识从AMI的分类、临床表现、血清学及影像学特征、治疗及预后等方面都进行了相关阐述并提出了相应的建议。
对于共识中的建议,专家小组以文献、数据的质量和每项建议的收益、风险与负担之间的平衡为基础进行了分级。

《2020中国急性肠系膜缺血诊断与治疗专家共识》急性肠系膜缺血(AMI) 常被定义为小肠部分血液供应的突然中断,引起的局部缺血、细胞损伤和肠道病变。
《2020中国急性肠系膜缺血诊断与治疗专家共识》从AMI的分类、临床表现、血清学及影像学特征、治疗及预后等方面都进行了相关阐述并提出了相应的建议,旨在指导我国AMI的诊断、评估与临床治疗等工作。
01临床表现与危险因素推荐意见1:主诉与查体不符的剧烈腹痛是AMI早期的经典表现,但不足以作为诊断标准。
而漏诊所导致的后果十分严重。
故无明确病因的急性腹痛患者(特别是合并有心血管方面疾病的老年人) 应疑诊为AMI直至被推翻。
(推荐等级:1B)推荐意见2:房颤患者突发剧烈腹痛时,应考虑肠系膜动脉栓塞(EAMI);动脉粥样硬化患者,特别是近期患有餐后综合征的患者,应考虑为肠系膜动脉血栓形成(TAMI);高凝状态的患者则应怀疑为VAMI;临床症状出现预期外恶化的危重患者应考虑非闭塞性肠系膜缺血(NOMI)。
(推荐等级:1B)推荐意见3:任何介入性操作,特别是涉及血管操作后出现的不明原因腹痛,均应考虑并查证AMI的可能性(推荐等级:1B)02辅助检查推荐意见4:目前并没有可用于确诊AMI的特定的实验室检验指标。
(推荐等级:1B)推荐意见5:对于疑诊为AMI的患者,应尽快进行CTA检查。
(推荐等级:1A)03治疗推荐意见6:确诊AMI的患者,无论是否存在休克症状,均建议立即开始液体复苏以增加内脏灌注。
(推荐等级:1B)推荐意见7:抗凝、解除肠系膜血管痉挛以及广谱抗生素的应用建议AMI早期立即进行。
(推荐等级:1B)推荐意见8:在病情允许情况下,建议AMI早期进行血管内介入治疗,以争取更好的预后。
介人术后应持续抗凝。
(推荐等级:1B) 推荐意见9:腹膜炎患者原则上仍应进行积极剖腹探查。
(推荐等级:1B)推荐意见10:对于预期需要进行肠道部分切除手术的患者而言,损伤控制性手术(DCS)是AMI治疗的重要辅助手段。
肠系膜血管损伤在临床工作中并不少见,在腹部穿透性创伤中肠系膜及大网膜受损的发生率为9.5%,腹部钝性伤中肠系膜受累率为2.5%[1]。
但由于诊断技术的限制,医生对肠系膜损伤的认识不足,大多数的系膜损伤都是在术中才被诊断。
因此,重新复习肠系膜血管损伤的一些相关问题,会有助于提高对肠系膜血管损伤的诊断和治疗水平。
一. 肠系膜血管损伤的发生原因肠系膜血管包括肠系膜上动、静脉和肠系膜下动、静脉,是腹部脏器血管的主要组成部分,分别走行于小肠系膜、结肠系膜和直肠系膜中,负责十二指肠水平段至直肠上段几乎全部肠道的血液供应及血液回流。
肠系膜上、下动脉是腹主动脉的两个主要分支,均起自腹主动脉前壁,由于肠系膜血管走行波及面积广,其受损机会并不比其它组织少,且常合并有消化道破损和实质脏器损伤。
肠系膜血管损伤在和平时期和战争时期均可发生,主要为3种原因造成。
1. 腹部穿透性损伤多为锐器所致,如刺伤等;也可为枪弹致伤;肠系膜血管受累的严重程度与投射物的速度有极大关系。
一般而言,开放性肠系膜血管损伤的受损范围比较局限,依其受伤形式不同而分为刺入伤和贯通伤两种。
2. 腹部闭合性损伤随着工业和交通的发展,工矿事故和交通事故所致闭合性肠系膜血管损伤日渐增多,损伤部位多在易于游动的系膜内血管,如小肠系膜中的空/回肠血管、横结肠系膜中的结肠中血管及乙状结肠系膜中的乙状结肠和直肠上血管。
相对而言,走行于腹膜后的结肠左、结肠右血管因其位置固定,在闭合性损伤中很少受累。
3. 医源性损伤医源性肠系膜血管损伤虽不常见,但仍应引起足够的重视,特别在外科手术范围日趋扩大和介入医学飞速发展的今天,该类损伤亦有增多的趋势。
在开腹手术操作中,医源性损伤主要发生于胃切除手术时结肠中血管的损伤、胰头十二指肠切除时的肠系膜上血管损伤、腹膜后或小肠系膜根肿物切除时造成的相应系膜血管损伤、左肾切除等手术中出现肠系膜上动脉起始部损伤等。
随着介入性诊治技术的发展,接受介入治疗的患者愈来愈多,操作过程中的动作粗暴、反复试插可以引起血管内皮损伤,损伤部位往往位于血管主干,造成严重后果,应予高度重视。
肠系膜血管损伤可以单发,也可以多发,其病理表现主要包括系膜挫伤、系膜破裂和血管内皮损伤三种形式。
无论是系膜挫伤造成的系膜血肿,还是系膜破裂造成的腹腔内出血,但凡损伤涉及肠系膜动脉主干或累及较大范围的肠动脉弓以远的直支血管,均影响肠壁的血液供应,甚至造成所属肠段的坏死。
介入治疗造成的肠系膜血管内皮损伤容易造成系膜血管内血栓形成,引发肠缺血等一系列病变。
血管内皮损伤在早期可无明显的病理变化,唯最终出现小肠供血不良或小肠瘀血、肠屏障功能下降[2],甚至肠坏死,造成严重的延迟性腹腔感染。
二. 肠系膜血管损伤的临床表现和诊断方法单纯的肠系膜血管损伤较为罕见,术前诊断十分困难,约半数以上患者出现进行性血压下降,而按腹腔内出血进行剖腹探查。
肠系膜血管损伤的临床表现主要取决于损伤程度、累及血管种类、受伤至就诊的时间、以及是否合并其它部位器官和组织的损伤,从而出现内出血、腹膜炎和休克征象。
合并胃肠道损伤者,则在受伤同时或一段时间后出现明显的腹膜炎症表现,甚至出现感染性休克和生命体征波动。
严重的肠系膜血管损伤导致的肠壁血运障碍,最终会因造成相应肠段坏死而出现延迟性腹膜炎。
极少数病人在腹部外伤后很长一段时间并无特异性症状,其后以反复性消化道出血就诊,通过血管造影发现为肠系膜血管动脉瘤或动静脉瘘。
肠系膜血管损伤的辅助诊断方法很多,但特异性不高,在临床工作中可选择以下方法进行辅助诊断。
1. 腹腔穿刺及灌洗对腹腔内出血诊断的准确率可高达90%以上,特别是对于尚未造成血液动力学波动的小量缓慢出血的诊断具有重要意义。
腹腔灌洗对腹腔内出血早期诊断的阳性率比腹腔穿刺高,经导管注入0.9%氯化钠溶液1 000 mL,如出现肉眼血性液或者引流液红细胞计数超过1×1010/L,白细胞计数超过5×108/L即为阳性诊断。
2. B型超声波检查B型超声波检查对肠系膜血管损伤的诊断价值虽不象对肝脾损伤那么重要,但对是否存在腹腔积液能做出判断,可有助于对肠系膜血管损伤的推理诊断。
B超也可发现因小肠系膜受损而出现的肠管扩张、肠腔内积气积液、肠道蠕动减弱或消失等。
B超所见肠壁弹性极差,肠黏膜皱襞显示不清,往往是肠组织血运障碍的特征。
3. X线检查在肠系膜血管损伤时,腹平片的主要表现为肠郁胀、肠梗阻,如出现“新月征”和“穹隆征”说明有胃肠道气体溢出,提示胃肠道损伤或因血运障碍造成迟发性肠坏死、肠穿孔,后者亦为系膜血管损伤的晚期表现。
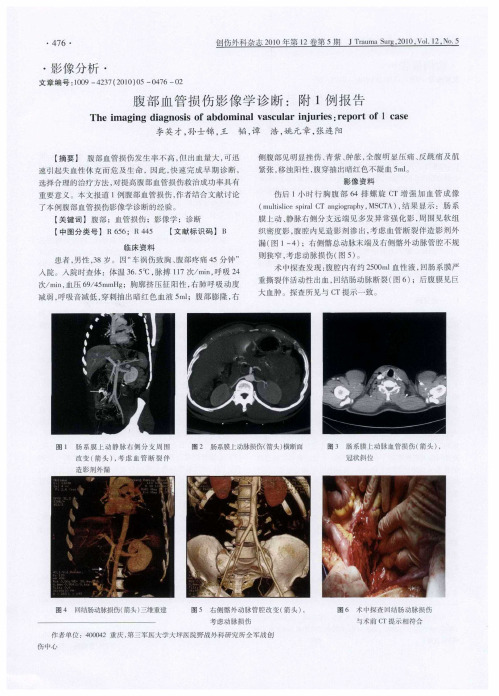
4. 腹部CT及MRI检查腹部CT扫描可以清楚识别肠系膜血管及小肠系膜根部情况,如肠系膜区出现不均质影像则对肠系膜血管损伤具有重要的定位诊断意义[3,4]。
Nghiem[5]等认为,在腹部闭合性损伤中,CT是肠系膜血管损伤术前诊断的最好影像学检查方法,通过细致的断层扫描,大多数肠系膜损伤可被发现。
MRI扫描可从多个方向进行切面成像,是一种新型的无损伤性诊断技术,其对组织的分辨能力极高,可清楚地显示肠系膜血管的走行及其管壁情况。
Dowe[6]对27例肠系膜血管损伤患者就CT发现和手术探查结果的相关性进行对比性研究,认为CT检查显示有肠系膜血肿及浸润并伴有肠壁增厚者,预示该系膜血管损伤需要手术治疗,而仅有局限性肠系膜血肿不伴对应肠壁增厚则不具有特异性。
5. 选择性肠系膜血管数字减影选择性肠系膜血管造影虽是术前确诊肠系膜血管损伤的最好方法,但因其检查操作繁琐而在急症诊断中极少应用,少数从肠系膜血管造影中获益的患者也并非为诊断肠系膜血管损伤而进行该项检查。
在肠系膜血管造影中如能发现造影剂溢入腹腔或沿肠系膜蔓延,肠系膜血管破裂诊断则不容置疑。
由于肠系膜血管损伤多伴发其它脏器损伤及其它大血管破裂,患者生命指征多不平稳,不宜进行复杂操作检查,因此肠系膜血管造影不应做为常规的诊断手段。
肠系膜血管损伤造成腹腔内出血需与肝、脾等实质脏器破裂出血及腹腔非内脏血管破裂出血相鉴别,术前对腹部损伤的具体部位应有一比较清楚的了解,这不仅有助于选择手术切口,而且有助于手术力量的配备和特殊器械及材料的准备。
但由于肠系膜血管损伤往往伴发其它脏器损伤,其鉴别诊断十分困难,大多在术前很难得到确定诊断,仔细了解受伤机制,认真阅读CT图片可能对鉴别诊断有所帮助。
在腹部闭合性损伤中,对于肠系膜血管损伤造成的肠系膜血肿应与腹壁挫伤相鉴别,如出现腹部绞痛、深压痛及肠鸣音减弱,X线检查出现肠麻痹及CT扫描发现肠系膜质地不均、肠壁增厚者要高度怀疑肠系膜血管损伤。
三. 肠系膜血管损伤的手术治疗肠系膜血管损伤多因合并其它脏器损伤,出现腹腔内出血或腹膜炎而进行剖腹探查,并在术中进一步明确诊断。
但对于尚无血液动力学变化的较大肠系膜血肿进行及时的手术治疗,并掌握其手术指征十分困难,而延误手术则有可能造成大段肠坏死,甚至危及伤员生命[7]。
怀疑肠系膜血管主干损伤时,剖腹探查手术切口以选择上至剑突下至耻骨联合的腹正中切口为宜,这样可以充分暴露内脏血管,提供良好的手术视野。
近段肠系膜上动脉的损伤可以在腹膜后将左侧腹腔脏器推向右侧,胰腺下缘肠系膜上动脉可通过横结肠系膜下叶予以暴露。
手指压迫无效的肠系膜上动脉出血应控制近端腹主动脉,其入路既可通过小网膜腔经腹控制,也可通过第八肋间经胸控制胸主动脉下段。
控制主动脉后,可以在腹膜后将脾、胰、左半结肠翻向对侧,充分暴露肠系膜上动脉起始部,以便于仔细寻找出血部位。
在闭合性损伤中肠系膜下动脉主干受损很少发生[8,9],其起始部可通过解剖肾下腹主动脉段获得。
轻度的肠系膜血管损伤无一不是在手术探查中发现的,对于肠系膜挫伤和较小的肠系膜血肿一般不需特殊处理,细小的肠系膜血管出血在肠系膜浆膜的张力压迫下很快可以自止[10]。
此时进行血管结扎止血不仅没有必要,而且可能造成肠系膜血管的进一步损伤。
由于内脏血管存在着丰富的侧支循环,小范围的肠系膜血管分支损伤不会造成肠道缺血。
对于较大的肠系膜血肿应切开浆膜进行受损血管探查,处理肠系膜血管损伤应十分细致,既要妥善止血,又要避免缝扎尚未受累的血管,二级、三级的肠系膜血管分支均可安全结扎。
为保障肠壁的血液供应,对于肠系膜血管主干的损伤应尽量进行修补重建。
范围较小的损伤,可对损伤部位连续单纯缝合或外翻缝合修补[11]。
肠系膜上动脉贯通伤可去除受损管壁,行断端的对端吻合;如吻合张力较大,可置入一段自体大隐静脉[12]。
范围较大的肠系膜上动脉根部损伤,可施行主动脉-肠系膜上动脉搭桥术[13]。
肠系膜静脉侧支循环比较丰富,结扎后发生坏死机会较少,但应谨慎行事,对肠系膜静脉大血管损伤也要尽量修复、重建。
静脉血管修复重建后,因其压力较低、血流缓慢,发生血栓的机会较动脉为多。
静脉血管吻合术后需做降低血液凝集性的处理,如予以低分子右旋糖酐、肝素等。
由于血管损伤而引起的失活肠组织必须予以切除,肝曲以远的结肠切除后进行一期吻合必须十分慎重,乙状结肠血管受损造成肠坏死者可选用Hartmann手术,以后再行二期吻合。
虽有文献报道Doppler血流探测技术、同位素检测、染色剂注入等技术有助于小肠活性评估,但这些方法的可靠数据多来源于非创伤性小肠缺血,失活肠段周边组织的血运情况通常需要在术后24小时行二次探查做出结论。
尿激酶、1'6二磷酸果糖等药物可溶解血栓或改善组织的乏氧状态,这些药物的及时应用可能对恢复周边组织血供提供帮助。
四. 医源性肠系膜血管损伤的预防在腹部手术操作中,外科医师应具有丰富的解剖学知识,注意腹膜后区的局部比邻关系,注意手术操作的层次,注意术野的充分暴露,都可以在一定程度上防止因手术操作失误而发生医源性肠系膜血管损伤。
选择性血管造影及介入治疗是引起医源性肠系膜血管损伤的另一原因,在插管操作时务必要动作轻柔,避免反复试插而引起血管损伤。
由于造成肠系膜血管损伤的众多相关因素,如受伤至就诊的时间、低血压的程度及时间、伴发损伤的种类、受损血管的类型等,无法对该类患者提出一个固定的抢救及手术治疗方案,为此只有根据具体情况进行不同的个体化处理才能收到较好的治疗效果。
/wkx/1490916/。