脓毒血症及脓毒性休克简介
- 格式:doc
- 大小:25.00 KB
- 文档页数:2



脓毒症和脓毒性休克定义国际共识解读(完整版)脓毒症(sepsis)是由感染诱发的机体生理、病理、生化异常的综合征。
由于一些众所周知的原因,近年脓毒症发病率有所上升,仍是全球范围内导致死亡及残疾的主要原因之一。
1991年脓毒症共识会议首次定义脓毒症为由感染引起的机体全身炎症反应综合征(SIRS),而有器官功能障碍者定义为重症脓毒症,脓毒性休克则定义为"充分液体复苏后持续存在的脓毒症诱导的低血压"[1]。
2001年第二次共识会议虽然认识到这些定义的局限[2],并且列出了扩展的诊断标准,但由于缺少循证医学证据,并未提出新的定义,事实上,脓毒症及脓毒性休克定义20多年来并无显著改变。
大家认为目前脓毒症定义不能代表当前对脓毒症的新认识,有必要重新审视现有相关定义及诊断标准,并且制定新的更符合脓毒症病理生理及临床的定义,为规范统一脓毒症诊断、流行病学及临床治疗、研究打下基础[3,4,5]。
为此,欧洲危重病学会2014年1月起发起了19个相关组织的特别专家组。
这个小组从2014年1月到2015年1月召开4次面对面的会议,并通过邮件联系及投票方式讨论并对相关问题作出决议,基于对脓毒症病理学的进一步加深认识及临床大数据分析,提出了脓毒症及脓毒性休克新的定义及诊断标准,结果发表于2016年2月美国医学会杂志(JAMA)上[6]。
限于篇幅,本文省略了有关制定新定义的方法学及过程,而主要介绍新定义及临床诊断标准。
1 共识提出的问题1.1 目的如何区别脓毒症和无并发症的感染是本次共识的主要目的,而与病理学进展一致的定义更新是共识的另一项任务。
专家组认为重要的是寻找可靠的指标,而且这些指标最好涵盖所有脓毒症因素(感染、宿主反应及器官障碍),易于获得,价格合理,最终应该能够前瞻性测定这些标准的有效性。
此外,这些标准应适用于医院外、急诊及医院内患者。
另外,共识试图寻求脓毒症生物学、临床诊断及流行病学的一致性。

名词解释脓毒血症
脓毒血症(Sepsis)是一种危重的全身感染,它通常由细菌、病
毒或真菌引起,可在任何年龄段发生。
当细菌或其他有害微生物进入
血液中,人体便发生免疫反应,从而产生炎症细胞,加重呼吸困难。
脓毒血症的发病机制是由于严重的炎症反应引起的,它会导致血液凝固、血流阻塞、组织萎缩、脏器功能受损,并逐渐发展为休克或死亡。
脓毒血症的症状很难确定,因为它可能伴随着许多其他问题,例
如关节疼痛、恶心和呕吐、皮疹和关节肿胀等。
因此,只有由医生专
业确诊时,才能确定脓毒血症的病情。
如果被及早诊断,脓毒血症可
能会得到有效治疗。
治疗通常由抗生素组成,其中一些可能会被注射
或给予口服。
如果抗生素无法控制病毒,患者可能需要血液流变治疗
或血液体液置换。
此外,病人还需要接受支持性疗法,以管理疼痛或疾病造成的其
他不良反应,并帮助促进恢复。
脓毒血症的治疗也可以根据患者的个
人情况来安排,以改善他们的健康状况。
虽然脓毒血症是危及生命的,但如果得到及时的治疗,患者仍有机会恢复健康。

脓毒血症:针对感染的失调的宿主反应引起的危及生命的器官功能障碍。
脓毒性休克:指脓毒症患者尽管充分的液体复苏仍存在持续的低血压,需要使用升压药物维持平均动脉压65mmHg以上,血乳酸2mmol/L 以上。
A.早期复苏1 对脓毒症诱导的低灌注,在开始的3h内,给与至少30ml/Kg的晶体液,在完成初始液体复苏后,需要反复进行评估血流动力学状态指导进一步的液体使用(CVP/血乳酸/平均动脉压/下腔静脉变异度等)。
2、对于脓毒性休克需要血管活性药物的患者,我们推荐初始目标平均动脉压为65mmHg。
3、对于乳酸水平升高,提示组织低灌注的患者,我们建议进行乳酸指导性复苏,并将乳酸恢复正常水平。
B.脓毒症筛查以及质量提高C.诊断:常规在使用抗生素之前,进行微生物培养。
D.抗微生物治疗:在识别脓毒症或者脓毒性休克后1h内尽快启动静脉抗生素使用,经验性使用一种或者几种广谱抗生素进行治疗,以期覆盖所有可能的病原体(包括细菌以及潜在的真菌或者病毒,强推荐,中等证据质量),一旦可以确认微生物,同时药敏结果已经明确,和/或充分的临床症状体征改善,需要将经验性抗生素治疗转化为窄谱,针对性用药。
抗生素治疗疗程为7-10天,对于大多数严重感染相关脓毒症以及脓毒性休克是足够的E.感染源的控制F.液体治疗1.在血流动力学指标持续在改善的前提下,当持续进行液体输注时,使用补液试验。
2.在早期液体复苏以及随后的容量置换中,首选晶体液。
也可以使用平衡液或者生理盐水进行液体复苏。
当需要大量的晶体液时,可额外使用白蛋白;不建议使用羟乙基淀粉进行血容量的扩充。
G.血管活性药物的使用1.去甲肾上腺素作为首先的血管活性药物,可以加用血管加压素(最大剂量0.03U/min)或者肾上腺素以达到目标MAP,或者加用血管加压素(最大剂量0.03U/min),以降低去甲肾上腺素的剂量。
2.在高选择性患者群体中,使用多巴胺作为去甲肾上腺素的替代血管活性药物(例如快速型心律失常以及绝对或者相对心动过缓低风险),不推荐使用低剂量多巴胺用于肾脏保护。
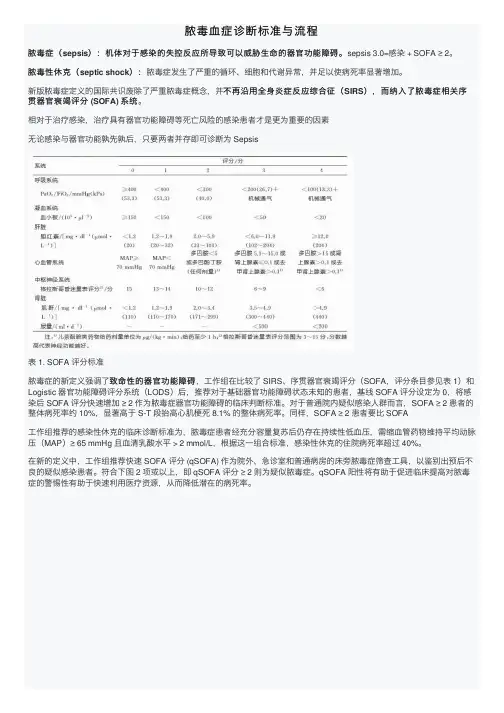
脓毒⾎症诊断标准与流程脓毒症(sepsis):机体对于感染的失控反应所导致可以威胁⽣命的器官功能障碍。
sepsis 3.0=感染 + SOFA ≥ 2。
):脓毒症发⽣了严重的循环、细胞和代谢异常,并⾜以使病死率显著增加。
脓毒性休克(septic shock):不再沿⽤全⾝炎症反应综合征(SIRS),⽽纳⼊了脓毒症相关序新版脓毒症定义的国际共识废除了严重脓毒症概念,并不再沿⽤全⾝炎症反应综合征(贯器官衰竭评分 (SOFA) 系统系统。
相对于治疗感染,治疗具有器官功能障碍等死亡风险的感染患者才是更为重要的因素⽆论感染与器官功能孰先孰后,只要两者并存即可诊断为 Sepsis表 1. SOFA 评分标准致命性的器官功能障碍,⼯作组在⽐较了 SIRS、序贯器官衰竭评分(SOFA,评分条⽬参见表 1)和脓毒症的新定义强调了致命性的器官功能障碍Logistic 器官功能障碍评分系统(LODS)后,推荐对于基础器官功能障碍状态未知的患者,基线 SOFA 评分设定为 0,将感染后 SOFA 评分快速增加 ≥ 2 作为脓毒症器官功能障碍的临床判断标准。
对于普通院内疑似感染⼈群⽽⾔,SOFA ≥ 2 患者的整体病死率约 10%,显著⾼于 S-T 段抬⾼⼼肌梗死 8.1% 的整体病死率。
同样,SOFA ≥ 2 患者要⽐ SOFA⼯作组推荐的感染性休克的临床诊断标准为,脓毒症患者经充分容量复苏后仍存在持续性低⾎压,需缩⾎管药物维持平均动脉压(MAP)≥ 65 mmHg 且⾎清乳酸⽔平 > 2 mmol/L,根据这⼀组合标准,感染性休克的住院病死率超过 40%。
在新的定义中,⼯作组推荐快速 SOFA 评分 (qSOFA) 作为院外、急诊室和普通病房的床旁脓毒症筛查⼯具,以鉴别出预后不良的疑似感染患者。
符合下图 2 项或以上,即 qSOFA 评分 ≥ 2 则为疑似脓毒症。
qSOFA 阳性将有助于促进临床提⾼对脓毒症的警惕性有助于快速利⽤医疗资源,从⽽降低潜在的病死率。

脓毒性休克脓毒性休克是一种严重的全身炎症反应,常见于感染引起的严重疾病,它是由细菌或其他病原体引起的感染导致体内产生大量毒素,并引起全身炎症反应。
脓毒性休克是一种紧急情况,需要立即就医处理。
脓毒性休克最常见的病原体是细菌,但也可能由真菌、寄生虫或其他病原体引起。
感染可以发生在任何部位,常见的包括肺部感染、腹腔感染、尿路感染和伤口感染。
脓毒性休克的发病机制复杂,主要与细菌或病原体引起的毒素释放和炎症介质的过度释放有关。
脓毒性休克的临床表现多种多样,包括高热、寒战、心率增快、血压下降、尿量减少等。
患者可能出现全身性感染症状,如发热、乏力、食欲不振等。
此外,脓毒性休克还可能导致多个器官功能衰竭,例如呼吸衰竭、肾功能衰竭和肝功能衰竭等,并且可能导致严重的并发症,甚至死亡。
对于患有脓毒性休克的患者,早期诊断和适时治疗至关重要。
首先,医生需要进行全面的体格检查和病史询问,以了解患者的病情和病史。
其次,医生可能需要进行一系列实验室检查,例如血常规、C反应蛋白和血培养等,以确定感染的类型和严重程度。
在一些病例中,医生可能还需要进行影像学检查,如X线、CT扫描或超声检查等。
这些检查可以帮助医生确定感染的来源和全身炎症反应的严重程度。
治疗脓毒性休克的目标是迅速控制感染,并支持患者的生命体征。
治疗的具体措施包括给予抗生素治疗、液体复苏、抗炎药物和支持性治疗等。
抗生素治疗应该根据细菌培养的结果来选择,并且需要在感染被确认后尽早给予。
液体复苏是通过静脉输液来纠正低血压和低血容量的情况。
抗炎药物可以通过抑制炎症反应来减轻症状和改善预后。
支持性治疗则包括监测和支持患者的生命体征,如呼吸、心率和血压等。
在一些情况下,脓毒性休克可能需要进行手术干预来控制感染源。
手术可能包括引流脓液、清创和切除坏死组织等。
手术的目的是尽早控制感染和清除病灶。
手术后,患者可能需要继续接受抗生素治疗和支持性治疗来促进康复。
脓毒性休克的预后取决于多个因素,包括感染的严重程度、患者的整体健康状况和治疗的及时性。



中国脓毒症/脓毒性休克急诊治疗指南脓毒症和脓毒性休克是临床上常见且严重的疾病,对患者的生命健康构成了巨大威胁。
为了提高急诊对这类疾病的治疗效果,制定科学合理的治疗指南至关重要。
脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍。
而脓毒性休克则是脓毒症的一种严重并发症,伴有持续性低血压,即使在充分补液后仍需要血管活性药物来维持平均动脉压≥65mmHg 以及血乳酸浓度>2mmol/L。
在急诊治疗中,早期识别和诊断脓毒症及脓毒性休克是关键的第一步。
对于存在感染或疑似感染的患者,如果出现了器官功能障碍的表现,如呼吸急促、意识改变、少尿等,应高度警惕脓毒症的可能。
同时,一些实验室指标如血乳酸水平升高、降钙素原升高等也有助于诊断。
一旦怀疑或确诊脓毒症/脓毒性休克,应立即开始液体复苏。
快速输注晶体液是初始治疗的重要措施,通常在 30 分钟内输注至少 30ml/kg的晶体液。
在补液过程中,要密切监测患者的反应,包括血压、心率、尿量等指标,以评估补液的效果。
对于经过充分液体复苏仍存在低血压的患者,需要使用血管活性药物来维持血压。
去甲肾上腺素是首选的血管活性药物,它能够有效地提升血压,改善组织灌注。
在使用血管活性药物时,要根据患者的血压情况及时调整剂量,以达到理想的血压水平。
抗感染治疗也是脓毒症/脓毒性休克治疗的重要环节。
在开始治疗前,应尽可能留取病原学标本,包括血培养、痰培养、尿培养等,以便明确致病菌,为后续的精准治疗提供依据。
在病原学结果明确之前,应尽早经验性地使用广谱抗生素进行抗感染治疗,之后根据病原学结果和药敏试验结果及时调整抗生素的使用。
除了上述治疗措施外,还需要对患者的器官功能进行支持治疗。
例如,对于呼吸功能障碍的患者,可能需要进行机械通气;对于肾功能衰竭的患者,可能需要进行血液净化治疗。
在治疗过程中,要密切监测患者的各项指标,包括生命体征、实验室检查结果、器官功能等。
同时,要根据患者的病情变化及时调整治疗方案。

脓毒症休克诊断标准
脓毒性休克诊断标准主要以体征、症状以及实验的检查三个方面来说的,脓毒性休克属于脓毒血症的一种,具体详情如下:
1、体征:脓毒血症的患者,一般正常体温是大于三十八点三摄氏度或者体温小于三十六摄氏度的;平均心率每分钟大于九十次;脓毒血症患者一般都有过度通气的表现,呼吸的频率比较慢,平均每分钟呼吸大于二十次。
2、症状:脓毒性休克的表现一般有精神状态不好、神志差,严重的情况就会出现休克的表现。
脓毒性患者的血糖浓度也处于持续升高的状态,平均血糖大于每公升十毫摩尔。
3、实验的检查:实验的检查得出是炎症的反映指标和组织的不良灌注,炎症的反映指标指的是反应蛋白升高,以及降钙素原升高。
因为脓毒血症有可能会引发高乳酸血症,会对组织的灌注造成不好的表现,从而使毛细血管的再灌注能力下降,导致出现少尿以及意识障碍等表现。
脓毒症与脓毒性休克脓毒症综合征是一个具有不同预后的临床连续体。
脓毒性休克是脓毒症最严重的并发症,死亡率高。
作为对一种激发剂的反应,免疫系统的促炎和抗炎与单核细胞、巨噬细胞和中性粒细胞的激活相一致,这些细胞通过病原体识别受体与内皮细胞相互作用,从而产生细胞因子、蛋白酶、激肽、活性氧和一氧化氮作为这种反应的主要部位,内皮细胞不仅受到微血管损伤,而且激活凝血和补体级联,进一步加重血管损伤,导致毛细血管渗漏。
这一系列事件导致了脓毒症的临床症状和体征,以及从脓毒症到脓毒症性休克的进展。
平衡促炎反应以消除入侵微生物的能力与控制整个炎症级联的抗炎信号的能力最终决定了患者的发病率和/或死亡率。
明智和早期使用抗菌药物、脓毒症集束化诊疗以及早期目标导向治疗对脓毒症相关死亡率有显著和积极的影响。
然而,早期识别仍是脓毒症治疗和管理的最佳治疗手段。
病因学2009年欧洲重症监护感染率(EPIC II研究)确定,革兰氏阴性细菌感染是脓毒症综合征最常见的病因,其发病率远远超过其他病因,其次是革兰氏阳性感染,占47%。
后者的患病率增加可能归因于更具侵入性的操作的执行以及医院感染的发生率增加。
患者中分离出的主要微生物包括金黄色葡萄球菌(20%),假单胞菌(20%)和大肠杆菌(16%)。
感染的主要部位包括呼吸道(42%),血液(21%)和泌尿生殖道(10%)。
在了解超过三分之一的患者从未培养阳性培养物的情况下,需要评估这些数据。
大型荟萃分析说明了细菌菌株和感染部位对死亡率的影响,在这项研究中,革兰氏阴性感染总体上与更高的死亡率有关。
然而,不动杆菌革兰氏阳性菌血症或葡萄球菌引起的肺炎的死亡率为40%,假单胞菌肺炎的死亡率最高,为70%。
由耐多药细菌菌株(耐甲氧西林的葡萄球菌(MRSA),耐万古霉素的肠球菌(VRE)引起的脓毒症综合征正在上升,目前的发病率高达25%;病毒和寄生虫引起的病例要少得多,在2%至4%的病例中被发现。
流行病学每年,脓毒症发病率几乎增加了9%。
脓毒症即是由感染所致的全身炎症反应综合征(SIRS),脓毒性休克是指在严重脓毒症基础上给予足量液体复苏后仍无法纠正的持续低血压状态,即微循环功能障碍未能纠正,伴或不伴组织灌注不良的表现,如酸中毒,意识障碍等,它是严重脓毒症的一种特殊类型。
脓毒性休克属于分布性休克,微循环功能障碍和心脏功能受抑制是循环系统损害的重要组成部分1.血管内皮损伤时毛细血管通透性增高,血管内液体分布到血管外间隙,造成有效循环量下降2.血管内皮损伤部位血小板,炎性细胞聚集及有效循环血容量下降后血液浓缩,血液淤滞造成微循环内血栓形成 3.血管内皮损伤时内皮素与输血管因子两者间平衡失调造成血管张力改变 4.脓毒性休克时心脏功能均受到抑制,脓毒性休克分为高排低阻与低排高阻两个阶段,首先休克发生时,循环血压迅速下降,引起代偿性微动脉收缩,心脏代偿性做功增加以提高心输出量,此时微动脉对舒血管物质,收缩血管物质及内皮介导的收缩反应降低,即是高排低阻阶段,微循环功能障碍时酸性物质堆积,造成代谢性酸中毒以及氧气在血液和组织细胞间的弥散距离增加,效率降低,造成组织缺氧,心肌细胞缺氧,酸中毒与心肌细胞缺氧可造成心肌收缩力下降,心脏功能受抑制,随着病程发展,心脏收缩功能进入失代偿期,心脏收缩功能进一步下降,心排量减少,并且微循环内血栓形成,即进入高排低阻阶段。
其中血管内皮损伤后内皮细胞活化异常是脓毒性休克时循环功能障碍的重要因素。
血管内皮损伤时血管通透性增加内皮细胞(EC)屏障功能丧失是脓毒性休克时微循环的核心特征,此时内皮细胞活化异常,循环内皮细胞(ECs)增加,此外大量炎症介质释放是EC 屏障功能丧失的重要因素,其中肿瘤坏死因子增加EC的通透性。
炎症介质与内皮细胞相互作用可诱导机体呈促凝血的特征,造成微循环血栓形成。
大量炎症介质释放,如肿瘤坏死因子,氧自由基等可诱导内皮细胞凋亡,内皮细胞通过产生舒血管因子一氧化氮(NO),前列环素(PGI2),收缩血管因子血栓素A2,内皮素(ET)和血小板活化因子(PAF)调节小动脉张力并调控血压。
脓毒症时舒血管因子与缩血管因子平衡失调造成血管张力异常,其中NO与ET产生增多,且血浆ET水平与脓毒症组织损伤程度成正比,PGI2生成减少。
综上所述微循环功能障碍的重要因素是血管内皮损伤,血管内皮损伤后内皮细胞活化异常,大量炎症介质释放造成内皮细胞通透性增加,EC平屏障功能丧失,炎症介质还可以使内皮细胞凋亡,与EC共同作用造成微循环血栓形成,EC产生的舒血管因子与缩血管因子平衡失调造成血管张力异常,以上因素共同造成微循环内有效循环血容量减少,在此基础上合并心脏收缩功能下降造成脓毒症时休克发生。
休克的本质是微循环功能障碍。
休克时组织缺血缺氧,无氧糖酵解发生,机体产生乳酸,因此可通过监测动脉血乳酸了解休克程度,判断预后。
在轻微细菌感染时降钙素原(PCT)4h开始升高,8-24h达高峰,较C反应蛋白更为敏感,SIRS时PCT升高更为明显,PCT水平可判断脓毒症程度及预后。
因此,脓毒性休克时监测血乳酸与PCT有指导治疗作用及判断病情预后。
对于脓毒症性休克治疗除病因治疗和给予足量的液体复苏,还应阻断血管内皮损伤因素,清除炎症介质,抑制EC与白细胞之间的相互作用,降低血管内皮通透性恢复血管内皮屏障功能,防治微循环血栓,清除氧自由基,稳定线粒体功能,拮抗内皮细胞凋亡及增强心肌收缩力。
针对以血管内皮为靶向的治疗是关键,乌司他汀,血必净等药物有清除炎症介质,减轻SIRS作用,糖皮质激素激素可能有抑制炎症介质释放作用,对改善伴随脓毒血症发生的免疫失调的瀑布反应有益,脓毒症患者相对肾上腺皮质功能不全的发生率高达50%~70%。
针对该情况,应用应激剂量的糖皮质激素可能是合理的,并得到研究的证实,能够减少升压药的使用,病死率降低10%。
而对那些肾上腺功能正常的病人却不能提高其存活率经足够的液体复苏治疗仍需升压药来维持血压的感染性休克病人,推荐静脉使用中小剂量的糖皮质激素,氢化可的松200~300 mg/d,疗程一般5~7天。
,糖皮质激素还有有稳定细胞膜与线粒体功能的作用。
维生素C可通过清除氧自由基与逆转脓毒症时微循环氧化反应从而达到拮抗EC凋亡目的。
在增强心肌收缩力治疗时血管活性药
物可提高有效循环血量,改善高排低阻的现象,首选药物为多巴酚丁胺与去甲肾上腺素。
和曾今使用的多巴胺相比较,多巴胺可兴奋β受体引起心率增快或心律失常,其正性肌力作用增加了心肌耗氧,而去甲肾上腺素对心率几乎无影响,不会增加心肌耗氧,还可增加门静脉血流与改善组织氧供,进而改善了脏器的微循环。
在此基础上还可以运用钙离子增敏剂,该药在增强心肌收缩力的同时不增加心肌细胞内的钙离子浓度,心率和心肌耗氧,还可以增加胃肠道血流,提高肌酐清除率增加尿量,降低血乳酸水平。
脓毒性休克治疗最初6小时为抢救的“黄金时间”,在1-2小时内使用强效广谱抗菌药物。
早期6小时应达到的治疗目标 1.CVP达8-12mmHg2.尿量达0.5ml/kg*h3.中心静脉血氧饱和度(ScVO2)或混合静脉血氧饱和度(SvO2)70%以上,外周静脉血氧饱和度93%以上4.平均动脉压65-75mmHg。
若复苏后CVP达到8-12mmHg,但ScVO2未达70%,需给予输入浓缩红细胞使红细胞压级提高至30%以上。