泛素
- 格式:doc
- 大小:78.50 KB
- 文档页数:17
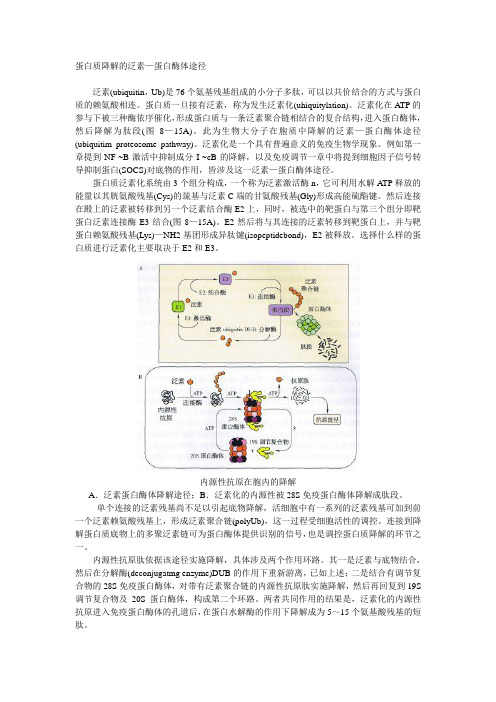
蛋白质降解的泛素—蛋白酶体途径泛素(ubiquitin,Ub)是76个氨基残基组成的小分子多肽,可以以共价结合的方式与蛋白质的赖氨酸相连。
蛋白质一旦接有泛素,称为发生泛素化(uhiquitylation)。
泛素化在A TP的参与下被三种酶依序催化,形成蛋白质与一条泛素聚合链相结合的复合结构,进入蛋白酶体,然后降解为肽段(图8—15A)。
此为生物大分子在胞质中降解的泛素—蛋白酶体途径(ubiquitim proteosome pathway)。
泛素化是一个具有普遍意义的免疫生物学现象。
例如第一章提到NF-~B激活中抑制成分I-~cB的降解,以及免疫调节一章中将提到细胞因子信号转导抑制蛋白(SOCS)对底物的作用,皆涉及这一泛素—蛋白酶体途径。
蛋白质泛素化系统由3个组分构成,一个称为泛素激活酶n,它可利用水解A TP释放的能量以其胱氨酸残基(Cys)的巯基与泛素C端的甘氨酸残基(Gly)形成高能硫酯键。
然后连接在殿上的泛素被转移到另一个泛素结合酶E2上,同时,被选中的靶蛋白与第三个组分即靶蛋白泛素连接酶E3结合(图8—15A)。
E2然后将与其连接的泛素转移到靶蛋白上,并与靶蛋白赖氨酸残基(Lys)—NH2基团形成异肽键(isopeptidebond),E2被释放。
选择什么样的蛋白质进行泛素化主要取决于E2和E3。
内源性抗原在胞内的降解A.泛素蛋白酶体降解途径;B.泛素化的内源性被28S免疫蛋白酶体降解成肽段。
单个连接的泛素残基尚不足以引起底物降解,活细胞中有一系列的泛素残基可加到前一个泛素赖氨酸残基上,形成泛素聚合链(polyUb),这一过程受细胞活性的调控。
连接到降解蛋白质底物上的多聚泛素链可为蛋白酶体提供识别的信号,也是调控蛋白质降解的环节之一。
内源性抗原肽依据该途径实施降解,具体涉及两个作用环路。
其一是泛素与底物结合,然后在分解酶(deconjugatmg enzyme)DUB的作用下重新游离,已如上述;二是结合有调节复合物的28S免疫蛋白酶体,对带有泛素聚合链的内源性抗原肽实施降解,然后再回复到19S 调节复合物及20S蛋白酶体,构成第二个环路。

泛素化的作用
泛素化是指从特殊的情况、实例、数据中提取出普遍规律或共性的过程。
泛素化在很多领域中具有重要的作用,如下所示:
1. 知识发现:通过泛素化,可以从大量的特定实例中总结出普遍规律,从而发现新的知识。
这对于科学研究、数据挖掘、机器学习等领域具有重要意义。
2. 案例泛化:在实际问题中,泛素化可以将多个具体案例中的共同特征提取出来,形成一个通用的模型,从而可以对新的案例进行预测或决策。
这在医疗诊断、工程设计、风险评估等领域具有应用价值。
3. 数据压缩:通过泛素化,可以将冗长的数据压缩成更简洁的表示形式,从而减少存储空间和传输成本。
例如,图像压缩算法利用图像中的共性特征进行泛素化,从而减少图像文件的大小。
4. 抽象化:泛素化有助于提取出实例中的核心特征,从而去除冗余信息,提取出问题的本质特征。
这有助于简化问题的分析和解决过程,提高问题的处理效率。
5. 模型建立:在机器学习等领域中,泛素化是建立模型的关键步骤。
通过将训练数据中的具体实例进行泛素化,可以得到一个能够适应未知数据的通用模型。
总而言之,泛素化在知识发现、案例泛化、数据压缩、抽象化和模型建立等方面
具有重要作用,可以帮助我们从具体实例中提取出共性规律,简化问题的处理过程,提高问题的解决效率。

泛素名词解释生物化学
泛素是一种小分子蛋白质,它在生物体内起着重要的调节作用。
它被称为细胞内的“生物化学开关”,能够调控细胞内的蛋白质降解、修复和信号传导等生物过程。
泛素的命名源于它的广泛存在性,被发现几乎存在于所有真核生物的细胞中。
泛素由76个氨基酸组成,其独特的结构决定了它的功能和调控机制。
泛素主要通过共价结合到目标蛋白上来发挥作用。
泛素的共价结合是通过酶系统来实现的,其中最重要的是泛素连接酶(E1)、泛素转移酶(E2)和泛素连接酶(E3)。
泛素连接酶(E1)首先与泛素结合形成泛素酰腺嘌呤复合物,然后将泛素转移到泛素转移酶(E2)上。
最后,泛素连接酶(E3)将泛素从泛素转移酶(E2)转移到目标蛋白上。
泛素化的目标蛋白可以被降解或修复。
当目标蛋白受到损伤或超过需要时,泛素连接酶(E3)能够将泛素结合到目标蛋白上,从而标记其为待降解的蛋白。
随后,被泛素化的蛋白会被蛋白酶体或蛋白酶降解体降解。
这个过程被称为泛素-蛋白质降解系统,是维持细胞内蛋白质稳态的重要机制之一。
另一方面,泛素化还可以参与细胞内的信号传导。
例如,一些转录因子在没有泛素化时无法发挥作用,而泛素化后能够与其他蛋白结合形成复合物,从而调控基因表达。
此外,泛素化还可以调节蛋白质的定位、活性和相互作用等,影响细胞
内的各种生物过程。
总的来说,泛素作为一种重要的生物分子,在生物化学中扮演着关键的角色。
它通过共价结合到目标蛋白上,调节蛋白质的降解、修复和信号传导等生物过程,对维持细胞内的稳态和功能发挥着重要作用。

蛋白泛素化研究套路蛋白泛素化是细胞内重要的修饰方式,也是细胞内蛋白质降解的重要途径。
泛素(Ubiquitin)是一种小分子蛋白,其通过和目标蛋白形成泛素化复合物,标记这些蛋白进行降解或其他功能性改变。
蛋白泛素化在调节细胞周期、细胞信号转导、DNA修复、免疫应答等生命活动过程中发挥着重要的作用,对各种疾病的发生发展也有一定影响。
研究蛋白泛素化机制对于深入理解细胞生物学和探讨相关疾病发生机制具有重要意义。
一般来说,进行蛋白泛素化研究需要遵循一系列的实验套路。
本文将详细介绍蛋白泛素化研究的套路,包括蛋白泛素化实验的设计、样品制备、实验操作和数据分析等内容。
希望通过本文的介绍,能够帮助研究人员更好地开展蛋白泛素化研究工作。
进行蛋白泛素化研究需要明确研究目的和问题,确定所选取的研究对象。
一般来说,可以选择已知相关泛素化酶或底物蛋白作为研究对象,也可以通过高通量筛选等方法寻找新的泛素化底物。
在确定研究对象后,需要设计实验方案,包括实验组的设置、处理方案、实验时间点等内容。
进行蛋白泛素化研究需要进行样品的制备。
样品制备的关键是提取蛋白或核酸,以便后续实验操作。
在提取样品的过程中,需要特别注意细胞或组织的裂解方式和条件,以保证蛋白或核酸的完整性和纯度。
接着,进行实验操作。
蛋白泛素化研究的实验操作包括多个环节,主要包括蛋白间相互作用的检测、泛素连接底物蛋白的检测以及蛋白泛素化酶的鉴定等。
在实验操作中,需要严格控制实验条件,保证实验结果的准确性和可靠性。
进行数据分析及结果解读。
在蛋白泛素化研究中,数据分析通常包括原位杂交、免疫共沉淀、蛋白质质谱等技术的应用。
通过对实验数据的分析,可以得到关于蛋白泛素化的一系列结果,包括蛋白相互作用的网络、底物蛋白的变化、泛素连接底物蛋白的位置等。
在结果解读过程中,需要综合考虑实验数据、文献资料等多方面信息,从而得出合理的结论。
蛋白泛素化研究是一个复杂而系统的工作,需要研究人员在实验设计、样品制备、实验操作和数据分析等各个环节都进行严格把关。

泛素依赖的蛋白质降解途径概述泛素依赖的蛋白质降解途径是细胞内一种重要的蛋白质降解机制。
在这个途径中,泛素被连接到待降解的蛋白质上,然后通过泛素连接酶系统和蛋白酶体进行降解。
这一途径在维持细胞内蛋白质稳态、调控细胞周期和应激响应等方面起着重要的作用。
泛素连接酶系统泛素连接酶系统是泛素依赖的蛋白质降解途径的关键组成部分,它包括泛素激活酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)。
泛素激活酶(E1)泛素激活酶是泛素连接酶系统的起始酶,它能够将游离的泛素与ATP结合形成泛素-AMP中间体,然后将泛素转移至泛素结合酶(E2)上。
泛素结合酶(E2)泛素结合酶是泛素连接酶系统中的中间酶,它能够与泛素激活酶(E1)和泛素连接酶(E3)相互作用,将泛素从泛素激活酶转移至泛素连接酶。
泛素连接酶(E3)泛素连接酶是泛素连接酶系统中的最后酶,它能够与泛素结合酶(E2)和待降解的蛋白质相互作用,将泛素连接到待降解的蛋白质上。
泛素连接酶的家族非常庞大,不同的泛素连接酶对不同的蛋白质具有特异性。
泛素化泛素化是将泛素连接到待降解的蛋白质上的过程。
泛素化是一个级联的反应过程,需要泛素激活酶、泛素结合酶和泛素连接酶的协同作用。
泛素连接酶的选择性不同的泛素连接酶对不同的蛋白质具有特异性,这种选择性是通过泛素连接酶与待降解蛋白质的相互作用来实现的。
泛素连接酶通过与待降解蛋白质的结构域或特定的氨基酸残基相互作用,选择性地将泛素连接到蛋白质上。
泛素连接点泛素可以连接到待降解蛋白质的不同位置,形成多种不同类型的泛素连接。
最常见的泛素连接方式是将泛素连接到蛋白质的赖氨酸残基上,形成K48链。
K48链是一个信号标记,会被蛋白酶体认识并降解。
此外,泛素还可以连接到蛋白质的其他氨基酸残基上,形成K63链或单一的泛素连接。
蛋白酶体蛋白酶体是细胞内的一种细胞器,主要负责泛素依赖的蛋白质降解。
蛋白酶体由核心颗粒和相关蛋白组成,核心颗粒是由多个蛋白酶组成的大复合物。
泛素化相关的结构域概述说明以及解释1. 引言1.1 概述泛素化是一个重要的细胞信号传导过程,调控了诸多细胞过程包括蛋白质降解、DNA修复、细胞周期调控等。
在泛素化过程中,蛋白质与泛素结合形成共价连接,从而发挥其特定功能。
而在泛素化相关的结构域则是特定蛋白质上存在的一些结构模块,可以通过相互作用参与到蛋白质的泛素化过程中。
1.2 文章结构本文将分为五个主要部分来进行论述。
首先,在引言部分我们将对文章整体内容进行概述和介绍。
接下来,在第二部分中将详细阐述泛素化相关的结构域及其分类情况。
然后,在第三部分中我们将进一步说明这些结构域的具体特征和功能,并回顾相关领域研究进展。
在第四部分中,我们会声明这些泛素化相关的结构域的重要性,并讲解其在细胞信号传导、疾病发生发展以及药物开发中的应用价值。
最后,在第五部分我们会对全文进行总结并回顾文章主要内容。
1.3 目的本文旨在提供一个全面的概述和解释泛素化相关的结构域。
通过对这些结构域的分类、特征和功能进行说明,我们希望读者能够更好地理解它们在细胞信号传导中的作用机制。
此外,我们也将探讨这些结构域与疾病发生发展以及药物开发之间的关联,以期为未来的研究和应用提供参考和启示。
2. 泛素化相关的结构域概述2.1 什么是泛素化相关的结构域泛素化相关的结构域是指在细胞中参与蛋白质降解和信号传递的关键蛋白质结构域。
它们能够识别和与泛素连接酶(E3)相互作用,并通过该相互作用将目标蛋白质上的泛素修饰,从而调控其功能、定位和稳定性。
由于其在细胞代谢、基因表达、细胞周期和免疫应答等生物学过程中的重要作用,对泛素化相关的结构域进行深入研究具有重要意义。
2.2 结构与功能关系泛素化相关的结构域通常具有特定的二级和三级结构特征,如α/β-折叠、β片层等。
这些特征使得该结构域能够与其他蛋白质相互作用,并在多种生物学过程中发挥调控功能。
例如,一些泛素连接酶(E3)上存在RING(Really Interesting New Gene)指环结构域,该结构域能够识别目标蛋白质并催化其与泛素的结合。
泛素化水平检测方法有哪些,各自的优缺点是什么?随着生物制药领域的不断发展,对蛋白质调控机制的研究变得越来越重要。
在这个过程中,泛素化水平检测成为了一项关键技术,帮助科学家们理解泛素系统的功能以及蛋白质降解与细胞过程之间的关联。
本文将介绍几种常用的泛素化水平检测方法,并探讨它们各自的优缺点和应用前景。
图1。
1.免疫印迹(Western Blotting)。
免疫印迹是一种常用的泛素化水平检测方法,它利用特异性抗体识别和结合泛素化修饰的蛋白质。
这种方法操作简便,需要的实验材料相对简单。
然而,免疫印迹对于低丰度的泛素化修饰蛋白质可能不够敏感,并且无法提供定量信息。
2.质谱分析法(Mass Spectrometry)。
质谱分析法是一种高效的泛素化水平检测方法,它可以对泛素化修饰蛋白质进行定性和定量分析。
通过质谱仪的测量,可以准确地确定泛素化修饰的位置和泛素链的长度。
然而,质谱分析法的设备昂贵,技术要求较高,需要专业的数据分析和解释。
3.免疫沉淀法(Immunoprecipitation)。
免疫沉淀法是一种将泛素化修饰蛋白质与特异性抗体结合,然后通过沉淀将目标蛋白质从混合物中分离出来的方法。
免疫沉淀法可以用于分析泛素化修饰蛋白质与其他蛋白质之间的相互作用,但对于泛素化修饰的蛋白质复杂性较高的样品,可能存在特异性和纯度的挑战。
4.紫外可见光谱法(UV Spectroscopy)。
紫外可见光谱法是一种测定泛素化修饰蛋白质浓度的常用方法。
通过测量特定波长下的吸光度,可以间接地推断泛素化修饰蛋白质的浓度。
然而,紫外可见光谱法只能提供浓度信息,无法提供泛素化修饰的具体位置和类型。
5.荧光共振能量转移法(Fluorescence Resonance Energy Transfer)。
荧光共振能量转移法是一种利用荧光标记分子之间的能量传递来检测泛素化修饰的方法。
它可以用于实时监测泛素化修饰的动态变化,并提供定量和定位信息。
泛素化试验步骤1.什么是泛素化试验泛素化试验(Ubiquitination assay)是一种研究泛素修饰作用的实验技术。
泛素是一种小分子蛋白,可以选择性地附加到其他蛋白上,对其进行标记,以促进它们的降解、修复和调节等功能。
泛素化试验可以用于研究泛素化过程的机制、泛素化的底物和酶、以及泛素化和其他生物学过程之间的相互作用等方面。
2.泛素化试验步骤2.1.突变和荧光标记的构建首先,需要构建带有突变或荧光标记的泛素和底物蛋白。
这通常通过克隆和基因工程技术进行。
例如,可以在泛素的K48位点上构建荧光标记,以便在下一步实验中监测底物蛋白的泛素化修饰。
2.2.固相分析接下来,需要进行固相分析,以评估底物蛋白的泛素化修饰水平。
这通常涉及在一个固相上固定底物蛋白,并向其添加泛素化酶和泛素化反应所需的其他材料。
底物蛋白和泛素可以在体外或体内进行泛素化修饰。
然后,用特定的抗体或荧光探针检测泛素化修饰水平。
2.3.在体修饰此外,可以进行在体修饰,以评估底物蛋白在细胞内的泛素化修饰水平。
这通常涉及将带有荧光标记的底物蛋白转染到细胞中,然后在不同条件下进行培养,以评估泛素化修饰的水平。
例如,在添加特定抑制剂的情况下,其影响底物蛋白的泛素化修饰水平等。
3.结论泛素化试验是一种关键的实验技术,可用于研究泛素化修饰在细胞生物学和生物化学过程中的作用和机制。
通过构建突变和荧光标记的泛素和底物蛋白,并进行固相分析和在体修饰,可以评估底物蛋白的泛素化修饰水平,并研究其在不同条件下的变化和影响。
这种技术的发展有望为生物学和医学研究提供更多的思路和方法。
e2在泛素降解过程中的作用
e2在泛素降解过程中扮演着重要的角色。
泛素是一种小蛋白质,它可以通过与特定底物结合并被添加到底物上,从而标记底物进行降解。
这个过程被称为泛素化。
泛素化是由一系列酶系统完成的,包括泛素激活酶(E1)、泛素
连接酶(E2)和泛素连接酶(E3)。
E2是其中的一个重要组成部分,它起着连接底物和泛素的桥梁作用。
具体来说,E2首先与泛素激活酶(E1)结合,形成一个E1-E2-
泛素复合物。
然后,E2与特定的泛素连接酶(E3)结合,这个
E2与E3的结合会对特定的底物产生准确的识别和选择性。
最后,底物与泛素复合物结合,形成泛素化的底物。
另外,一部分E2也可以直接与底物结合,起到泛素连接酶的
双重角色,即既能与底物结合,又能与泛素结合。
总之,E2在泛素降解过程中的作用是连接底物和泛素,为底
物的泛素化提供必要的桥梁,并参与与泛素连接酶的协同作用,确保底物的准确选择和特异性标记。
泛素-蛋白酶体途径及研究进展【摘要】泛素-蛋白酶体途径介导的蛋白降解是机体调节细胞内蛋白水平与功能的一个重要机制。
负责执行这个调控过程的组成成分包括泛素及其启动酶系统和蛋白酶体系统。
泛素启动酶系统负责活化泛素, 并将其结合到待降解的蛋白上, 形成靶蛋白多聚泛素链, 即泛素化。
蛋白酶体系统可以识别已泛素化的蛋白并将其降解。
此外, 细胞内还有另一类解离泛素链分子的去泛素化蛋白酶形成反向调节。
泛素-蛋白酶体途径涉及许多细胞的生理过程, 其调节异常与多种疾病的发生有关。
【关键词】泛素化去泛素化类泛素化一.泛素及其启动酶系统泛素-蛋白酶体途径( Ubiquitin-Proteasome pathway )是一个新近受到关注的调节蛋白质降解与功能的重要系统。
其主要作用于细胞内一些半衰期短的调节蛋白和一些结构异常、错构或受损伤的蛋白。
其过程是以共价键形式联结多个泛素( ubiquitin)分子, 形成靶蛋白多聚泛素链即泛素化后, 再输送到26S 蛋白酶体上被消化降解。
这一途径在很多细胞生命过程中起调节作用, 包括细胞周期循环、信号转导、核酸密码翻译、DNA 损伤修复、异常蛋白代谢、抗原递呈及细胞受体功能等, 并与许多疾病的发生发展密切相关。
因此对该系统的调节及其意义的研究已成为医学研究的一个热点。
泛素是由76个氨基酸组成的球形热稳定蛋白,其结构在真核细胞中高度保守。
在不同生物体间组成泛素的氨基酸序列差别很小, 如酵母和人的泛素仅有3个氨基酸序列的差别。
泛素能以自由的形式存在, 也能和其他蛋白形成复合物。
泛素是通过一系列泛素启动酶的作用而与靶蛋白连接的。
泛素启动酶包括E1 泛素激活酶、E2 泛素结合酶、E3 泛素连接酶。
首先, 在ATP参与下, 游离的泛素被E1激活, 即E1的半胱氨酸残基与泛素的C末端甘氨酸残基形成高能硫酯键。
然后,活化的泛素被转移到E2的活性半胱氨酸残基上, 形成高能硫酯键。
接着, E2再将泛素传递给相应的E3。
E3可直接或间接地促进泛素转移到靶蛋白上, 使泛素的C末端羧酸酯与靶蛋白赖氨酸氨基形成异肽键,或转移到已与靶蛋白相连的泛素上形成多聚泛素链。
以上即泛素化过程。
在该途径中, E3是通过识别和结合特异的靶蛋白序列或降解决定子(degron: 决定某一蛋白发生降解或部分降解的序列)来特异性地调节靶蛋白的降解代谢。
根据识别靶蛋白序列中结构域不同, E3又分为两类: (1)HECT 型E3连接酶, HECT 结构域包含保守的350个氨基酸。
该结构域上的半胱氨酸残基与泛素的硫酯键连接形成复合物U b-E3作为过渡, 再将泛素转移到靶蛋白上。
(2) RING-finger E3连接酶, 包括c-Cb1, APC和SCF, 在泛素转运过程中都不直接与Ub形成过渡的蛋白复合物, 而且都包含一个RING-finger结构域或一个结构相关的结构域,例如U-box 结构域。
RING结构域可以与Ub-E2形成复合体, 随后直接将Ub转移至靶蛋白上。
二.26S蛋白酶体系统蛋白酶体定位于胞核和胞质内。
26S蛋白酶体是由2个环状的19S亚单位和1个20S微粒体状的亚单位组成。
19S亚单位由包含6 个AAA-ATP 酶的碱性亚复合体和包含8个非ATP酶的亚复合体组成。
它的功能是识别泛素化的靶蛋白并在其进入20S复合体前对其进行去泛素化、打开折叠和移位。
20S催化核心有4 个环叠成圆筒状结构, 其中两侧外环由1~ 7亚单位组成, 两个内环由1~ 7亚单位组成, 4个环的中央形成一个狭窄的孔。
亚单位促使底物移位进入中央孔隙水解中心, 并使20S复合体和19S调节复合体之间发生构象改变。
亚单位N末端苏氨酸残基是蛋白酶体的水解中心, 但是不同的亚单位有不同的蛋白酶活性, 包括胰蛋白酶样、糜蛋白酶样和半胱氨酸蛋白酶样活性,分别能裂解羧基端碱性、疏水性或芳香性和酸性氨基酸残基, 从而消化底物, 释放出短肽碎片。
蛋白酶体被认为是细胞内的再生与回收中心,泛素化的靶蛋白在此被分解为短肽和氨基酸, 而泛素被回收再利用。
2. 1.蛋白质降解的泛素化调节研究发现, 蛋白质带有某些能被泛素系统识别的信号, 这些信号包括: (1) N-degron: 早在1986年, Varshavsky等进行了一系列试验, 提出了N-末端规则, 即通过蛋白质N-末端的氨基酸来预测它的半衰期, 如蛋白质N-末端是丝氨酸, 半衰期可以长达20 h; 相反,如果是天冬氨酸, 半衰期只有3min。
但N-degron如何启动并标记泛素的机制还不清楚。
(2)有些氨基酸序列是降解的信号: PEST序列是其中之一, 在短短8个氨基酸的片段上, 富含脯氨酸、谷氨酸、丝氨酸和苏氨酸。
如转录因子Gcn4p, 有281个氨基酸, PEST 序列位91~106, 此蛋白正常的半衰期大约为5min,如果将PEST 序列移除,半衰期增加到50min。
此外,有时信号也可能隐藏在疏水核心中或被掩盖。
当一些蛋白以天然状态存在时, 信号被隐藏, 蛋白不被降解。
但蛋白结构出现变化如出现部分解链区,信号就会暴露而被泛素系统发现并降解。
这就是为何部分折叠、异常和突变蛋白易被降解的原因。
目前, 泛素-蛋白酶体途径对蛋白质降解信号的识别和它们被标记的具体机制仍然不清楚。
2. 2.去泛素化酶系统特异性的去泛素化酶主要有两大类: (1)泛素羧基末端水解酶家族( ubiquit in C-term inal hydro lases, UCH s) , 属于半胱氨酸蛋白酶。
UCHs通常是小分子蛋白, 包括UCHL-1, -2,-3等分子。
UCH s可以通过裂解C 末端76位甘氨酸将泛素分子从小的多肽底物上释放出来。
现已发现UCH s与一些疾病及肿瘤关系密切。
如UCHL-1 主要分布在神经组织, 与帕金森病等发病有关; (2)泛素特异性修饰酶家族( ubiquit in-specific processing enzymes, UBPs) 包括U bp-M, UBP41, UBP4, HAUSP, ISOT1等, 这些酶分子都含有2 个短而保守的片段即Cys盒和H is盒, 包括了所有有催化作用的残基,UBPs能将泛素分子从大的蛋白上移除。
总之, 两组酶都能催化水解泛素分子C 末端的多肽链连接, 起到去泛素化作用。
目前, 利用泛素化或去泛素化来调控细胞内蛋白质的水平, 并影响其功能已成为蛋白质研究的一个重要策略。
如已知P53的泛素化降解与许多肿瘤发生相关。
1997年发现UBP成员疱疹病毒相关泛素特异性蛋白酶( herpesvirus-associated Ub-specific protease, HAUSP)与细胞核内分子结合, 与前髓细胞白血病发病相关, 随着研究的深入, Muyang等证实HAU SP能特异性结合P53泛素化链, 使其去泛素化, P53降解减少, 稳定性增强,并抑制肿瘤细胞的生长。
三.蛋白质降解的泛素化调节和去泛素化调节研究证实, 细胞内80% ~ 90% 的蛋白通过泛素-蛋白酶体途径降解。
泛素的靶蛋白包括: 细胞周期调节因子、肿瘤抑制因子、转录激活因子和抑制因子、细胞表面受体以及突变或受损蛋白质, 通过以上靶蛋白的多聚泛素化并经蛋白酶体降解后, 可以影响或调节多种细胞活动。
但随着对泛素-蛋白酶体途径的研究深入, 进一步发现蛋白泛素化调节是一个可逆的过程。
细胞内同时还存在一些特异的去泛素化蛋白酶进行负向调节3.1.泛素化途径与细胞周期由依赖于SCF的泛素化途径参与降解的与细胞周期有关的蛋白Cyc lin D是细胞周期中Gl期向S期过渡的重要的调控因子, 它与CDK4 、6结合, 使Rb发生磷酸化而失活, 释放出转录因子EZF,转录因子进入细胞核内, 转录出介导Gl期向期过渡的调控因子。
如果Cyclin D l过量表达, 则会导致细胞加速通过Gl期和S期。
研究发现Cy-elin Dl 的降解是由于CDC34和SCFskpZ相互作用的结果。
在Gl期, Cychn Dl定位于细胞核上;在S 期,Cychn Dl则定位于细胞质上。
如果使定位于细胞核上的Cyclin Dl第268位上的氨基酸发生磷酸化, 则会使在S期定位于细胞质上的Cyclin DI被泛素化降解。
如果使Cyelin Dl 第268 位氨基酸发生突变, 突变的Cycln Dl会定位于细胞核中, 并且一直表达图。
这说明Cyclin Dl通过泛素化途径降解可能受到细胞定位和磷酸化两个方面的调控。
但是关于Cychn Dl降解的生物学意义还在研究中。
cycln E在Gl期的晚期到S期的早期与CDK Z相结合, 启动了DNA 的复制。
如果在细胞中Cyclin E过度表达, 会使细胞提早进入S 期, 造成细胞基因组的不稳定和肿瘤的形成。
有研究证明,无论是独立存在的Cychn E, 还是与CDK Z 结合的Cyclin E都是通过泛素化途径降解的。
Nakayajna等发现在小鼠中, 如果Cullins和基因失活, 会造成细胞中Cychn E含量的增加, 这说明与CDK Z结合的Cychn E是由依赖S CF的泛素化途径降解的。
如果使与CDK Z结合的Cychn E在第380位的苏氨酸上发生磷酸化, 则Cychn E被泛素化, 进而被降解。
而独立存在的Cychn E的降解不需要被磷酸化, 它的降解模式与处于结合状态的Cy-elil, E 是不同的。
研究发现, Fbw 7 / hCed 4 / Ago (属于F一box proteins 家族的蛋白质) 的变异会阻止Cy-eli, I E 被泛素化降解。
对Fbw 7/ hCed 4 / Ago变异的研究也暗示F 一box proteins 变异是人类肺癌和卵巢癌的致病机理。
3.2.泛素化和磷酸化协同作用调控蛋白质降解越来越多的研究发现,丝氨酸和苏氨酸的磷酸化可以使底物蛋白质迅速经泛素蛋白酶体途径降解,一种叫。
在细胞外信号的刺激下,可诱导的磷酸化使得泛素化机器能够识别磷酸化底物并对底物进行泛素化标记,从而启动蛋白质降解。
真核生物的细胞周期是高度有序的调控过程,参与细胞周期调控的的主要调节因子包括:!细胞周期蛋白,因其含量在细胞周期中呈周期性变化而被发现并得名;细胞周期蛋白依赖性激酶的激酶活性被顺序激活,从而驱动细胞周期周而复始地转动,细胞不断增殖;#细胞周期蛋白依赖性激酶抑制因子,与结合并抑制其活性。
3.3.泛素化介导的非蛋白质降解功能基因组频繁地受到外部的(如辐射)和内部的(如复制错误)各种损伤因子作用,引起损伤,因此DNA修复是保持基因组完整性所必需的.1987 年发现DNA 修复基因RAD6编码Ub 结合酶(E2),第一次揭示了Ub 在DNA 修复中的作用。