第三节化学平衡2
- 格式:doc
- 大小:130.00 KB
- 文档页数:9

第3节化学平衡第2课时化学平衡移动勒夏特列原理基础训练1.下列措施有利于反应:N2(g)+3H2(g)2NH3(g)ΔH=-92 kJ·mol-1平衡向正反应方向移动的是()①升高温度②降低温度③增大压强④减小压强⑤增大NH3浓度⑥减小NH3浓度A.②④⑥B.①③⑥C.②③⑤D.②③⑥解析:该反应为一个体积减少的放热反应;①升高温度,平衡左移;②降低温度,平衡右移;③增大压强,平衡右移;④减小压强,平衡左移;⑤增大NH3浓度,平衡左移;⑥减小NH3浓度,平衡右移;故②③⑥符合题意,D正确。
答案:D2.下列变化不能用勒夏特列原理解释的是()A.氯水宜保存在低温、避光条件下B.H2、I2、HI混合气体加压后颜色变深C.SO2催化氧化成SO3的反应,往往加入过量的空气D.打开汽水瓶,看到有大量的气泡逸出解析:A.存在Cl2+H2O HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水宜保存在低温、避光条件下,能用勒夏特列原理解释,故A不选;B.H2、I2、HI三者的平衡,增大压强平衡不移动,但浓度增大,则颜色加深,不能用勒夏特列原理解释,故B选;C.存在平衡2SO2(g)+O2(g)2SO3(g),加入过量的空气,平衡向正反应方向移动,提高二氧化硫的转化率,能用勒夏特列原理解释,故C不选;D.因溶液中存在二氧化碳的溶解平衡,打开汽水瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故D不选。
答案:B3.在密闭容器中发生反应a A(g)c C(g)+d D(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述中正确的是()A.平衡向正反应方向移动B.a<c+dC.D的体积分数增大D.A的转化率变大解析:气体体积压缩到原来的一半,即压强增大到原来的2倍,若平衡不移动,D的浓度应为原来的2倍,但事实上D的浓度为原来的1.8倍,即平衡向逆反应方向移动,则有a<c+d,从而使A的转化率减小,D的体积分数减小。



化学平衡的移动1、在密闭容中发生下列反应a A(g) c C(g)+d D(g),压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是( )A.A的转化率变大B.平衡向正反应方向移动C.D的体积分数变大D.a<c+d2、下图表示一定条件下N2+3H22NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是()A.加压B.升温C.加入催化剂D.增大反应物浓度3、现有m A(s)+n B(g)q C(g) ΔH<0的可逆反应,在一定温度下达平衡时,B的体积分数φ(B)和压强p的关系如图所示,则有关该反应的下列描述正确的是( )A.m+n<qB.n>qC.x点的混合物中v正<v逆D.x点比y点的正反应速率小4、可逆反应aA(g)+bB(s)cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是()A.使用催化剂,C的物质的量分数增加B.升高温度,平衡向正反应方向移动C .化学方程式的系数a <c +dD .根据图像无法确定改变温度后平衡移动方向5、一定条件下,通过下列反应可以制备特种陶瓷的原料MgO :()()4MgSO s CO g +()()()22MgO s CO g SO g ΔH ++>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x 的值,重新达到平衡后,纵坐标y 随x 变化趋势合理的是( )选项 xyA . 4MgSO 的质量(忽略体积) CO 的转化率B . CO 的物质的量2CO 与CO 的物质的量之比C . 2SO 的浓度 平衡常数KD .温度 容器内混合气体的密度6、下列事实中,不能应用化学平衡移动原理来解释的是( ) ①可用浓氨水和NaOH 固体快速制氨气 ②700K 左右比室温更有利于合成氨反应 ③开启啤酒瓶后,瓶中马上泛起大量泡沫 ④温度升高水的K W 增大 ⑤对于反应2HI(g) H 2(g)+I 2(g)达平衡后,缩小容器体积可使体系颜色变深 A. ①②③B. ②④⑤C. ②⑤D. ④⑤7、对于可逆反应:2AB 3(g) A 2(g)+3B 2(g) ΔH > 0,下列图象中正确的是( )A. B. C. D.8、在一密闭容器中,反应a A(g)b B(g)+c C(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A 的物质的量的浓度变为原来的50%,则( )A .平衡向正反应方向移动B .a >b +cC .物质B 的质量分数增大D .以上判断都错误9、探究浓度对化学平衡的影响,实验如下:I.向5mL 0.05mol/L 3FeCl 溶液中加入5mL 0.05mol/L KI 溶液(反应a),平衡后分为两等份 II.向一份中加入饱和KSCN 溶液,变红(反应b);加入4CCl ,振荡、静置,下层显极浅的紫色 III.向另一份中加入4CCl ,振荡、静置,下层显紫红色 结合实验,下列说法不正确是( ) A.反应a 为:3+-2+22Fe +2I 2Fe +I ƒ B.II 中,反应a 进行的程度大于反应b C.比较氧化性:II 中,3+2I >Fe D.比较水溶液中2+(Fe ):c II<III10、温度为T 时,向2.0L 恒容密闭容器中充入1.0mol PCl 5,反应PCl 5(g)PCl 3(g)+ Cl 2(g)经过一段时间后达到平衡。

第二章第三节化学平衡一、可逆反应1.定义:在条件下向正、反两个方向进行的反应,用符号表示。
2.特征:(1)可逆反应正、逆反应的条件是。
(2)相同条件下,正反应和逆反应。
(3)一定条件下,反应物不可能全部转化为生成物,反应物和生成物。
(4)若正反应是放热反应,则逆反应为。
例1:判断下列反应,属于可逆反应的是。
①二氧化硫的催化氧化②氮气和氢气的化合③水的电解④可燃物的燃烧⑤氨气溶于水⑥氯气溶于水⑦二氧化硫和水的反应⑧三氧化硫和水的反应⑨铁置换硫酸铜溶液中的铜⑩二次电池的充电和放电例2:在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是()A.Z为0.3 mol·L-1B.X2为0.2 mol·L-1C.Y2为0.4 mol·L-1D.c(X2)+c(Y2)+c(Z)=0.55 mol·L-1二、化学平衡状态1.化学平衡状态的建立在200 ℃时,将1 mol H2(g)和2 mol I2(g)充入到体积为V L 的密闭容器中,发生反应:I2(g)+H2(g) 2HI(g)(1)反应刚开始时,化学反应速率___________最大,而__________最小(为零)。
(2)随着反应的进行,v正____________,而v逆____________。
(3)某一时刻,当反应进行到_______________时,此可逆反应就达到了平衡。
2.化学平衡状态在一定条件下,当一个可逆反应进行到和相等,反应物与生成物时的状态。
例3:在一定条件下,某容器内充入N2和H2合成氨,以下叙述中错误的是 ( )A、开始反应时,正反应速率最大,逆反应速率为零。
B、随着反应的进行,正反应速率减小,最后降为零。


第三节化学平衡(第二课时)教学目标:正确理解浓度、温度对化学平衡的影响,并能利用勒夏特列原理加以解释。
教学重点:理解浓度、温度对化学平衡的影响。
教学难点:勒夏特列原理的归纳总结。
教学过程【引入】:我们知道:不同温度下物质的溶解度不同。
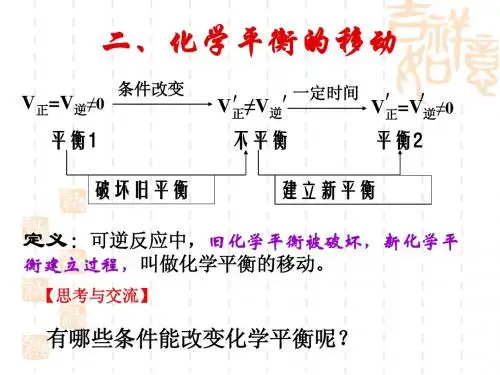
那么对于t0时达到溶解平衡状态的饱和溶液,当升高或降低温度至t1时:若:溶解度增大,固体溶质继续溶解,则V(溶解)V(结晶)溶解度减小,固体溶质析出,则V(溶解)V(结晶)那么溶解平衡状态被打破,继而建立一种新的溶解平衡,也就是说:条件改变,溶解平衡移动。
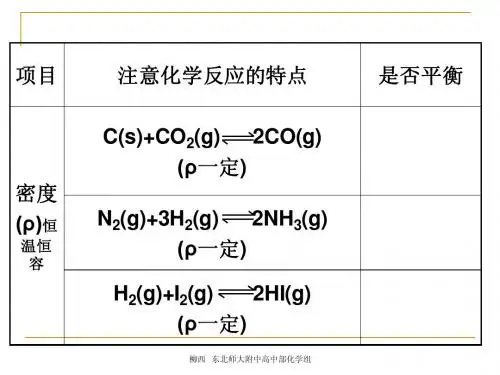
那么:化学平衡是否也只有在一定条件下才能保持?当条件(浓度、压强、温度等)改变时,平衡状态是否也会发生移动?【实验探究一】:探究浓度变化对化学平衡的影响实验原理:已知在K2Cr2O7的溶液中存在如下平衡:Cr2O72-+ H2O 2CrO42-+ 2H+K2Cr2O7为橙色,K2CrO4为黄色。
实验步骤:①取两支试管各加入5ml0.1mol/L K2Cr2O7溶液,然后按下表步骤操作,观察并记录溶液颜色的变化。
步骤滴加3~~10滴浓H2SO4滴加10~~20滴6 mol/LNaOHK2Cr2O7溶液实验结论:V 正V 逆 V 逆V 正V ′正V ′逆【实验探究二】:探究浓度变化对化学平衡的影响实验原理:Fe 3++3SCN -Fe (SCN )3 (红色)实验步骤:向盛有5 ml 0.005mol/L FeCl 3溶液的试管中加入5 ml 0.01mol/L KSCN 溶液,溶液显红色。
(1)将上述溶液均分置于两支试管中;向其中一支试管中加入饱和FeCl 3溶液4滴,充分振荡,观察溶液颜色变化;向另一支试管滴加4滴1 mol/L KSCN 溶液,观察溶液颜色变化。
(2)向上述两支试管中各滴加0.01mol/LNaOH 溶液3~~5滴,观察现象,填写下表。
编号 12步骤(1) 滴加饱和FeCl 3溶液滴加1 mol/L KSCN 溶液现象步骤(2) 滴加NaOH 溶液滴加NaOH 溶液现象结论【思考与交流】1、 上述两个实验中,化学平衡状态是否发生了改变?你是如何判断的?2、从中你能否推知影响化学平衡状态的因素? 小结:(1)浓度对化学平衡的影响的规律在其他条件不变的情况下,增大反应物浓度或减小生成物浓度,都可以使平衡向着 移动;增大生成物浓度或减小反应物浓度,都可以使平衡向着 移动。


第3节 化学平衡第2课时1.关于化学平衡常数的叙述正确的是( )A .温度一定,一个化学反应的平衡常数不是一个常数B .两种物质反应,不管怎样书写化学方程式,平衡常数不变C .温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数D .浓度商Q c <K 时,v 正<v 逆解析:选C 。
K 是温度的函数,平衡常数的表达式与化学方程式的书写方式有关。
正、逆反应的平衡常数互为倒数,如H 2(g)+I 2(g)2HI(g),K 正=c 2HIc H 2c I 2,K逆=c H 2c I 2c 2HI ,所以K 正=1K 逆。
浓度商Q <K ,未达到化学平衡状态,此时v 正>v 逆。
2.对于3Fe(s)+4H 2O(g)Fe 3O 4(s)+4H 2(g),反应的化学平衡常数的表达式为( )A .K =c Fe 3O 4·c H 2c Fe ·c H 2OB .K =c Fe 3O 4·c 4H 2c Fe ·c 4H 2OC .K =c 4H 2Oc 4H 2D .K =c 4H 2c 4H 2O解析:选D 。
固体不写入表达式中。
3.在一定温度下的密闭容器中存在如下反应:2SO 2(g)+O 2(g)催化剂△2SO 3(g),已知c (SO 2)始=0.4 mol ·L -1,c (O 2)始=1 mol ·L -1,经测定该反应在该温度下的平衡常数K =19,则此反应中SO 2的转化量为( ) A .0.24 mol ·L -1 B .0.28 mol ·L -1 C .0.32 mol ·L -1D .0.26 mol ·L -1 解析:选C 。
2SO 2(g)+O 2(g) 催化剂△2SO 3(g)起始量/mol ·L -1:0.4 1 0变化量/mol ·L -1:x 0.5x x平衡量/mol ·L -1:0.4-x 1-0.5x x由平衡常数的定义:K =c 2SO 3c 2SO 2·c O 2=x 20.4-x2·1-0.5x=19,解得x =0.32 mol ·L -1。
第三节化学平衡2〔第二课时〕教学目标:正确明白得浓度、温度对化学平稳的阻碍,并能利用勒夏特列原理加以讲明。
教学重点:明白得浓度、温度对化学平稳的阻碍。
教学难点:勒夏特列原理的归纳总结。
教 学 过 程【引入】:我们明白:不同温度下物质的溶解度不同。
那么关于t 0时达到溶解平稳状态的饱和溶液,当升高或降低温度至t 1时:假设:溶解度增大,固体溶质连续溶解,那么V 〔溶解〕 V 〔结晶〕溶解度减小,固体溶质析出,那么V 〔溶解〕 V 〔结晶〕 那么溶解平稳状态被打破,继而建立一种新的溶解平稳,也确实是讲: 条件改变,溶解平稳移动。
那么:化学平稳是否也只有在一定条件下才能保持?当条件〔浓度、压强、温度等〕改变时,平稳状态是否也会发生移动?【实验探究一】:探究浓度变化对化学平稳的阻碍 实验原理:在K 2Cr 2O 7的溶液中存在如下平稳: Cr 2O 72- + H 2O2CrO 42- + 2H + K 2Cr 2O 7为橙色,K 2CrO 4为黄色。
实验步骤:①取两支试管各加入5ml 0.1mol/L K 2Cr 2O 7溶液,然后按下表步骤操作,观看并记录溶液颜色的变化。
实验结论:【实验探究二】:探究浓度变化对化学平稳的阻碍实验原理:Fe3++3SCN-Fe〔SCN〕3〔红色〕实验步骤:向盛有5 ml0.005mol/L FeCl3溶液的试管中加入5 ml0.01mol/LKSCN溶液,溶液显红色。
〔1〕将上述溶液均分置于两支试管中;向其中一支试管中加入饱和FeCl3溶液4滴,充分振荡,观看溶液颜色变化;向另一支试管滴加4滴1 mol/L KSCN溶液,观看溶液颜色变化。
〔2〕向上述两支试管中各滴加0.01mol/LNaOH溶液3~~5滴,观看现象,填写下表。
【摸索与交流】1、上述两个实验中,化学平稳状态是否发生了改变?你是如何判定的?2、从中你能否推知阻碍化学平稳状态的因素?小结:〔1〕浓度对化学平稳的阻碍的规律在其他条件不变的情形下,增大反应物浓度或减小生成物浓度,都能够使平稳向着移动;增大生成物浓度或减小反应物浓度,都能够使平稳向着移动。
〔2〕用v-t图表示化学平稳的移动:例:①旧的化学平稳②增大反应物的浓度请同学们用v-t图表示以下平稳的移动:③减少反应物的浓度④增大生成物的浓度⑤减少生成物的浓度讲明:〔1〕〔2〕〔3〕〔4〕【实验探究三】:温度对化学平稳的阻碍〔阅读教材30页实验2-7〕实验原理:实验步骤:实验现象:结论:v-t图表示:化学反应速率、化学平稳、平稳移动三者之间的关系以一样反应:mA〔气〕+n B〔气〕= p C〔气〕+qD〔气〕+Q〔千焦〕通式为例来讨论浓度,温度,压强,催化剂等对三者的阻碍极其规律。
Q < 0升高温度↑↑> →↑↑降低温度m+n<p+q 加入惰性气体V不变——= ———V变大↓↓> →↑↑V变小增大压强减小压强m+n=p+q 加入惰性气体V不变——= ———V变大↓↓= ———V变小增大压强减小压强m+n>p+q 加入惰性气体V不变——= ———V变大↓↓< ←↓↓V变小增大压强减小压强注:用〝=〞表示相等〝↑〞表示升高或增加〝↓〞表示降低或减少〝—〞表示无关或不变〝V〞表示体积〝v〞表示速率反馈练习:1、在密闭容器中存在以下平稳:,CO2的平稳浓度为C1摩/升,现再充入CO2使其浓度达到2C1摩/升,重新达到平稳后,CO2的浓度为C2摩/升(设温度不变),那么C1和C2的关系是〔〕A. C 1 < C 2B. C 1 = C 2C. C 1 > C 2D. 2C 1 = C 22、现有可逆反应2A + B + H 2O C + D 已达到平稳,往平稳体系中加水稀释,平稳向_____方向移动,理由是__________________________________3、关于mA(气)+nB(气)pC(气)+qD(气)的平稳体系,当升高温度时,体系对氢气的相对密度从16.5变成16.9,那么以下讲法正确的选项是 〔 〕 A.m+n>p+q 正反应是放热反应 B.m+n>p+q 正反应是吸热反应 C.m+n<p+q 逆反应是放热反应 D.m+n<p+q 逆反应是吸热反应4在密闭定容容器中,有可逆反应:nA 〔g 〕+mB 〔g 〕pC 〔g 〕+qD 〔g 〕ΔH>0处于平稳状态〔m+n>p+q 〕,以下讲法正确的选项是 〔 〕 ①升温时C 〔B 〕/C 〔C 〕的值减小 ②降温时,体系内混合气体的平均相对分子质量增大③加入B 后,A 的转化率变大A .①②③B .②③C .①②D .①③ 1、关于反应A 2+3B 2 2AB 3以下表示的反应速率中,速率最大的是A 、v A =0.4mol ·L -1min -1B 、v B =0.8mol ·L -1min -1C 、v 3AB =0.6mol ·L -1min -1 D 、v 2A =0.01mol ·L -1·S -12、在2L 密闭容器中,盛有2mol X 和2molY 物质进行如下反应:X(s)+3Y(g) Z(g),当反应进行到10s 后,测得生成0.5mol Z ,这期间的平均反应速率为 A 、v X =0.05mol ·s -1 B 、v X =0.025mol ·L -1·s -1 C 、v y =0.05mol ·L -1·s -1 D 、v y =0.075mol ·L -1·s -1 3、现有三个体积相等的密闭容器中都进行如下反应:CO 2+H 2 CO+H 2O(g),反应所处的温度相同,但反应的起始浓度不同,其中甲: [H 2]=[CO]=amol 乙:[CO 2]=amol [H 2]=2amol 丙[CO 2]=[H 2]=[H 2O]=amol ,达到平稳时,CO 的浓度由大到小的顺序排列正确的选项是A 、丙>甲>乙B 、甲>乙>丙C 、乙>丙>甲D 、乙>甲>丙 4、在一个固定体积的密闭容器中,放入mmol 的A 和nmol 的B ,发生如下反应: mA(g)+nB(g) PC(g),平稳时C 的浓度是wmol ·L -1,假设坚持容器的体积不变,起始时放入amolA 、bmolB 和cmolC ,要使平稳时C 的浓度仍为wmol ·L -1,那么a 、b 、c 必须满足的条件是A 、a:b:c=m:n:pB 、a:b=m:n 和p c map=+ C 、m a p mc =+和n b n pc =+ D 、a=3m , c=3n 和c=32p 5、对处于化学平稳的体系,以化学平稳与化学反应速率的关系可知: A 、化学反应速率变化时,化学平稳一定发生移动。
B 、化学平稳发生移动时、化学反应速率一定变化。
C 、正反应进行的程度大、正反应速率一定大。
D 、只有催化剂存在下,才会发生化学反应速率变化,而化学平稳不移动的情形。
6、在PCl 5(g) PCl 3(g)+Cl 2(g),达到平稳后,其它条件不变,向平稳体系中加入37Cl 2,达到新平稳后,含37Cl 的PCl 3的物质的量与原平稳相比A 、增大B 、减小C 、不变D 、不能确定 7、以下事实不能用勒沙特列原理讲明的是 A :往氢硫酸溶液中加入盐酸,[S 2-]降低。
B :温度不变时,敞口久置于空气中的饱和KNO 3溶液含有晶体析出。
C :在合成氨的工业生产中,使用较高的温度有利于提高产量。
D :在密闭容器中,水面上方的蒸气压强随温度升高而增大。
8:以下平稳:C 2H 2+H 2 C 2H 4……① 2CH 4 C 2H 4+2H 2……②当降低温度时,①式 向右移动,②式向左移动,试判定以下式中C+2H 2 CH 4+Q 1 2C+H 2 C 2H 2+2Q 22C+2H 2 C 2H 4+2Q 3 Q 1、Q 2、Q 3的大小顺序为A 、Q 1>Q 2>Q 3B 、Q 1> Q 3> Q 2C 、Q 2> Q 1 >Q 3、D 、Q 2>Q 3 >Q 19、在CuCl 2水溶液中存在如下平稳:[Cu(H 2O)4]2++4Cl - [CuCl 4]2-+4H 2O 能使黄绿 〔蓝〕 〔绿〕 色CuCl 2溶液向蓝色转化的操作是A 、蒸发浓缩B 、加水稀释C 、加入AgNO 3D 、加入食盐晶体 10、反应A(g)+xB(g) yC(g),将A 与B 按体积比1:x 混合反应当A 的转化率是50%时,反应前混合气体的密度是反应后混合气体密度的43〔同温同压〕,那么x 、y 的值可能是A 、3,4B 、3,2C 、3,3D 、1,111、在容积一定的密闭窗口中,反应A B(g)+C(s)达平稳,假设连续升高温度,容器内气体的密度增大,以下判定正确的选项是A 、 压强对该反应的平稳移动没有阻碍B 、 在平稳体系中加入C ,混合气体平均分子量增大 C 、 假设正反应为吸热反应,那么A 为非气态D 、 假设正反应为放热反应,那么A 为气态12、某温度下,反应H 2(g)+I 2(g) 2HI(g)+Q,在一带有活塞的密闭容器中达到平稳, 以下讲法不正确的选项是A 、 恒温压缩体积,平稳不移动,颜色加深B 、 恒压迅速充入HI ,开始时正反应速率减小C 、 恒容,升温正反应速率减小D 、 恒容,充入H 2,I 2的百分比含量降低二:填空1、t0C在VL密闭容器中加入vmol N2和3vmol H2,当反应N2+3H22NH3达平稳时,混合气体中N2、H2、NH3分不为A、B、Cmol,仍在t0C,假设只改变起始物的加入量,但要坚持A、B、C值不变,那么在N2、H2、NH3的加入量用X、Y、Z表示,应满足的条件是(1)假设X=0,Y=0,那么Z=_______(2)假设X=0.75vmol,那么Y=________ Z=________。
N2+3H22NH3+Q达到平稳,测得混合气体为7体积〔1〕保持上述反应温度不变,设a、b、c分不代表初始加入的N2、H2、NH3体积,假设反应达到平稳后,混合气体中各物质的百分含量仍与上述平稳完全相同,那么:①假设a=1, c=2那么b=_____,在此情形下,反应起始时将向_____方向进行。
②假设规定起始时反应向逆方向进行,那么C的取值范畴是______________〔2〕在上述装置中,假设起始时的a、b、c值均与〔1〕相同,但需操纵平稳后混合气体为6.5体积,那么可采取措施是______,其缘故是______。