学习目标
新知讲学
课堂总结
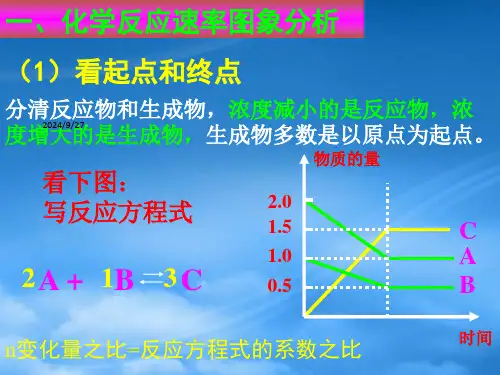
4.百分含量(或转化率)—压强—温度图像(等温线、等压线)
解题原则——“定一议二”。 在化学平衡图像中,讨论三个量之 间的关系,先确定其中一个量(看 曲线趋势或做辅助线),再讨论另 两个的关系,从而得到反应热或气 体分子数信息。
如分析图Ⅰ中等压线,温度升高C%减小,即平衡逆向移动,说明正反应放热;分析等温线(做 垂线),压强增大C%增大,即平衡正向移动,说明正反应方向气体总体积减小。 分析图Ⅱ中等温线,压强增大C%减小,即平衡逆向移动,说明正方向气体总体积增大;分析 等压线(做垂线),温度升高C%减小,即平衡逆向移动,说明正反应方向放热。
学习目标
A
新知讲学
课堂总结
解析: 随着温度的升高,化学平衡应向吸热反应方向移动,即向逆反应方向移动,所以C的体积 分数减小,A的转化率减小,A正确,D错误; 增大体系的压强,由于反应的两边都是气态物质,所以正反应和逆反应的速率都增大,B错误; 而加入催化剂,只能加快反应速率,缩短达到平衡的时间,不能使平衡移动,所以达到平衡后,各组 分的浓度及体积分数不变,C错误。
分含量与温度(T)和压强(p)的关系如图所示,判断下列叙述中不正确的是( D)
A.达到平衡后,升高温度,平衡向逆反应方向移动 B.达到平衡后,若使用催化剂,D的物质的量分数不变 C.化学方程式中一定有m<p+q D.平衡后增大B的量,有利于平衡向正反应方向移动
解析:由左图知,温度为T2时先到达平衡,故T2>T1,升高温度,D%减小,则平衡向逆反应移动,故 A正确;使用催化剂,缩短到达平衡时间,平衡不移动,D%不变,故B正确;由右图可知,压强为p2 时先到达平衡,故p2>p1,增大压强,D%减小,则平衡逆向移动,增大压强平衡向体积减小的方向 移动,反应中B为固体,故m<p+q,故C正确;B为固体,对反应速率以及平衡移动没有影响,增加B 的质量平衡不移动,故D错误。