第16章 硼族元素..
- 格式:doc
- 大小:149.50 KB
- 文档页数:21
高中化学奥林匹克竞赛辅导硼族元素一、硼族元素简介硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl),在周期表中处于第Ⅲ A族。
硼族元素的价电子构型为n s2n p1,除硼外其余元素均为金属元素,金属性随原子序数的增加而增强。
B的半径较小,失去三个电子非常困难,因此硼不能形成简单阳离子B3+,只能通过共用电子对形成共价化合物。
Al、Ga、In、Tl在水溶液中可以形成M3+。
因为惰性电子对效应,Tl3+具有强氧化性。
在硼族元素形成的共价分子中,中心原子最外层只有6个电子,未达到8电子的外层结构,属于缺电子化合物,它们具有一个空p轨道,可以接受孤对电子形成配位键,是强的路易斯酸。
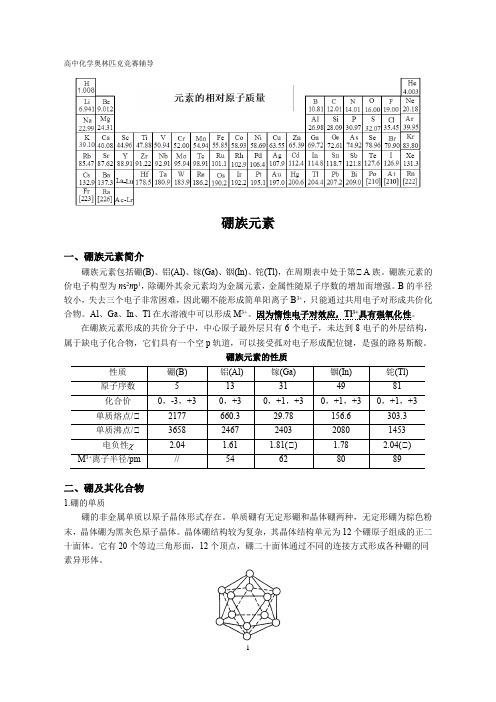
硼族元素的性质二、硼及其化合物1.硼的单质硼的非金属单质以原子晶体形式存在。
单质硼有无定形硼和晶体硼两种,无定形硼为棕色粉末,晶体硼为黑灰色原子晶体。
晶体硼结构较为复杂,其晶体结构单元为12个硼原子组成的正二十面体。
它有20个等边三角形面,12个顶点,硼二十面体通过不同的连接方式形成各种硼的同素异形体。
晶体硼的化学活性较低,无定形硼较活泼。
常温下,硼能与F 2反应,高温下能与N 2、O 2、S 等非金属单质反应。
无定形硼可被热的浓硝酸、浓硫酸氧化成硼酸,也能与强碱作用放出氢气。
2B+N 22BN(与金刚石C 2互为等电子体,是原子晶体) B+3HNO 3(浓)B(OH)3+3NO 2↑2B+2NaOH+2H 2O2NaBO 2+3H 2↑(与Al 的性质相似)2.硼的氧化物及含氧酸硼最重要的氧化物是B 2O 3,熔融B 2O 3能溶解许多金属氧化物,形成具有特征颜色的偏硼酸盐,这个反应用于定性分析,称为硼珠实验:CuO+B 2O 3Cu(BO 2)2(蓝色) NiO+B 2O 3Ni(BO 2)2(绿色) B 2O 3的水化物为硼酸H 3BO 3或B(OH)3。
H 3BO 3是白色的片状晶体,具有片层结构,层和层 之间存在范德华力,容易发生滑动,其中氢键对其结构的形成具有支配的作用。




第16章硼族元素16.1 硼族元素的通性16.1.1 硼族元素的通性包括硼、铝、镓、铟、铊五种元素。
硼在自然界中有硼镁矿、硼砂等;铝在地壳中的含量仅次于氧和硅,占第三位,主要以长石、云母、高岭土等硅酸盐形式存在。
镓、铟、铊比较分散,没有单独矿藏,与其他矿物共生。
硼的原子半径最小,核电荷对外层电子的吸引较强,为非金属,其余四种元素为金属,从硼到铝是由非金属突变到金属,不是逐渐过渡的。
●硼族元素氧化物的酸碱性递变规律:硼的氧化物呈酸性,铝和镓的氧化物为两性,铟和铊的氧化物是碱性的。
●硼族元素的价电子构型为ns2np1,一般氧化态为+III。
“惰性电子对效应”,随着原子序数的递增,生成低氧化态的(+I)的倾向增强。
镓、铟、铊在一定的条件下能显示出+I氧化态,特别是Tl ,其+I氧化态常见,Tl(+I)的化合物具有较强的离子健特征。
●硼、铝两元素亲氧特性表现得突出。
●硼族元素价电子轨道(ns和np)数为4,而价电子仅为3,为缺电子原子,它们所形成的化合物有些为缺电子化合物。
有空的价键轨道,这些化合物有很强的接受电子的趋势,容易形成聚合分子(如:Al2Cl6)和配合物(如:HBF4)。
在此过程中,中心原子价轨道由sp2杂化过渡到sp3杂化,相应分子从平面结构过渡到立体结构。
硼原子最高配位数为4,而其它元素外层d轨道可参与成键,最高配位数可以为6。
16.2 硼族元素的单质及其化合物硼在自然界主要以含氧化合物的形式存在。
硼的重要矿石有硼砂Na2B4O7·10H2O,方硼石2Mg3B8O15•MgCl2,硼镁矿Mg2B2O5•H2O等。
铝在自然界分布很广,主要以铝矾土矿形式存在,它是一种含有杂质的水合氧化铝矿。
镓、铟、铊在自然界单独矿物,以杂质的形式分散在其它矿物中。
16.2.1 硼族元素的单质1. 单质硼(1) 单质硼的结构单质硼有多种同素异形体,包括无定形硼和晶体硼。
无定形硼为棕色粉末,晶体硼呈黑灰色。

第十六章硼族元素1.硼 单质 硼烷 硼的含氧化合物 硼与硅的相似性2.铝 Al2O3的两种变体 铝盐 §本章摘要§3.镓铟铊Tl(III)的氧化性§1.硼 一.单质 黄棕色固体,高硬度,高沸点1. 制备和Si制备相比较 用Mg或Al 还原B2O3,相当于用C还原SiO2 B2O3 + 3Mg --- 3MgO + 2B (高温) 用H2还原三溴化硼,相当于用H2还原SiCl4 2BBr3 + 3H2 --- 2B + 6HBr (W丝, 高温) 2. 硼的反应 常温下不活泼,高温下活泼 4B + 3O2 --- 2B2O3 2B + 3Cl2 --- 2BCl3与硅相似 2B + N2 --- 2BN (均在高温下进行) 和氧化性酸起反应,比硅活泼些 B + 3HNO3(浓) --- H3BO3 + 3NO2 和强碱起反应 2B + 2NaOH(浓) + H2O ---2NaBO2 + 3H2(气体) (偏硼酸钠) 二硼烷 硼氢化合物虽没有碳氢化合物种类多, 但远比硅烷多. 其结构比烷烃、硅烷复杂.1. 结构 最简单的硼烷,理应是BH3, 但结构研究表明它的分子式是B2H6, 分子间键联关系: 2. 乙硼烷制备质子置换法: 相当于Mg2Si和盐酸反应制备SiH4。
还原法: 4BCl3 + LiAlH4 --- 2B2H6 + 3LiCl + 3AlCl3相当于SiCl4和LiAlH4反应制SiH4。
端基上的H和B之间形成σ键(sp3-s). 四个端H和两个B形成分子平面,中间两个H不在分子平面内,其连线垂直于分子平面,上下各一个, 上面的H所成的键共用价电子44个3. 乙硼烷的性质1°稳定性 B2H6 ----B + H2 B2H6要在100℃以下保存,稳定性不如硅烷。
2 °还原性 B2H6 + 3O2 --- B2O3 + H2O 自燃 属高能燃料,但毒性极大,不易储存。
第十六章硼族元素
§16-1 硼族元素的通性
硼族元素:B、Al、Ga、In、Tl
价电子层结构:ns2np1
主要氧化数: B Al Ga In Tl
+3 +3 +3,(+1) +1,+3 +1,(+3)
从Al开始为金属,但成键时表现为极性共价键
+3氧化态化合物特点:缺电子,易聚合,易与路易斯碱形成稳定化合物
元素电势图(P769):所有单质都具有还原
性,无氧化性,碱性
条件下还原性更强。
酸性条件下Tl3+具有
较强氧化性,Ga2+、
In2+、In+易歧化。
§16-2 硼族元素的单质及其化合物
一、硼族元素在自然界中的分布
二、硼族元素的单质
2Al
3.镓、铟、铊
Ga: 银白色光泽的软金属。
熔、沸点相差最大,m.p.=302.78K,
b.p.=2343K。
凝固时体积膨胀。
在
干燥的空气中不起变化。
两性金
属。
In: 银白略带淡蓝色金属,比铅还软。
在干燥的空气中不起变化。
不与
碱作用。
Tl:灰白色,重而软的金属,在空气中生成一层Tl2O膜。
不与碱作用。
化学性质:M+O2(或S) 灼热M2O3(或M2S3)(M=Ga,In,Tl)
M+X2= MX3(M=Ga,In,Tl)(X=Br,Cl; Tl无三溴化物)
M+I
MI3(或MI)
(M=Ga,In)
2In(粉末)+6H2O=2In(OH)3+3H2↑
M+HCl MCl3(或
MCl)+H2↑
M+HNO3(稀)M(NO 3)3(或MNO3)+NO↑+H2O
2Ga+2NaOH+6H2O=2Na[Ga (OH)4]+3H2↑
4.单质的提取和冶炼
B的制备:
碱法:Mg2B2O5.H2O+2NaOH=2NaBO2+2Mg
(OH)2
4NaBO2+CO2+10H2O=Na2B4O7.10H2
O+Na2CO3
Na2B4O7+H2SO4+5H2O=4H3BO3+Na2S
O4
2H3BO3
O3+3H2O
B
B2O3+3Mg=2B+3MgO
酸法:
Mg2B2O5.H2O+2H2SO4=2H3BO3+2Mg
SO4
99.95%单质B的制备:2BI3 1000-1300K,钽丝2B+3I
2
Al的制备:
Al2O3+2NaOH+3H2O=2Na[ Al(OH)4]
2Na[Al(OH)4]+CO2=2Al(O H)3↓+Na2CO3+H2O
2Al(OH)
Al2O3+3H2O
2Al2O3Na3AlF6, 电解4Al+3O2 Ga的制备:
Ga(OH)3OH-Ga(OH)4-电解Ga
GaCl3+HCl TBP萃取HGaCl4 OH-, 电解Ga
三、硼的氢化物(硼烷)
两类:B n H n+4:B2H6, B5H9, B6H10……
B n H n+6:B3H9,B4H10,
B5H11……
B2-B4 为气体,B5-B8为液体B2H6制备:质子置换法
2B2H6加压B4H10+H2
B2H6+2LiH=2LiBH4
硼烷中的五种成键情况:端侧的2中心
-2电子硼氢键B-H;
3中心-2电子
氢桥键H
B B
2中心-2电子
硼-硼键B-B
开放的3中心
-2电子硼桥键 B
B B
闭合的3中心
-2电子硼键 B
B B
四、卤化物
1.B、Al的三卤化物
BX3制备:置换法
B2O3+6HF=2BF3↑+3H2O
B2O3+3CaF2+3H2SO4(浓)=2BF3↑+3H2
O+3CaSO4
BF3(g)+AlCl3=AlF3+B Cl3↑
B2O3+3C+3Cl2=2BCl3+ 3CO
2B+3X2=2BX3
BX3性质:加合性及水解性
4BF3+6H2O=3H3O++3BF4 -+B(OH)
3
BCl3+3H2O=B(OH)3+3H Cl
无水AlCl
制备:2Al+3Cl2(g)
2AlCl3
2Al+6HCl(g) 2AlCl 3+3H2↑
Al 2O3+3C+3Cl22AlCl3+3CO
AlX3中AlF3为离子型,
其它为共价型。
AlCl3性质:易与路易斯碱配合,强烈水解
AlCl3+Cl-=[AlCl4]-
AlCl3+NH3=AlCl3.NH3 2.硼族元素卤化物的比较
Ga In Tl
三价卤化物的稳定性下降
B、Al: 只有三价卤化物
Tl: 无TlBr3TlI3
除BF3外,其它三氟化物为离子型
磁性:GaCl2反磁性-----Ga+[GaCl4]-
InCl2反磁性-----In+[InCl4]-
Tl(I)与Ag(I)卤化物的制法及性质相似,但TlCl不溶于NH3.H2O
Tl(I)盐与碱金属(K,Rb等)盐同晶型,可与碱金属离子互相替代。
五、含氧化合物
1.B2O3与Al2O3
B
O3: 制备:2H3BO3B2O3+3H2O
性质:吸水性强,可作干燥剂
B2O3+3H2O(l)=2H3BO3(aq)
B2O3(晶状)+H2O(g)=2HBO2(g)
硼珠试验,用于定性分析金属离子,如:
O3Cu(BO2)2(蓝)
CuO+B
NiO+B2O3
)2(绿)
Ni(BO
X B2O3+2xNH3873K (BN)x+3x H2O
B2O3+CaH2873K CaB6 Al2O3: α-Al2O3即刚玉,硬度大,不溶于水、酸及碱,可与KHSO4共熔
α-Al2O3的制备:4Al+3O2燃烧2Al2O3
2Al(OH)3高温灼烧α-Al2O3+3H2O
2Al(OH)3较低温灼烧γ-Al2O3+3H2O
O
双核的,如FeB2O5, ThB2O5
由二个以上BO3构成环状或链
状结构,如三聚的NaBO2
多核的为无限(BO2)n n-,如
Ca(BO2)2
BO3与BO4结合成硼氧骨架,如
N
a
2
B
4
O
7
.
1
H
2
O
(
即
N
a
2
B
4
O
5
(
O
H
)
4
.
8
H
2
O
)
3. 硼族元素含氧化合物的比较
B2O3Al2O3Ga2O3
I
n
Tl-O体系:Tl2O3(棕黑色);无Tl(OH)3
Tl2O3373K Tl2O
Tl3++OH-→棕色↓(组成近似于Tl2O3.1.5H2O)
Tl2SO4+Ba(OH)2=TlOH+BaSO4↓
TlOH的碱性强度与NaOH相近,蒸发可得TlOH黄色晶体。
TlOH及
其溶液易从空气中吸收水蒸气及
CO2,并能腐蚀玻璃。
2TlOH Tl 2O(黑)+H2O
Ga、In、Tl的氧化物和氢氧化物中
只有Tl2O及TlOH是碱性的且易溶
于水。
§16-3 惰性电子对效应和周期表中的斜线
关系
一、惰性电子对效应
同族中,诸元素S电子对的惰性随原子序数的上升而增强,在第六周期尤为明显。
例:Hg难被氧化
Bi(V)、Pb(IV)、Tl3+的强氧化性
惰性电子对效应产生的原因:高价化合
物的平
均热化
学键能
的降低;
nS2电离
能之和
的增大
等。
二、周期表中的斜线关系
在周期表中,有数对处于相邻两个族的对角线上的元素,它们的性质十分相似,这种相似性称作斜线关系或对角线关系。
原因:离子场力相似Z/r
如: Li与Mg、Be与Al、B与Si
Li与Mg的相似性:(1)在空气中燃烧得正常氧化物
(2)与N2化合能力较强,易生成Li3N和Mg3N2
(3) 氟化物、碳酸盐及磷酸盐均为难溶盐
(4)氢氧化物溶解度较小,受热易脱水成氧化物
(5)硝酸盐热分解产物相似
(6)水合氯化物受热易水解
Be与Al的相似性:(1)电极电势相近
(2)均为两性金属
(3)氧化物均为高熔点及高硬度
(4)氢氧化物均为两性
(5)氯化物均为缺
电子的共价
型化合物,在
蒸气中以缔
合分子的状
态存在
(6)均能被浓HNO3钝化
(7)盐都能水解且高价阴离子的盐难溶
B与Si的相似性:(1)单质状态下都呈某些金属性
(2)自然界中以氧的化合物存在
(3)B-O、Si-O键能大,稳定性高
(4)氢化物多种多
样,具有挥发
性、水解性、
可自燃
(5)卤化物彻底水
解,都是路易
士酸
(6)都生成多酸及
多酸盐,有类
似结特征。
正
硼酸及正硅
酸均为弱酸(7)氧化物可与某
些金属氧化
物共熔生成
含氧酸盐。