无机化学下册第十六章硼族
- 格式:ppt
- 大小:1.67 MB
- 文档页数:38


化学竞赛无机化学绝密课件硼族元素-(含多场合)化学竞赛无机化学绝密课件硼族元素摘要:本文主要介绍了化学竞赛中无机化学部分的重要知识点——硼族元素。
通过对硼族元素的概述、性质、化合物以及应用等方面的详细讲解,旨在帮助参赛者更好地掌握这一部分内容,提高化学竞赛成绩。
一、硼族元素概述硼族元素位于元素周期表的第二族,包括硼(B)、铝(Al)、镓(Ga)、铟(In)和铍(Tl)等元素。
硼族元素在自然界中分布广泛,其中硼和铝是地壳中含量较多的元素。
硼族元素在化学性质上具有一定的相似性,但在物理性质和应用方面存在较大差异。
二、硼族元素的性质1.电子结构:硼族元素的原子结构中,最外层电子数为3个,因此它们在化学反应中容易失去3个电子,形成+3价离子。
2.金属性和非金属性:从上到下,硼族元素的金属性逐渐增强,非金属性逐渐减弱。
硼和铝具有较强的非金属性,而铟和铍的金属性较强。
3.离子半径:硼族元素的离子半径随着原子序数的增加而增大,这是因为原子核对最外层电子的吸引力逐渐减弱。
4.电负性:硼族元素的电负性随着原子序数的增加而减小,这是因为原子核对最外层电子的吸引力逐渐减弱。
三、硼族元素的化合物1.氧化物:硼族元素与氧元素形成的氧化物具有多种类型,如硼酸、氧化铝、氧化镓等。
这些氧化物在工业、医药等领域具有广泛的应用。
2.硼化物:硼族元素与金属元素形成的硼化物具有高熔点、高硬度和良好的导电性等特点,如碳化硼、氮化硼等。
3.氢化物:硼族元素与氢元素形成的氢化物在有机合成中具有重要应用,如硼氢化钠、硼氢化铝等。
4.硼酸盐:硼酸盐是一类重要的无机化合物,如硼砂、硼酸铝等。
它们在玻璃、陶瓷、洗涤剂等领域具有广泛应用。
四、硼族元素的应用1.金属铝:铝是硼族元素中应用最广泛的元素,广泛应用于建筑、交通、包装、电力等领域。
铝具有良好的导电性、导热性和轻质等特点,是国民经济的重要支柱产业。
2.硼化合物:硼化合物在农业、医药、化工等领域具有重要应用。


无机化学总结硼族元素无机化学总结硼族元素无机化学总结硼族元素一硼单质及其化合物制作成员:摆宫泽贾震韦仕富硼单质硼单质可以分为晶体与无定形两大类。
晶体硼呈灰黑色硬度极高,导电性差但它的电导率却随着温度的升高而增大从而显示出与金属导体的不同。
不太纯的无定形硼为棕色粉末。
晶体硼单质的化学反应活性较低无定形硼相对活泼。
硼单质的晶体结构晶体硼单质基本结构单元为正二十面体,12个硼原子占据着多面体的顶点。
a—菱形硼:B12结构单元间的硼硼化学键属于三中心二电子键。
由片层间B12结构单元按面心立方最密堆积方式形成晶体其中所以硼原子间均形成共价键使单质硬度大导热能力强,导电能力弱。
B—菱形硼:结构更复杂其中含B84结构单元。
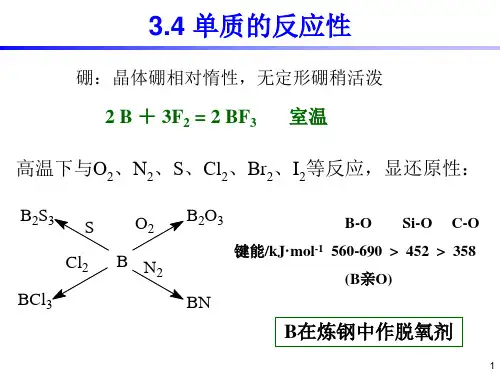
硼单质的化学性质常温下与F2化合:2B+3F2=2BF3在空气中燃烧放出大量热:4B+3O2=2B2O33由于硼氢键的键能很大所以硼能从许多稳定的氧化物如SiO2,P2O5中夺取氧。
硼在炼钢过程中可以作为去氧剂。
4赤热下无定形硼与水蒸气反应:2B+6H2O(g)=2B(OH)3+2H2 5在高温下硼能同N2,S,_2等非金属单质反应2B+N2=2BN2B+3CI2=2BCI22B+3S=B2S36在高温下硼也能同金属反应生成金属硼化物如NbB4,ZrB2,LaB6等。
硼化物一般具有咼硬度咼熔点。
7无定形硼不与非氧化性酸作用但可以与热浓H2SO4,热的HN03反应:B+3HN03(浓)=B(OH)3+3NO2f2B+3H2SO4(浓)=2B(0H)3+3SO2f8有氧化剂存在时硼与强碱共熔可得到偏硼酸盐:2B+2NaOH+3KNO3=2NaBO2+3KNO2+H2O硼单质的制备工业上用碱法分解硼镁矿制取单质硼。
Mg2B2O5?H2O+2NaBO2=2NaBO2+2Mg(OH)24NaBO2+CO2+10H2O=NaB4O7?10H2O+Na2CO3NaB4O7+H2SO4+5H2O=4H3BO3+Na2SO42H3BO3=B2O3+3H2OB2O3+Mg=2B+3MgO用硫酸与硼镁矿反应一步制得硼酸:Mg2B2O5?H2O+2H2SO4=2H3BO3+2MgSO4硼氢化合物称为硼烷已知的有:B2HqB4Hio,B5H9,B8Hi6,B8Hi8等,BnHn+4与BnHn+6共20多种。




第16章硼族元素16.1 复习笔记一、硼及其化合物硼的化学性质与Si有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量化合物,如等。
1.单质硼(1)单质硼的晶体结构单质硼有两种同素异形体。
无定形硼为棕色粉末,晶态硼呈黑灰色。
硼的熔沸点高,晶态硼的硬度很大,在单质中仅次于金刚石。
晶态硼有很多种复杂的结构,他们都以B12正二十面体为基本的结构单元(如图16-1所示)。
图16-1 硼的基本结构单元(2)单质硼的化学性质硼和硅一样,在常温下较惰性,仅与F2反应。
相对于单质硼而言,晶态硼惰性较大,无定形硼比较活泼。
①在高温下,硼与N2、O2、S、卤素等反应。
②硼能从许多稳定的氧化物(等)中夺取氧。
③硼不与盐酸反应,但与氧化性的酸反应,生成H3BO3。
④在有氧化剂存在时,硼与碱共熔得到偏硼酸盐。
(3)单质硼的制备①金属还原法②工业上的碱法碱法步骤如下:a.用浓碱溶液来分解硼镁矿,得到偏硼酸钠:b.通入CO2调节碱度,分离出硼砂:c.用H2SO4调节酸度,可析出溶解度小的硼酸晶体:d.加热,使硼酸脱水生成B2O3:e.用Mg或Al还原成粗硼:③工业上的酸法酸法用硫酸分解硼镁矿,一步制得硼酸。
此法虽然简单,但需要耐酸设备等条件,不如碱法好。
④精制粗硼可将碘化硼在灼热(1000~1300 K)的钽丝上热解,可得到纯度达99.95%的α-菱形硼。
2.硼的化合物(1)硼的氢化物硼的氢化物的物理性质相似于烷烃,故称硼烷。
多数硼烷的组成是,少数为。
但最简单的硼烷是B2H6。
①硼的氢化物的制备方法a.质子置换法b.氢化法c.氢负离子置换法②硼烷的结构硼烷是缺电子化合物,B原子采取sp3杂化,位于一个平面的BH2原子团,以二中心二电子键连接,位于该平面上、下且对称的H原子与硼原子分别形成三中心二电子键,即氢桥键,如图16-2所示。
图16-2 硼烷B2H6的结构③硼烷的物理性质常温下,为气体,至为液体,及其他高级硼烷都是固体。

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。