化学平衡移动的图像
- 格式:docx
- 大小:320.36 KB
- 文档页数:4




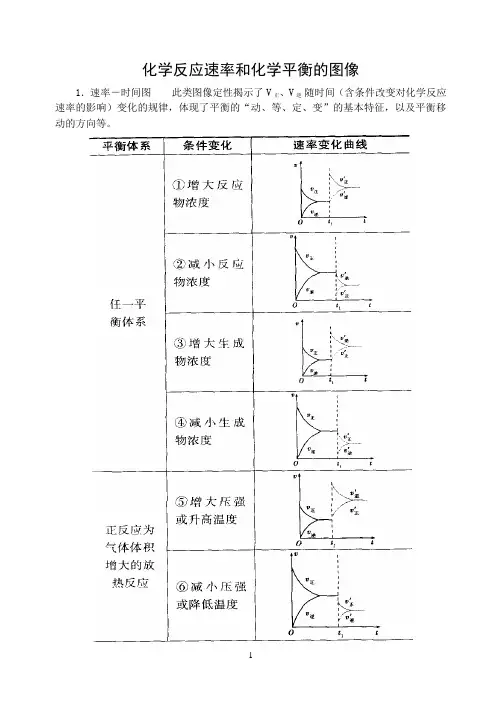
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。





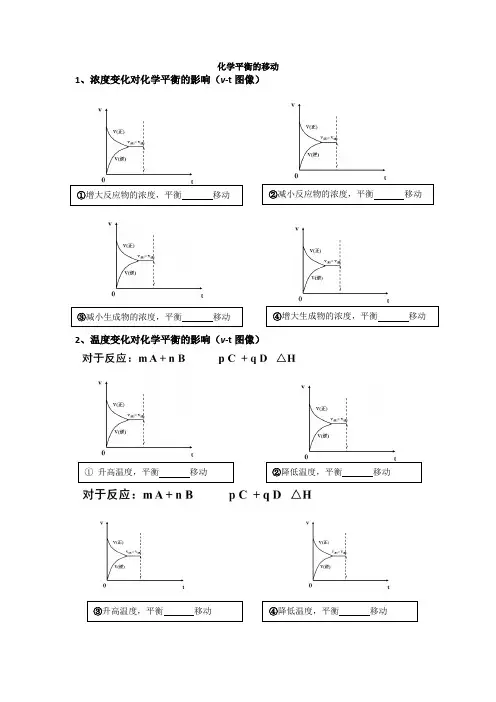
化学平衡的移动1、浓度变化对化学平衡的影响(v-t图像)
2、温度变化对化学平衡的影响(v -t图像)
①增大反应物的浓度,平衡移动②减小反应物的浓度,平衡移动③减小生成物的浓度,平衡移动④增大生成物的浓度,平衡移动
①升高温度,平衡移动②降低温度,平衡移动
③升高温度,平衡移动④降低温度,平衡移动
3、压强变化对化学平衡的影响
(1)当m + n >p + q时:
①增大压强,平衡移动②减小压强,平衡移动(2)当m + n <p + q 时:
③增大压强,平衡移动④减小压强,平衡移动
(3)A(气) + B (气) 2C (气) + D (固)
⑤增大压强,平衡移动⑥减小压强,平衡移动
4、催化剂对化学平衡的影响。
化学平衡移动的图像一、化学平衡的移动
二、影响化学平衡移动的条件
1、浓度的变化对化学平衡的影响
结论:其它条件不变的情况下,①增大反应物浓度或减小生成物浓度平衡向正方向移动
②增大生成物浓度或减小反应物浓度平衡向逆方向移动
2、温度变化对化学平衡的影响
温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。
表现在:
升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。
降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。
结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热的方向移动。
注意:温度的变化一定会影响化学平衡,使平衡发生移动
3、压强的变化对化学平衡的影响
对于反应前后气体分子数有变化的体系:
结论:增加压强可使平衡向气体分子数目减小的方向移动;
减小压强可使平衡向气体分子数目增大的方向移动.
对于反应前后气体分子数目不变的反应:
结论:对于反应前后气体分子数目不变的反应,改变压强平衡不移动。
4、使用催化剂对化学平衡的影响
结论:催化剂同等程度的改变正、逆反应速率(V正=V逆)
使用催化剂,对化学平衡无影响。
正催化剂能缩短平衡到达的时间
[总结]改变反应条件时平衡移动的方向
5、化学平衡移动原理——勒夏特列原理
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
注意:
①是“减弱”这种改变,不是“消除”这种改变
②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解
平衡等),未平衡状态不能用此来分析
③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。