植物病毒的人工摩擦接种实验
- 格式:doc
- 大小:27.50 KB
- 文档页数:1

物理农业实验基础植物病害的人工接种物理农业实验基础植物病害的人工接种现代物理农业是以理论做指导,并以实践为基础发展起来的装备型农业,其中的一个重要分支就是无毒农业,如何保障农作物在其全生育期内不使用农药是无毒农业需要解决的核心问题,从土传病虫害到气传病害、地上部分的虫害均需要相应的防治设备,而判定一个设备是否好用,需要进行验证试验。
物理农业常用的验证试验方法如下:植物病害的人工接种人工使病原物与寄主植物的易感病部位接触,并给予一定的发病条件,诱起病害的发生叫接种。
在证病过程中,分离所得的病原物必须通过接种才能确定它的致病性,接种是证病过程的重要环节。
在研究寄生现象、发病规律,鉴定品种的抗病性及进行药效测定等工作时,都需借助人工接种才能得出比较可靠的结论。
因此,接种是植病工作者必须掌握的基本技术,应该充分掌握它的原理和方法。
一、植物病害发生的条件充分掌握病害发生的条件,才能人工诱起病害的发生。
已知植物病害的发生是由寄主植物、病原物和环境条件三方面的因素决定。
要准确诱发病害,就要深入掌握这三方面的因素对接种的影响。
(一)寄主植物的感病性诱发病害必须有感病的寄主。
寄主的感病性受下列因素影响:1、作物的种类和品种不同的作物各类以及同一作物的不同品种对一定病害的感病性不同。
接种需要选择感病的作物和感病的品种。
但有时亦可选择感病性不同的作物或品种来作比较。
2、感病的阶段和部位寄主各个发育时期感病性不同,同一寄主对不同病害的感染阶段亦不一样,接种必须明确该病害的感染阶段。
有些病害在寄主的一定部位和一定的细胞生理年龄感染,因此必须注意感染部位和细胞的生理年龄问题。
如水稻对稻瘟病的感染阶段是苗期(四叶期)、分蘖盛期及抽穗初期。
前两期的感染部位是叶子,后一期的感染部位是穗部。
以叶片和穗子的生长年龄来说,以出叶当天和始穗期最感病。
因此接种不仅要选择感染阶段,并要选择感病的部位和组织细胞最感染的生理年龄。
3、生长状况一般来说,兼性寄生菌对生长衰弱的寄主容易侵染,专性寄生菌则需要生长发育比较正常的寄主。

烟草花叶病毒的检测方法研究进展摘要烟草花叶病毒(TMV)的寄主范围相当广泛,给农业生产带来重大损失,加强对该病毒的检测具有重要意义。
在查阅近年来国内外文献的基础上,总结了对烟草花叶病毒的检测方法如直接观测法、电子显微镜检测法、生物学测定法、血清学检测和分子生物学检测法等的研究进展。
随着植物种质资源的引进和生态条件的改变,对检测TMV方法提出了更高的要求,因此在实际应用中要综合运用各种检测方法提高检测的准确性。
关键词烟草花叶病毒;检测方法;研究进展烟草花叶病毒(tobacco mosaic virus,TMV)是一种RNA病毒,病毒粒体为棒状,长度为300~310 nm、直径18 nm;病毒基因组为单分子线形正义ssRNA,长6 300~6 600 nt;衣壳蛋白由一种多肽组成,分子质量为17~18 kDa。
TMV 的寄主范围非常广,可侵染的植物达150多个属,主要是一些草本双子叶植物,包括蔬菜、花卉和烟草等,导致烟草和番茄等作物的严重危害[1]。
烟草业在我国经济中占据着重要的地位,而烟草花叶病严重危害烟叶的产量和质量,成为优质烟叶生产的因子,是烟叶出口所面临的挑战,同时给我国造成巨大的经济损失。
不同条件下同种病毒的症表现状有很大差异,而不同病毒在烟叶上表现为相似的症状,烟草花叶病毒检测对于烟叶病毒的防治提供理论依据,同时也对进一步识别病毒病害和防止病毒传播危害具有重要的实际意义。
1 直接观测法直接检查植株叶子和茎有无可见的病毒症状。
烟草花叶病毒属中大多数病毒的寄主范围较广,对外界环境的抵抗力强,自然传播不需要介体生物,靠植株间的接触(或有时种子)传播。
如在烟草上自苗期至大田期可连续发生,早期发病烟株节间缩短、植株矮化、生长缓慢,幼苗被侵染后,新叶的叶脉颜色变浅,而后形成黄绿相间的花叶症;苗期侵染的植株发育缓慢。
大田期植株发病,除显示明脉、花叶症状以外,病叶上会形成疱斑,厚薄不匀;叶片出现各种畸形。


实验一植物病毒的机械接种
实验目的:了解植物病毒机械接种的原理和方法
实验内容:以带有TMV病毒的病叶为材料进行机械接种,1周后观察接种植物叶片等形态与生理的变化
实验材料:研钵、TMV或其他病叶、金刚砂(600目)、普通烟或本氏烟苗、灭菌蒸馏水或磷酸缓冲液(pH7.0)、花盆、营养土
实验方法:机械传染是指病毒从植物表面的机械损伤侵入,引起植物的发病,机械传染病毒的接种方法,一般是将病株汁液在叶面摩擦,所以又称“汁液传染”或“汁液摩擦传染”。
但这种传染只限于大部分引起花叶型症状的病毒,因为这些病毒在寄主细胞中的浓度较高同时在寄主体外的存活力也较长,通过汁液接种便可证实病毒是由机械传染的。
具体操作步骤如下:先用肥皂将手彻底洗净,取病毒病的病叶,用清水洗净,放入研钵中,磨碎挤出汁液,接种于无病烟草,选择生长健壮具有4—5个叶片的烟草植株,作为接种寄主,每株接2—3个叶片,接种时先用清水冲洗待接种的叶片,晾干后再撒上少许金刚砂(600目)或硅藻土,以左手托着叶片,用右手食指蘸取少量病毒汁液。
在接种叶片上轻轻摩擦,要求仅使叶片表皮细胞造成微伤口而不死亡,接种后用清水洗去接种叶片上的残留汁液,在标签纸上写出接种日期、班级及姓名并贴于花盆上。
将接种的植株放在防虫的温室或纱笼中,在
20—25℃条件下培养,
7—14日内随时注意观察其发病情况。
附图:。


番木瓜环斑病毒(PRSV)人工摩擦接种西葫芦
一实验目的
通过人工摩擦接种方法,将番木瓜环斑病毒(papaya ring spot virus,PRSV)接种到健康的西葫芦幼苗。
学习常规的汁液接种技术。
二实验方法
植物病毒不同于真菌和细菌,属于被动侵入寄主的类型。
在自然界里大多依靠机械摩擦或生物介体完成传播。
故在实验室中常用病株汁液作为人工接种的材料,将其有效地接种到试验材料上。
三实验材料
材料:侵染了PRSV的表现症状明显的番木瓜叶片;生长健康的3-4叶期的西葫芦幼苗。
研钵与研棒、纱布、洗瓶、金刚砂、0.05 mol/L pH7.2 的磷酸缓冲液(PBS)、标签、记号笔等。
四实验过程
(1)剪取小块含病毒的叶片(1 g)放在研钵中并加入适量磷酸缓冲液(10 mL),研磨成糊状。
(2)在植物幼嫩的叶面上洒少许金刚砂。
(3)用纱布蘸取少量病样汁液在洒了金刚砂的叶面上轻抹2-3次,之后用洗瓶内的水清洗叶面。
另外在花盆中要插入标签,注明病毒样品代号、寄主、接种日期和接种人等
(4)管理和记载:有专人负责植物的日常管理,每2-3天记载一次发病情况,注意接种叶和新叶上的症状是否一致。
五实验要点
(1)供试植物材料的叶面和每个人的手指都要在实验前洗净以保证成功率。
(2)摩擦接种的动作要轻,不要弄破叶片,单方向进行;接种后用洗瓶将叶面冲洗干净以免影响以后的观察。

植物病毒病检测及防治的研究进展摘要:植物病毒病又称植物癌,给农作物及经济作物带来了严重危害,降低了农作物产量和质量,每年仅在我国因病毒感染农作物造成的损失就可达200亿美元,植物病毒病造成的损失是世界人口生存的威胁之一。
关键词:植物病毒病;检测;防治一、植物病毒病的检测技术病毒有两种,以DNA为遗传物质的病毒称为DNA病毒,以RNA为遗传物质的病毒称为RNA病毒,90%的植物病毒是RNA病毒。
早期RNA植物病毒病的检测一般采用传统的生物学方法(指示植物检测法),即通过汁液摩擦接种或嫁接传染方式,将待测带毒植株汁液接种到一株或多株指示植物上,从而观察其在指示植物上的症状。
指示植物是对某一种或某几种病毒和类病毒敏感的植物,感染后可迅速出现明显症状。
传统生物学方法鉴定谱广,操作简单,但需培育大量指示植物,检测速度慢,易受外界环境影响。
随着电子显微镜的出现,病毒的真实形态才得以展现。
电子显微镜观察结果直观、准确,还能观察病毒引起的寄主细胞病变及内含体特征,是深入研究病毒病机理的重要手段之一。
但仪器设备昂贵,制片及操作技术复杂,难以掌握,对操作人员技术水平要求高。
由于每一种植物病毒产生的抗血清各有特性,人们研发一种利用抗原抗体外特异性免疫反应检测植物病毒的方法。
酶联免疫吸附法(ELISA)是通过酶催化颜色反应将抗原抗体结合起来的一种方法,其具有灵敏、快速、特异性强、分析率高、成本低等优点,可用于大规模样品检测,是血清学中应用最广泛的方法,已成为检测植物病毒的关键技术。
随着生物体遗传物质研究的逐步深入,人们发现通过核酸能准确、快速地鉴定植物、动物和微生物的物种和种群。
基于核酸检测的分子生物学方法比血清学方法具有更宽的检测范围、更高的灵敏度、更强的特异性,适用于大批量样本检测,在植物病毒检测中得到了迅速而广泛的应用。
包括核酸杂交技术(Nucleic acid hybridiza-tion)、反转录PCR技术(RT-PCR)、荧光定量PCR技术(real-timePCR)、DNA微阵列技术(DNA microarray)。

关于“烟草花叶病毒的感染和重建实验”的几个疑惑点探析作者:盛国跃来源:《中学生物学》2020年第04期摘要:主要以Fraenkel-Conrat H,Williams R C于1955年发表的《Reconstitution of active tobacco mo-saic virus from Its inactive protein and nucleic acid components》(《活性烟草花叶病毒活性蛋白及核酸成分的重组》)Fraenkel-Conrat H,Singer B于1957年发表的《Virus reconstitution:Ⅱ.Combination ofpro-tein and nucleic acidfrom different strains》(《病毒重组:Ⅱ来自不同品系的蛋白质与核酸的结合》)两篇论文为依据,对学生在学习烟草花叶病毒的感染和重建实验过程中经常产生的三个疑惑点进行探析。
关键词:烟草花叶病毒病毒感染病毒重建中图分类号:Q-49 文献标志码:E烟草花叶病毒的感染和重建实验是证明核酸是遗传物质的证据链中关键的一环。
学生在学习时,经常h会对该实验中的几个操作产生疑惑。
其原因有:①在经全国中小学教材审定委员会2004年及2019年初审通过的各个版本高中生物学教材中对这一实验的介绍都很少,如人教版只是简单地说明了实验的结论,苏教版只以“知识海洋”的方式做了简介,浙科版对这一实验的着墨相对较多,但也基本没有提及具体的操作过程。
②与生物学教学相关的杂志中,这方面的相关论文也极少,在中国知网上以烟草花叶病毒为关键词,以生物学通报为文献来源进行检索,只搜到3篇论文。
下面以浙科版教材为例,对学生经常产生的三个疑惑点进行探析。
1使烟草花叶病毒感染烟草的操作方法1.1疑惑:如何进行烟草花叶病毒感染烟草的操作在浙科版高中生物学教材中多次提及“感染”操作,如“用RNA和蛋白质分别去感染烟草”“分别来自不同病毒株系的RNA和蛋白质混合后感染烟草”等。

植物病理学报ACTAPHYTOPATHOLOGICASINICA㊀45(1):88 ̄92(2015)收稿日期:2014 ̄03 ̄01ꎻ修回日期:2014 ̄10 ̄09基金项目:质检公益性行业科研专项项目(201310068)ꎻ浙江省重中之重林学一级学科开放基金项目(KF201330)ꎻ浙江农林大学科研发展基金项目(2013FK019)通讯作者:周雪平ꎬ教授ꎬ主要从事植物病毒学研究ꎻE ̄mail:zzhou@zju.edu.cnꎮdoi:10.13926/j.cnki.apps.2015.01.013研究简报利用小RNA深度测序和组装技术鉴定紫藤花叶病病原苏秀1ꎬ2ꎬ徐毅1ꎬ陈莎1ꎬ傅帅1ꎬ钱亚娟1ꎬ张立钦2ꎬ周雪平1∗(1浙江大学生物技术研究所ꎬ杭州310058ꎻ2浙江农林大学亚热带森林培育国家重点实验室培育基地ꎬ临安311300)DetectionofvirusesinfectingWisteriasinensisbydeepsequencingandassemblyofsmallRNA㊀SUXiu1ꎬ2ꎬXUYi1ꎬCHENSha1ꎬFUShuai1ꎬQIANYa ̄juan1ꎬZHANGLi ̄qin2ꎬZHOUXue ̄ping1㊀(1InstituteofBiotechnologyꎬZhejiangUniversityꎬHangzhou310058ꎬChinaꎻ2TheNurturingStationfortheStateKeyLaboratoryofSubtropicalSilvicultureꎬZhejiangAgricultureandForestryUniversityꎬLin an311300ꎬChina)Abstract:PlantdefenseagainstvirusesthroughsmallRNA(sRNA)mediatedRNAinterferencemechanism.AnalysisofvirusderivedsRNAprofilesinplantcanbeappliedfordenovoassemblyofvirusgenomesandvirusidentification.Inthisstudyꎬsuspectedvirus ̄infectedWisteriasinensissamplescollectedfromZijingangCampusofZhejiangUniversitywereusedforsRNAlibraryconstructionanddeepsequencing.AfterassemblyoftotalsRNAsꎬitwasfoundthatW.sinensisleaveswereinfectedbyWisteriaveinmosaicvirus(WVMV).Thelibrarygenerated18.9millionsRNAreadsꎬofwhich0.32millionwereWVMV ̄derivedsRNAs.Usingdenovoassemblyꎬ23.3%offulllengthgenomenucleotidesequenceofapreviouslyreportedpotyvirusWVMVwasobtained.ToconfirmtheexistenceofWVMVinthesamplesꎬWVMVcoatprotein(CP)genesequencewasobtainedbyRT ̄PCRꎬandensuredbySangersequencing.TakentogetherꎬthedatasuggestthatsRNAdeepsequencingtechnologyisanefficientandpowerfulgenetictoolforvirusidentificationinwoodyplants.Keywords:smallRNAꎻWisteriaveinmosaicvirusꎻdeepsequencing文章编号:0412 ̄0914(2015)01 ̄0088 ̄05㊀㊀RNA沉默(RNAsilencing)是一种在真核生物体内普遍保守的基于核酸序列特异性抑制基因表达的调控机制[1]ꎮ2009年Kreuze等[2]发现病毒特异的小RNA(smallRNAꎬsRNA)在序列上是重叠的ꎬ因此推测通过深度测序技术获得的大量sRNA序列能用来组装病毒的基因组并用来鉴定和发现新病毒ꎮ利用sRNA深度测序技术已在作物和昆虫上鉴定发现多种病毒[3㊁4]ꎬ但在木本植物上还未见报道ꎮ㊀㊀紫藤(Wisteriasinensis)是城市园林绿化美化的主要植物ꎬ在公园㊁校园㊁庭院等地普遍种植ꎮ由紫藤花叶病毒引起的紫藤花叶病在捷克㊁意大利㊁荷兰㊁美国㊁波兰㊁德国等都有发生ꎬ已成为一种世界性的病害ꎮ紫藤花叶病主要表现花叶㊁斑驳㊁黄化㊁脉明等症状ꎬ感病紫藤开花能力明显下降ꎬ严重影响其观赏性和经济价值ꎮ2006年Fan等[5]报道了紫藤脉花叶病毒北京分离物(WVMV ̄BJ)的全序列ꎬ并证实WVMV ̄BJ是Potyvirus中的一种新病毒ꎮ本文利用深度测序技术对采自浙江的紫藤花叶病病原进行了鉴定ꎮ1㊀材料与方法1.1㊀材料来源㊀㊀表现花叶症状的紫藤病叶采自浙江大学紫金㊀㊀1期苏秀ꎬ等:利用小RNA深度测序和组装技术鉴定紫藤花叶病病原港校区校园内ꎮ感病紫藤叶片表现褪绿㊁花叶㊁斑驳㊁黄化㊁脉明㊁叶片变小㊁卷曲等症状ꎬ并出现小的星状斑ꎬ褪绿部分生长较慢ꎬ致使叶片畸形(图1)ꎮFig.1㊀Wisteriasinensisleavesshowingchloroticspotsꎬblotchesandleafdistortion1.2㊀植物总RNA提取和sRNA纯化㊀㊀采集的样品用TiangenmiRcutemiRNA提取分离试剂盒提取总RNAꎬ操作步骤参照说明书进行ꎬ然后运用醋酸锂和聚乙二醇法(LiAC/PEG)分离其中的sRNAꎬ经15%的PAGE分离切割18~28nt的sRNAꎮ1.3㊀sRNA的Solexa深度测序㊀㊀上述sRNA样品送至上海美吉生物医药科技有限公司进行测序ꎮ测序流程:运用TaKaRasmallRNAcloningkit(DRR065)将分离的18~28nt的sRNA分别在3ᶄ端和5ᶄ端加上接头ꎻ随机引物反转录获得cDNA第一链ꎻPCR富集ꎻ产物回收(6%NovexTBEPAGEgelꎬ1.0mmꎬ10well)ꎻTBS380(Picogreen)定量ꎬ按数据比例混合上机ꎻcBot上桥式扩增ꎬ生成clustersꎻ运用IllumiaSolexa的Hiseq2000测序平台ꎬ进行1ˑ50bp测序试验ꎮ1.4㊀Solexa测序数据的预处理㊀㊀运用生物信息学手段对原始数据进行处理:去接头序列ꎬ去污染序列ꎬ去低质量碱基ꎬ去未插入3ᶄ接头㊁5ᶄ接头的readsꎬ获得不含接头序列的sRNA序列ꎬ在此基础上筛选出18~28nt的sRNA序列ꎮ1.5㊀测序数据的序列拼接㊁BLAST分析及病毒相关序列的筛查㊀㊀用Velvet软件对上述18~28ntsRNA进行序列拼接ꎬ得到的contigs用BLAST(BasicLocalAlignmentSearchTool)进行比对并注释ꎬ经过BLAST同源比对筛查到与紫藤脉花叶病毒北京分离物(WVMV ̄BJꎬGenBank登录号AY686816)同源ꎮ以WVMV ̄BJ为参考基因组ꎬ应用生物信息手段比对得到病毒来源的sRNAꎬ并对产生sRNA的热点区进行统计ꎮ1.6㊀RT ̄PCR扩增㊁克隆及序列分析㊀㊀提取植物总RNAꎬ采用TaKaRa公司的RNAReversePCRKit(AMV)反转录成cDNAꎬ以cD ̄NA为模板ꎬ利用根据拼接到的序列设计的特异性引物和Phusion超保真PCR试剂盒(NEB公司)进行PCR扩增ꎬPCR产物纯化后连接到PZeroBack载体(Tiangen)ꎬ并转化E.coli菌株DH5α感受态细胞ꎬ涂布于含氨苄青霉素的LB平板上ꎬ培养过夜后挑选单菌落ꎬ用Taq酶PCR扩增鉴定阳性克隆ꎬ随机挑取2个阳性克隆送Invitrogen公司进行测序ꎬ获得的序列利用BLAST进行比较分析ꎮ2㊀结果2.1㊀感病紫藤叶片sRNAs高通量测序结果㊀㊀感病紫藤叶片经总RNA提取ꎬsRNA分离㊁纯化和Solexa测序后得到18902046个readsꎬ经过Solexapipeline加工后ꎬ得到介于18~28nt之间的reads为4673447个ꎬ占总sRNAreads数量的24.72%ꎮ2.2㊀WVMV来源sRNAs(vsiRNAs)数据分析㊀㊀以WVMV ̄BJ为参考基因组ꎬ将上述经过筛选的4673447个reads进行本地BLASTt分析ꎬ在不包含重复序列的情况下ꎬ获得与参考基因组完全匹配的reads共9868个㊁允许1个错配的reads共45510个㊁允许2个错配的reads共113932个ꎮ重点分析了允许1个错配的情况ꎮ一共有315123个reads(包含重复序列)与WVMV ̄BJ匹配ꎬ其中20~24ntvsiRNA数量分别为7410㊁195697㊁99536㊁2950和1208个ꎬ其他长度的vsiRNA数98㊀植物病理学报45卷量为8402个ꎮ有1794681个来自正义链ꎬ135655个来自负义链ꎮ㊀㊀通过对不同长度的vsiRNA的读数百分比分析(图2)ꎬ可以看出21nt和22nt大小的sRNA占主要部分ꎮ不同长度sRNA占总数的百分比分别为:20nt2.35%㊁21nt62.10%㊁22nt31.59%㊁23nt0.94%㊁24nt0.38%ꎬ其他长度占2.67%ꎮ由此可见ꎬvsiRNA以21nt和22nt大小为主ꎬ可以推测紫藤的DCL4和DCL2在抗病毒中起了主要的作用ꎮFig.2㊀SizedistributionofWVMV ̄derivedsRNAs㊀㊀将vsiRNAs根据来自WVMV的正义链还是负义链进行分析ꎬ发现来自正义链的(57%)略高于来自负链的(43%)ꎮWVMV属于单链正义RNA病毒ꎬ其基因组正义链含量远高于互补链ꎬ而产生的sRNA比例比较接近ꎬ揭示WVMV复制过程中产生的双链RNA中间体可能是sRNA产生的主要来源ꎮ㊀㊀通过对WVMV来源sRNAs的5ᶄ端起始核苷酸碱基分析(图3)发现ꎬ总的WVMV来源的sRNAs中ꎬ5ᶄ端起始核苷酸碱基以 U ㊁ G ㊁ C ㊁ A 开头的比例分别是28.96%㊁20.29%㊁19.03%和31.70%ꎬ以 A 或 U 开头的sRNAs要比以 G 或 C 开头的多ꎬ并且在不同长度的sRNAs中也遵循这样的规律ꎮ这与受侵染拟南芥植株中TMV ̄Cg来源的21ntsRNAs的5ᶄ端起始核苷酸碱基分布一致ꎮ研究证实ꎬ拟南芥中不同的AGO蛋白在招募内源sRNA时ꎬ对其5ᶄ端起始核苷酸碱基具有不同的偏好性ꎻ然而ꎬ在紫藤与病毒的互作过程中ꎬAGO蛋白在招募sRNAs时是否也遵循同样的规律还需进一步的研究ꎮ㊀㊀利用基于Perl语言脚本的程序分析了WVMV来源sRNA在寄主中的热点分布(图4)ꎮ从紫藤叶片分离到的来源于WVMV的sRNA特异序列几乎覆盖了该病毒的全基因组ꎬ但在某些特定的区域ꎬ也称为热点(hotspots)区ꎬ各个sRNA序列出现的频率比较集中ꎮ在WVMV基因组的2600~2700㊁2900~3050㊁5900~6000㊁7800~7900以及9200~9500位置sRNA出现的频率较高ꎬ尤其是在9300~9390区域ꎬsRNA总量达到4230个ꎬ并且大部分来自病毒的正义链ꎬ说明该位点可能存在典型的RNA双链结构ꎮFig.3㊀WVMV ̄derivedsRNAs5ᶄterminalnucleotidepreference09㊀㊀1期苏秀ꎬ等:利用小RNA深度测序和组装技术鉴定紫藤花叶病病原Fig.4㊀PolaritydistributionofWVMV ̄derivedsRNAsFig.5㊀PositionanddistributionofWVMVsRNAcontigsThedifferentcolorsofcontigsrepresentthesequencehomologywithreferenceWVMV ̄BJgenome.Redmeanshighesthomologyꎬfollowedbypinkandgreen.2.3㊀WVMV的RT ̄PCR验证㊀㊀用velvet软件对18~28ntsRNA进行序列组装拼接ꎬ共得到894条contigsꎬ共有23条序列与已知的WVMV ̄BJ序列匹配ꎬ总长2254ntꎬ占WVMV ̄BJ基因组全长(9695nt)的23.3%(图5)ꎮ根据拼接到的序列设计特异引物ꎬ用RT ̄PCR方法ꎬ从测序样品的总RNA中克隆到971bp的片段ꎬ经测序及同源比对分析ꎬ与WVMV ̄BJ病毒序列相似性为87%ꎬ这段序列编码WVMV的CP基因(GenBank登录号KJ836282)ꎮ根据ICTV对马铃薯Y病毒属病毒命名的规定ꎬ此分离物与已知的WVMV ̄BJ是同一种病毒ꎮ3㊀讨论㊀㊀传统的植物病毒检测需要对病毒进行纯化和分离ꎬ对样品纯化要求较高ꎬ且需要对病原的生物学特性㊁理化特性㊁基因组特性㊁血清学特性等有预先的了解ꎬ对于未知病原ꎬ这些检测方法的使用就受到了极大限制ꎬ需要较长的研究周期和繁琐的研究过程ꎮ木本植物上的病毒往往含量比较低ꎬ且很难通过摩擦接种的方式进行人工接种ꎬ因此ꎬ传统方法很难检测木本植物病毒ꎬ相关的研究报道很少ꎮ㊀㊀已报道的紫藤花叶病毒北京分离物病原的鉴定是在酶联免疫吸附试验(ELISA)基础上ꎬ通过7次逆转录 ̄聚合酶链反应(RT ̄PCR)ꎬ并结合5ᶄRACE等方法得到的[5]ꎮ这些试验方法工作量很大ꎬ耗时长ꎬ较难用于紫藤等木本植物的病毒检测与鉴定ꎮ本文利用小RNA深度测序和组装技术ꎬ将分离自浙江的紫藤花叶病病原鉴定为WVMVꎮ深度测序技术的发展开辟了大规模快速诊断植物病毒的途径ꎬsRNA深度测序已在许多植物的未知病原鉴定中发挥了重要作用ꎮ利用植物体内的19㊀植物病理学报45卷sRNA病毒序列ꎬ大大提高了筛查木本植物病毒的效率ꎮ伴随着深度测序成本的降低ꎬsRNA深度测序将成为一种经济有效的可用于木本植物病毒鉴定的方法ꎬ值得推广使用ꎮ参考文献[1]㊀WaterhousePM.Genesilencingasanadaptivedefenseagainstviruses[J].Natureꎬ2001ꎬ411:834-842.[2]㊀KreuzeJFꎬPerezAꎬUntiverosMꎬetal.CompleteviralgenomesequenceanddiscoveryofnovelvirusesbydeepsequencingofsmallRNAs:Agenericmethodfordiagnosisꎬdiscoveryandsequencingofviruses[J].Virologyꎬ2009ꎬ388(1):1-7.[3]㊀WuQꎬLuoYꎬLuRꎬetal.Virusdiscoverybydeepsequencingandassemblyofvirus ̄derivedsmallsilen ̄cingRNAs[J].PNASꎬ2010ꎬ107(4):1606-1611.[4]㊀XuYꎬHuangLꎬWangZꎬetal.IdentificationofHimetobiPvirusinthesmallbrownplanthopperbydeepsequencingandassemblyofvirus ̄derivedsmallinterferingRNAs[J].VirusRes.ꎬ2013ꎬ14:pii:S0168-1702(13)00394-8.[5]㊀LiangWXꎬSongLMꎬTianGZꎬetal.ThegenomicsequenceofWisteriaveinmosaicvirusanditssimilari ̄tieswithotherpotyviruses[J].Arch.Viro.ꎬ2006ꎬ151:2311-2319.责任编辑:于金枝欢迎订阅«植物病理学报»«植物病理学报»是中国植物病理学会主办的全国性学术刊物ꎬ 中国科技核心期刊 ꎮ主要刊登植物病理学各分支未经发表的专题评述㊁研究论文和研究简报等ꎬ以反映中国植物病理学的研究水平和发展方向ꎬ推动学术交流ꎬ促进研究成果的推广和应用ꎮ本刊现已被英国农业与生物技术文摘(CAB)㊁联合国粮农组织AGRIS等收录ꎮ据«中国科技期刊引证报告»(2014年版)统计结果ꎬ«植物病理学报»影响因子0.832ꎮ荣获首届«中国学术期刊检索与评价数据规范»(CAJ ̄CD)执行优秀期刊奖㊁2012中国国际影响力优秀学术期刊奖和2013百种中国杰出学术期刊奖ꎮ本刊为双月刊ꎬ每期定价30元ꎬ全年6期共180元ꎮ邮发代号:82 ̄214ꎮ欢迎投稿ꎬ欢迎订阅ꎮ编辑部地址:北京市海淀区圆明园西路2号中国农业大学农学楼243室邮编:100193电话:(010)62732364E ̄mail:zwblxb@cau.edu.cnꎮ29。

实验六植物茎尖培养(理论)病毒对寄主植物可造成毁灭性危害,导致大幅度减产,甚至全株死亡。
潜隐性病毒侵染植物造成症状不明显的慢性危害,不易被发现,尤其危险。
国内外解决作物病虫害的有效途径是培育无病毒苗,实施农作物无病毒化栽培。
所谓“无病毒苗”,是指不含该种植物的主要危害病毒,即经检测主要病毒在植物内的存在表现阴性反应的苗木。
因此,培育无病毒母株,是获得无病毒苗的根本途径。
一、病毒在植物体内的分布及危害1、病毒在植物体内的分布病毒侵染植物叶片后即增殖并向附近细胞转移,尽管速度很慢,但经过一段时间,叶片内病毒浓度达到一定量而到达韧皮部。
1943年,White首先发现已感染的烟草植株生长点附近烟草花叶病毒浓度很低,甚至没有。
1948—1949年,Holmes和Masset等证实了病毒的分布随植株不同部位和年龄而异。
★老叶和成熟的组织中病毒含量高★幼嫩和未成熟的组织及器官中病毒含量较低★根尖、茎尖点约0.1~1mm区域中几乎不含病毒病毒的传播:筛管组织、胞间连丝、营养体及刀具、土壤茎尖分生组织无分化,没有维管组织。
2、病毒的危害已发现的植物病毒超过500种,草莓病毒曾使日本草莓的产量严重下降,品质退化。
★病毒危害极大★不能通过化学杀菌和抗生素进行防治和消除★研究脱毒方法意义重大二、植物脱毒的意义1、能够有效地保持优良品种的特性任何一种优良品种均需要有一个忠实地保存其遗传性状的繁殖方法。
离体无性繁殖:不会造成性状分离、不会产生退化、避免病虫害的侵染2、快速繁殖品种,使优良品种迅速应用离体繁殖周期短(1~3个月)、不受季节限制、繁殖系数高3、生产无病毒种苗,防止品种退化目前受病毒危害严重影响生产的有:大田作物:马铃薯、甘薯、甘蔗、烟草蔬菜:白菜、大蒜、葱、番茄、箩卜果树:柑橘、苹果、草莓、香蕉花卉:香石竹、各种菊花、天竺葵、紫罗兰4、节约耕地,提高农产品的商品率块根、块茎、鳞茎为繁殖器官的作物,每年产品用留作种的比例:大蒜:留种量占产量的五到八分之一;马铃薯:留种量占产量的十分之一;贝母:留种量占产量的三分之一。

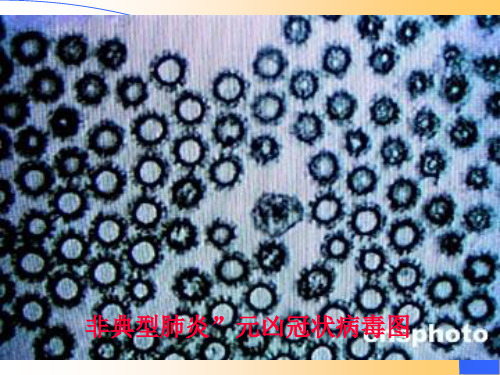

实验六植物病毒病及其传染方式一、实验目的认识植物病毒形态和病毒病主要症状类型,通过植物组织汁液的摩擦接种和蚜虫传播试验了解病毒病的主要传染方式。
二、讲解要点1.病毒颗粒很小,必须用电子显微镜才能观察到。
植物病毒颗粒可以分为圆球状(或等边多面体)、炮弹状、长杆状和线条状4种。
这些在课堂和本次实验课上只能通过观看电镜照片或幻灯片来了解。
2.植物病毒病的主要症状类型有花叶、变色、条纹、枯斑或环斑坏死、畸形。
应该注意:一方面这些症状类型的分辨在病毒病鉴定上具有比起它病害更重要的意义,另一方面在实际观察中,也会发现同一种病毒病在发病过程中或在不同环境条件下会有不同的表现(不同病状甚至隐症)。
3.病毒病多为系统性侵染,没有病征,易与非侵染性病害相混淆,往往需要通过一定方式的传染试验证实其传染性。
植物病毒病的传染方式有:机械(摩擦)接触传染、嫁接传染、介体(包括昆虫、线虫、真菌、螨类和菟丝子)传染、花粉及种子传染等。
由于病毒是专性寄生物,它的侵染来源都与活体(活的动、植物体或介体)有关,传染要使病毒接触活体。
例如汁液摩擦接种,要用新鲜的病毒汁液,摩擦的目的是造成寄主植物体表面的微伤,使病毒有可能进入活的细胞,过重的损伤造成组织坏死并不利于病毒的传染。
蚜虫、飞虱等刺吸式口器昆虫取食植物汁液的方式更容易满足植物病毒传播的两方面要求。
4.大白菜病毒病的症状为幼苗受侵后首先心叶出现明脉即沿叶脉失绿,继呈花叶及皱缩。
成株被害,出现不同程度的叶片皱缩、变硬而脆,后期出现褐色斑点或褐色坏死条纹;植株矮化。
我国十字花科蔬菜病毒病主要由芜菁花叶病毒(简称TuMV)、黄瓜花叶病毒(简称CMV)和烟草花叶病毒(简称TMV)所致,前两种病毒能由蚜虫和汁液传染,第三种只能以汁液传染。
马铃薯病毒病主要是皱缩花叶病和卷叶病两种。
前者的症状为叶片皱缩、变小;叶尖向下弯曲,全株矮化,叶片色泽深浅不均,以后出现黑褐色坏死斑,质地变脆,严重时全株发生坏死性叶斑,自下而上枯死。
番木瓜环斑病毒(PRSV)人工摩擦接种西葫芦
一实验目的
通过人工摩擦接种方法,将番木瓜环斑病毒(papaya ring spot virus,PRSV)接种到健康的西葫芦幼苗。
学习常规的汁液接种技术。
二实验方法
植物病毒不同于真菌和细菌,属于被动侵入寄主的类型。
在自然界里大多依靠机械摩擦或生物介体完成传播。
故在实验室中常用病株汁液作为人工接种的材料,将其有效地接种到试验材料上。
三实验材料
材料:侵染了PRSV的表现症状明显的番木瓜叶片;生长健康的3-4叶期的西葫芦幼苗。
研钵与研棒、纱布、洗瓶、金刚砂、0.05 mol/L pH7.2 的磷酸缓冲液(PBS)、标签、记号笔等。
四实验过程
(1)剪取小块含病毒的叶片(1 g)放在研钵中并加入适量磷酸缓冲液(10 mL),研磨成糊状。
(2)在植物幼嫩的叶面上洒少许金刚砂。
(3)用纱布蘸取少量病样汁液在洒了金刚砂的叶面上轻抹2-3次,之后用洗瓶内的水清洗叶面。
另外在花盆中要插入标签,注明病毒样品代号、寄主、接种日期和接种人等
(4)管理和记载:有专人负责植物的日常管理,每2-3天记载一次发病情况,注意接种叶和新叶上的症状是否一致。
五实验要点
(1)供试植物材料的叶面和每个人的手指都要在实验前洗净以保证成功率。
(2)摩擦接种的动作要轻,不要弄破叶片,单方向进行;接种后用洗瓶将叶面冲洗干净以免影响以后的观察。