“铝三角”及其应用
- 格式:pptx
- 大小:1.30 MB
- 文档页数:20

考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
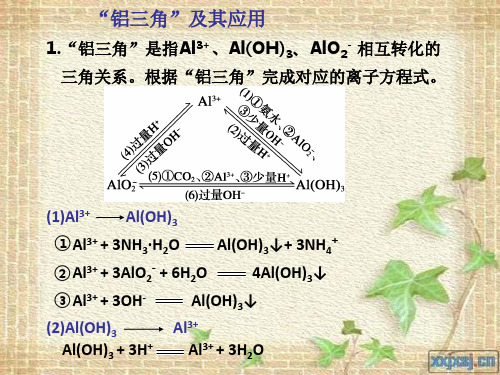
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。

铝三角化学
铝三角化学是一种新型的化学学科,它是近年来新兴的重要的化学学科之一。
它涉及原子结构、物理性质、化学特性和化学反应等多方面的内容,从而推动着它的发展和应用。
铝系元素的三角化学利用了铝的配位性和金属性,以及其与氧、硫、氟等无机或有机化合物的配位作用,以及铝原子的共价结合能,可以用来制备出丰富多样的功能性分子。
其中,部分金属配位物,如氯代烷基铝(AlCl3)、氧化铝(Al2O3)等,具有独特的光学和结构性质,广泛应用于许多医药、农药、农膜、防锈防潮剂等领域。
铝三角化学具有独特的化学性质,可以用来合成具有多种物理、化学和生态功能特性的新材料。
目前,有许多以铝三角结构为中心的材料研究正在进行,主要是设计出能够改善生物识别、重组和转换物质的新型功能材料,以满足不同的实际应用。
比如,人们研究开发了铝三角阳离子润湿剂,它具有良好的抗菌和抗霉性能,可用于消毒和抑制细菌繁殖。
此外,铝三角化学也发展出一系列高效、安全、绿色的水处理技术。
通过调节氯铝离子在水中的溶解度,可以有效减少水中的有机物和杂质,从而实现水的净化处理。
同时,通过利用铝的分子结构特性,可以制备抗菌剂,有效控制及消除有害微生物的繁殖,从而满足人们对安全饮用水的要求。
随着社会需求的不断增加,铝三角化学将会面临前所未有的发
展机遇。
国内外专家学者们正在深入探索其中全新的发展和应用方向,以实现铝三角化学在社会经济发展、生态环境保护和保健医疗等方面重要的贡献。
未来,铝三角化学将会发挥更大的作用,在不同领域的发展中将会发挥积极的作用。

高一化学铝三角知识点一、铝的性质铝是一种常见的金属元素,化学符号为Al,原子序数为13,在化学元素周期表中位于第三周期。
它具有以下几个主要的性质。
1.1 物理性质铝是一种轻质金属,其密度约为2.7g/cm³。
它具有良好的导电性和导热性,在常温下不磁性。
此外,铝具有较高的延展性和韧性,可以轻松地拉成细丝或轧制成薄片。
1.2 化学性质铝具有较强的氧化性,但其表面会形成一层致密的氧化铝膜,防止进一步的氧化反应发生。
铝在常温下与大多数非金属元素不发生反应,但在高温下可与氧、硫、卤素等反应。
此外,铝还可以与一些酸性或碱性溶液发生反应。
二、铝的三角知识点在化学学科中,铝的三角知识点主要涉及以下几个方面。
2.1 铝的制取铝的制取主要有金属铝的电解法、铝矾土的热法和金属铝的热还原法等几种方法。
其中,金属铝的电解法是目前最常用的工业制取方法。
在这个过程中,以氧化铝为原料,溶解在氟化铝和氯化钠的混合熔盐中,通过电解进行还原,得到纯度较高的金属铝。
2.2 铝和酸的反应铝在与酸反应时产生的产物取决于所用酸的类型。
在与多数非氧化性酸(如盐酸、硫酸)反应时,铝会被酸溶解生成相应的盐和氢气。
而当与氧化性酸(如硝酸)反应时,铝会被酸氧化生成相应的盐和氧气。
2.3 铝的氧化反应铝与氧气反应产生的氧化物是氧化铝,化学式为Al2O3。
这种氧化物具有很高的熔点和热稳定性,形成了一层致密的氧化铝膜,能够有效地保护铝材表面免受进一步的氧化侵蚀。
2.4 铝的还原反应铝具有较强的还原性,可以被一些金属离子还原成金属。
例如,当铝与铜(II)离子反应时,铜(II)离子被还原为铜金属,而铝本身被氧化为铝离子。
2.5 铝的应用铝具有许多重要的应用。
由于其轻质和良好的延展性,铝被广泛用于制造航空器、汽车、自行车等交通工具的结构部件。
此外,铝还在建筑、电子、包装等领域有广泛的应用。
三、总结铝是一种常见的金属元素,具有轻质、良好的导电性和导热性等物理性质。


铝三角关系铝三角关系是指由铝和其他两种元素组成的化合物。
铝作为一种常见的金属元素,与其他元素形成的化合物具有重要的应用价值和研究意义。
本文将从铝与其他两种元素的化合物的合成、性质和应用等方面进行介绍。
一、铝三角关系的合成铝与其他两种元素形成的化合物可以通过多种合成方法获得。
常见的合成方法包括化学反应、热处理和物理沉积等。
例如,通过铝与氧气的化学反应可以得到氧化铝;通过铝与硫的反应可以得到硫化铝。
此外,还可以通过在高温下将铝蒸发沉积在其他元素的表面来合成铝合金。
铝与其他两种元素形成的化合物具有多种性质。
首先,这些化合物通常具有良好的导电性和导热性,这归功于铝本身的良好导电性和导热性。
其次,铝化合物往往具有较高的熔点和硬度,这使得它们在高温和高压环境下具有良好的稳定性和耐磨性。
此外,铝化合物还可以表现出不同的颜色和光学性质,如氧化铝的白色和透明性。
三、铝三角关系的应用铝与其他两种元素形成的化合物在各个领域都有广泛的应用。
首先,铝合金作为一种轻质高强度材料,被广泛应用于航空航天、汽车制造和建筑等领域。
其次,铝氧化物作为一种绝缘材料,被广泛应用于电子器件的绝缘层和光学玻璃的基底。
此外,铝硫化物还可以用作催化剂和防腐剂等。
总结起来,铝三角关系是指由铝和其他两种元素组成的化合物。
铝与其他两种元素的化合物可以通过化学反应、热处理和物理沉积等方法合成。
这些化合物具有良好的导电性和导热性、较高的熔点和硬度,以及不同的颜色和光学性质。
它们在航空航天、汽车制造、建筑、电子器件和光学玻璃等领域都有广泛的应用。
铝三角关系的研究将进一步推动材料科学和化学工艺的发展。
(九)“铝三角”关系与Al(OH)3图像分析(对应学生用书第83页)突破1| “铝三角”关系及应用[考纲知识整合]1.Al3+、Al(OH)3、[Al(OH)4]-之间的转化关系2.“铝三角”转化的应用(1)判断离子共存问题:Al3+与OH-及[Al(OH)4]-、CO2-3、S2-等弱酸根阴离子;[Al(OH)4]3+、Fe3+等因生成沉淀或发生水解相互促进反应而不能大量-与H+、HCO-3以及弱碱阳离子Al共存。
(2)鉴别(利用滴加顺序不同,现象不同)①向AlCl3溶液中滴加NaOH溶液,先产生白色沉淀,后沉淀溶解。
②向NaOH溶液中滴加AlCl3溶液,开始无明显现象,后产生白色沉淀,沉淀不溶解。
3.判断铝元素的存在形式(1)可溶性铝盐与强碱(如NaOH)溶液反应,铝元素的存在形式(2)可溶性四羟基合铝酸盐与强酸(如HCl)溶液反应,铝元素的存在形式[高考命题点突破]命题点“铝三角”关系及应用1.(2018·西安名校三检)某无色透明溶液与铝反应放出氢气,该溶液中可能含有Mg2+、Cu2+、Ba2+、H+、Ag+、SO2-4、SO2-3、HCO-3、OH-、NO-3十种离子中的若干种,下列推断正确的是( )A.当溶液中有Al3+生成时,溶液中可能存在:SO2-4、NO-3、H+、Mg2+B.当溶液中有Al3+生成时,溶液中一定存在:H+、SO2-4;可能存在Mg2+C.当溶液中有[Al(OH)4]-生成时,溶液中一定存在:OH-、Ba2+、NO-3D.当溶液中有[Al(OH)4]-生成时,溶液中可能存在:OH-、Ba2+、NO-3、SO2-3B[据题意,一定不含有Cu2+、HCO-3。
当溶液中有Al3+生成时,原溶液中含有H+,不可能有NO-3(产生的气体为NO)、SO2-3、OH-,据电中性原理知其中必定含有SO2-4,于是不能存在Ba2+、Ag+,可能含有Mg2+,A项错误,B项正确;当溶液中有[Al(OH)4]-生成时,原溶液含有OH-,肯定没有H+、Ag+、Mg2+,据电中性原理知其中必定含有Ba2+,于是不可能含有SO2-3、SO2-4,可能含有NO-3,C、D项错误。
高二化学《铝三角及其应用》说课稿作为高中的化学老师,要怎么写好说课稿呢?以下是一篇关于高二化学《铝三角及其应用》说课稿的范文,供大家参考,希望对大家有帮助!尊敬的各位领导、评委,大家好,我是化学组教师李显胜,今天我说课的内容是人教版高二化学必修教材第四章第一节镁和铝中的一节专题课,课题是:铝三角及其应用。
下面我从几个方面谈谈我对本节课的教学构想。
②。
横式移位练习。
练习在横式中移动小数点位置时,由于“划、移、点”只反映在头脑里,这就需要学生把转化前后的算式建立起等式,使人一目了然。
(1)判断下面的等式是否成立,为什么?一. 说理念本节课意在着重培养学生的各种思维能力和运用知识处理实际问题的能力,充分体现学生主动学习、思考的行为习惯,让他们尝试着运用所学知识和方法去寻求解决问题的策略。
我在设计这节课时,通过大量的问题来激发学生思考,让学生人人参与活动,并培养他们的合作学习精神。
二. 说教材铝三角及其应用是本节内容的一个重点,也是高考的重要考点,既是对铝三角转化知识的总结,又是对铝及其化合物转化知识的延伸,是知识向能力转化的一座重要桥梁。
三维目标:1. 知识与能力:正确理解和掌握铝三角间的转化关系,了解它们在实际中的应用,培养学生应用理论解决实际问题的能力和思维能力。
2. 过程与方法:充分利用学生已有的知识经验,创设问题情景,让学生人人参与,主动学习和思考,使他们在问题情景中获得知识和体验。
拿出第三组教具(两个完全一样的钝角三角形)。
用同样方法进行操作,交流。
从而总结出:两个完全一样的钝角三角形也能拼成一个平行四边形。
情感与价值观:通过问题的讨论、交流与探讨,进一步提高学生的合作学习精神,使他们树立起事物间可以转化的辩证唯物主义观点,提高学习化学的积极性。
四. 说教法本节课采用“引导探究”的教学模式,问题开路,各个击破,层层深入,从而获取新知识。
在整个教学过程中让问题贯串课堂的始终,使学生在解决问题的同时,不知不觉地获取新知。
①过量OH —②过量H +③H + ④OH —⑤H + ⑥OH —“铝三角”的图像分析及计算一、镁、铝的工业制法 1、镁的工业制法:(从海水中提取镁)2、铝的工业制法:(以铝土矿为原料) 二、铝三角及应用1、三角关系:Al 3+、Al(OH)3与AlO 2—相互转化的关系有关离子方程式:A 、Al 3+与AlO 2—的相互转化①Al 3+→AlO 2—:②AlO 2—→Al 3+:B 、AlO 2—与Al(OH)3的相互转化③AlO 2—→Al(OH)3: ④Al(OH)3→AlO 2—: C 、Al 3+与Al(OH)3的相互转化⑤Al(OH)3→Al 3+: ⑥Al 3+→Al(OH)3: 2、铝三角的应用①制取Al(OH)3Al 3+ + 3NH 3·H 2O == Al(OH)3↓+3NH 4+(常用方法)AlO 2— + CO 2 + 2H 2O == Al(OH)3↓+ CO 32—②离子共存问题:a 、Al 3+与OH —、S 2—、AlO 2— 、HCO 3—、CO 32—、HSO 32—等离子因生成沉淀或双水解而不能大量共存;b 、AlO 2—与Al 3+、H +、NH +、Fe 3+等离子因生成沉淀或双水解反应而不能大量共存。
三、铝的化合物的有关图象1、向AlCl 3溶液中逐滴滴入NaOH 溶液至过量(如图①) 有关反应:Al 3+ + 3OH —== Al(OH)3↓Al(OH)3 + OH —== AlO 2—+ 2H 2O现象:先产生白色沉淀,后沉淀逐渐消失2、向AlCl 3溶液中逐滴滴入氨水至过量(如图②) 有关反应:Al 3+ + 3NH 3·H 2O == Al(OH)3↓ +3NH 4+ 现象:产生白色沉淀,继续加氨水,沉淀不消失。
3、向NaOH 溶液中逐滴滴入AlCl 3溶液至过量(如图③) 有关反应:Al 3+ + 4OH —== AlO 2—+ 2H 2OAl 3+ +3 AlO 2—+ 6 H 2O == 4Al(OH)3↓现象:先无白色沉淀,后产生白色沉淀,继续滴加,沉淀不变化。