北京高考化学一轮复习第27讲盐类的水解作业
- 格式:doc
- 大小:729.00 KB
- 文档页数:8

2020届北京高三化学一轮复习盐类的水解(综合测试)一、选择(单选,共42分)1、相同温度、相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分别为()A.NH4Cl(NH4)2SO4CH3COONaB.(NH4)2SO4NH4Cl CH3COONaC.(NH4)2SO4NH4Cl NaOHD.CH3COOH NH4Cl(NH4)2SO4答案 B2.室温下,0.5 mol·L-1相同体积的下列四种溶液①KCl、②FeCl3、③HF、④Na2CO3,其中所含阳离子数由多到少的顺序是()A.④>①=②>③B.①>④>②>③C.④>①>③>②D.④>②>①>③答案 D3.常温下,Na2CO3溶液中存在平衡:CO2-3+H2O HCO-3+OH-,下列有关该溶液的说法正确的是()A.离子浓度:c(Na+)>c(CO2-3)>c(OH-)>c(H+)B.升高温度,平衡向逆反应方向移动C.加入CaCl2浓溶液,溶液的pH增大D.加入NaOH固体,溶液的pH减小答案 A2.为了配制NH+4的浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入()①适量的HCl②适量的NH4Cl固体③适量的氨水④适量的NaOHA.①②B.③C.②③D.③④答案4(2019年湖北恩施)下列与盐的水解有关的是()①NH4Cl溶液与ZnCl2溶液均可作焊接金属中的除锈剂②NaHCO3溶液与Al2(SO4)3溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干AlCl3溶液得到Al(OH)3固体A.只有①②③B.只有②③④C.只有①④⑤D.①②③④⑤答案 D5、(2018·广州调研)下列关于FeCl3水解的说法错误的是()A.在FeCl3稀溶液中,水解达到平衡时,无论加FeCl3饱和溶液还是加水稀释,平衡均向右移动B.浓度为 5 mol·L-1和0.5 mol·L-1的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者小于后者C.其他条件相同时,同浓度的FeCl3溶液在50 ℃和20 ℃时发生水解,50 ℃时Fe3+的水解程度比20 ℃时的小D.为抑制Fe3+的水解,更好地保存FeCl3溶液,应加少量盐酸答案 C6.下列有关工农业生产和实验中与盐的水解无关的是()A.金属焊接时可用NH4Cl溶液作除锈剂B.配制FeSO4溶液时,加入一定量Fe粉C.长期施用铵态氮肥会使土壤酸化D.向FeCl3溶液中加入CaCO3粉末后有气泡产生答案 B7、有关下列两种溶液的说法中,正确的是()①0.1 mol·L-1 CH3COONa溶液②0.1 mol·L-1 CH3COOH溶液A.相同温度下,溶液中水的电离程度:溶液①>溶液②B.等体积混合溶液①和溶液②,所得溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C.加水稀释溶液①,溶液中c CH3COOH·c OH-c Na+不变D.向溶液①中加少量的CH3COONa固体则c CH3COO-c Na+减小答案 A8.25 ℃时实验测得0.10 mol/L的NaHB溶液的pH=9.1。

第27讲盐类的水解A组基础题组1.物质的量浓度相同的下列溶液中( )A.NH4Cl溶液B.CH3COONH4溶液C.NH4HSO4溶液D.NH4HCO3溶液2.下列说法正确的是( )A.100 ℃时水的离子积常数K W为5.5×10-13,说明水的电离是放热过程B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸C.NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强D.0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中的c(OH-)都增大3.常温下,有关 0.1 mol/L NH4Cl 溶液(pH<7)的下列说法不正确...的是( )A.根据以上信息,可推断出NH3·H2O为弱电解质B.加水稀释过程中,c(H+)·c(OH-)的值增大C.加入K2CO3固体可促进D.相同pH的NH4Cl溶液和CH3COOH溶液,由水电离出的c(H+)前者大4.常温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),下列关系或说法一定正确的是( )A.c(Na+)+c(H+)=c(HB-)+2c(B2-)B.c(H+)·c(OH-)=10-14C.c(Na+)=c(B2-)+c(HB-)D.溶液的pH=15.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )A.在Na2A、NaHA两溶液中,离子种类不相同B.在溶质的物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)6.经测定某溶液中只含Cl-、H+、OH-四种离子,已知这种溶液含有一种或两种溶质。

课练27 盐类的水解————————[狂刷小题夯基础]—————————[练基础]1.下列各物质对水的电离不会产生影响的是( )A.氯化钠B.氯化铵C.氯化铁D.氯化氢2.下列说法正确的有①pH=0的溶液中,Fe3+与S2-因发生相互促进的水解反应而不能共存;②MgCl2溶液蒸干灼烧后得MgO固体,如果想要得到MgCl2固体应通入HCl的气流;③将0.1 mol的Na2CO3溶于水中,形成的溶液中阴离子总数小于0. 1N A;④HCO-3和AlO-2在溶液中因为互相抑制的水解而能大量共存;⑤将I2加入NaHSO3溶液中发生反应:HSO-3+I2+3OH-===SO2-4+2I-+2H2O;⑥pH =2的盐酸和醋酸,均稀释到pH=5,醋酸加水量大;⑦向NaHSO3溶液中加入少量NaOH固体,c(SO2-3)/c(HSO-3)将增大( )A.2个 B.4个 C.5个 D.7个3.已知酸H2B在水溶液中存在下列关系:①H2B===H++HB-,②HB-H++B2-,则下列说法一定正确的是( )A.在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B)B.NaHB溶液中可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+)C.NaHB溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-)D.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性4.常温下,下列溶液中的微粒浓度关系不正确的是( )A.pH=8.3的某酸式盐NaHB的水溶液中:c(Na+)>c(HB-)>c(H2B)>c(B2-)B.pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH+4)>c(OH -)C.含等物质的量的NaHC2O4和Na2C2O4的溶液中:2c(Na+)=3[c(HC2O-4)+c(C2O2-4)+c(H2C2O4)]D.0.10 mol·L-1CH3COONa溶液中通入HCl至溶液的pH恰好等于7,则c(Na+)>c(CH3COOH)=c(Cl-)5.10 ℃时加热NaHCO3溶液,测得溶液pH发生如下变化:温度/℃10 20 30 加热煮沸后冷却到50 ℃pH 8.3 8.4 8.5 8.8下列判断正确的是( )A.50 ℃时,c(OH-)=1×10-5.2mol·L-1B.30 ℃时,c(Na+)=c(HCO-3)+2c(CO2-3)C.升高温度,c(Na+)/c(HCO-3)增大D.将NaHCO3溶液蒸干并灼烧,得到NaOH固体6.(多选)改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数α(X)随pH的变化如图所示[已知α(X)=c Xc H2A+c HA-+c A2-,X表示含A微粒]。


北京卷专题分析:盐类水解时间题型考查内容备注2004 11.选择题二元弱酸及其盐溶液中离子浓度之间的关系H2A及其盐2005 11.选择题A选项:温度对水解平衡移动影响水解平衡移动27填空题FeCl3蒸发结晶过程的水解抑制水解平衡抑制2006 11.选择题D选项:弱酸强碱盐水解考查水解因素28.填空题FeCl3水解制备胶体水解应用2007 12选择题D选项:不同程度的弱酸强碱盐溶液水解情况综合考查酸性→水解程度2008 6.选择题通过化学用语考查盐类水解离子的水解程度26填空题NaCN水解:CN-+H 2O HCN+OH- 阴离子水解2009 11.选择题盐类水解的促进与抑制水解因素的影响26.填空题FeSO4溶液配制过程中的水解抑制水解应用2010 10选择题Na2CO3溶液水解水解方程式2011 9选择题C选项Al3+水解水解方程式二.考试要求考试说明II-7-(8) 要求(8)理解盐类水解的原理,掌握影响盐类水解程度的主要因素和盐类水解应用[II]三.考查形式1(2004-bjlz-11).已知L的二元酸H2A溶液的PH=,则下列说法中正确的是A.在Na2A、NaHA两溶液中,离子种类不相同B.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C.在NaHA溶液中一定有:[Na+]+[H+]=[HA-]+[OH-]+2[A2-]D.在Na2A溶液中一定有:[Na+]>[A2-]>[H+]>[OH-]2(2005-bjlz-11).下列有关pH变化的判断中,正确的是A.随着温度的升高,碳酸钠溶液的pH减小B.随着温度的升高,纯水的pH增大C.新氯水制经光照一段时间后,pH减小D.氢氧化钠溶液久置于空气中,pH增大3(2006-bjlz-11).某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH>7,编号HX YOH 溶液的体积关系(1)强酸强碱V(HX)=V(YOH)(2)强酸强碱V(HX)<V(YOH)(3)强酸弱碱V(HX)=V(YOH)(4)弱酸强碱V(HX)=V(YOH)A.(1)(3)B.(2)(3)C.(1)(4)D.(2)(4)4(2007-bjlz-12).有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25mL,物质的量浓度均为L,下列说法正确的是种溶液pH的大小顺序是③>②>①B.若将3种溶液稀释相同倍数,pH变化最大的是②C.若分别加入·L-1盐酸后,pH最大的是①D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②5(2008-bjlz-6).对H2O的电离平衡不产生影响的粒子是:••••Cl: B.26M3+C. D.6(2009-bjlz-11).有4L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3下列各项排序正确的是:②>③>④>①(CH3COO-):②>④>③>①C.溶液中c(H+):①>③>②>④(CH3COOH):①>④>③>②7(2010-bjlz-10).下列解释实验事实的方程式不准确...的是A.0.1mol/L CH3COOH溶液的pH>1:CH3COOH CH3COO-+H+B.“NO2球”浸泡在冷水中,颜色变浅:2NO2(g)N2O4(g);△H<0C.铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO3-===3Fe2++2NO↑+4H2OD.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+H2O HCO3-+OH-8(2011-bjlz-9).下列与处理方法对应的反应方程式不正确的是A.用Na2S去除废水中的Hg2+:Hg2++S2-=HgS↓B.用催化法处理汽车为其中的CO和NO:CO+NO催化剂C+NO2C.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O Al(OH)3(胶体)+3H+D.用高温催化氧化法去除烃类废气(C x H y):C x H y +(x+y/4)O2催化剂△xCO2+y/2H2O填空题1(2005-bjlz-27)(18分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。
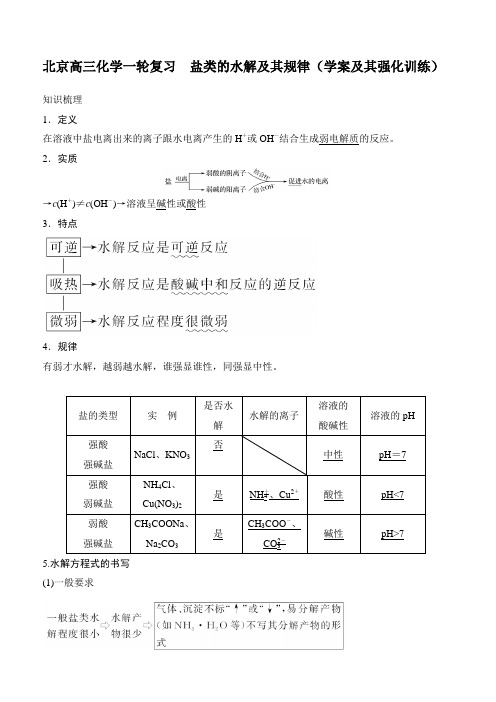
北京高三化学一轮复习盐类的水解及其规律(学案及其强化训练)知识梳理1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OH-结合生成弱电解质的反应。
2.实质→c(H+)≠c(OH-)→溶液呈碱性或酸性3.特点4.规律有弱才水解,越弱越水解,谁强显谁性,同强显中性。
5.水解方程式的书写(1)一般要求如NH4Cl的水解离子方程式为NH+4+H2O NH3·H2O+H+。
(2)三种类型的盐水解方程式的书写。
①多元弱酸盐水解:分步进行,以第一步为主,一般只写第一步水解方程式。
如Na2CO3的水解离子方程式为CO2-3+H2O HCO-3+OH-。
②多元弱碱盐水解:水解离子方程式一步写完。
如FeCl3的水解离子方程式为Fe3++3H2O Fe(OH)3+3H+。
③阴、阳离子相互促进的水解:水解程度较大,书写时要用“===”、“↑”、“↓”等。
如Na2S溶液与AlCl3溶液混合反应的水解离子方程式为2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑。
提示:有时阴、阳离子相互促进水解,但水解程度仍较小,离子间可以共存,书写水解离子方程式时仍用“”不写“↓、↑”。
6.盐类水解常数(K h)A-+H2O HA+OH-B++H2O BOH+H+[名师点拨]盐类水解的规律及拓展应用1.“谁弱谁水解,越弱越水解”。
如酸性:HCN<CH3COOH,则相同条件下碱性NaCN>CH3COONa。
2.强酸的酸式盐只电离,不水解,溶液显酸性。
如NaHSO4在水溶液中:NaHSO4===Na++H ++SO2-4。
3.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中: HCO -3H ++CO 2-3(次要),HCO -3+H 2OH 2CO 3+OH -(主要)。
(2)若电离程度大于水解程度,溶液显酸性。
2019年北京顺义高三化学一轮复习盐类水解及应用(学案)【考纲要求】1.了解盐类水解的原理。
2.了解影响盐类水解程度的主要因素。
3.了解盐类水解的应用。
【教学过程】【基础自主落实】一、盐类水解1.定义:在溶液中盐电离出来的离子跟产生的H+或OH-结合生成的反应。
2.实质:3.特点:4.水解的规律及类型有弱才水解,越弱越水解;谁强显谁性,同强显中性。
【学情检测】1.填写下面空白(1)Na2CO3溶液呈____性(填“酸”“碱”或“中”),其原因是什么?____________(用方程式表示)。
在Na2CO3溶液中存在哪些离子?试写出离子浓度由大到小的顺序:。
(2)NaHCO3溶液呈______性(填“酸”“碱”或“中”),中存在哪些平衡关系?试一一写出。
在NaHCO3溶液中存在哪些离子?试写出离子浓度由大到小的顺序:_________。
(3)NaHSO3溶液呈______性(填“酸”“碱”或“中”),中存在哪些平衡关系?试一一写出。
在NaHSO3溶液中存在哪些离子?试写出离子浓度由大到小的顺序:_________。
(4)根据H2SO3、H2CO3的电离平衡常数判断,相同浓度的Na2SO3和Na2CO3溶液,pH较大的是___。
2.判断下列溶液的酸碱性(“>7”或“<7”“=7”)NaHCO3NaHSO3 NaHSO4NaClCH3COONaCH3COONH4【课堂互动---突破考点研析热点】一、盐类水解的实质和离子方程式的书写例题1.在盐类发生水解的过程中,正确的说法是( )A.盐的电离平衡被破坏B.水的电离程度逐渐增大C.溶液的pH发生了较大改变D.水解后溶液一定呈酸性或碱性例题2.常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是() A.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:K+、Na+、ClO-、I-B.c(H+)=K W mol·L-1的溶液中:K+、Fe3+、Cl-、CO2-3C.常温下,c(H+)c(OH-)=1×10-12的溶液:K+、AlO-2、CO2-3、Na+D.pH=13的溶液中:AlO-2、Cl-、HCO-3、SO2-4例3.下列物质在常温时发生水解,对应的离子方程式正确的是()A.Na2CO3:CO2-3+2H2O H2CO3+2OH-B.NH4Cl:NH+4+H2O NH3↑+H2O+H+C.CuSO4:Cu2++2H2O Cu(OH)2+2H+D.NaF:F-+H2O===HF+OH-【引导与归纳1】----书写盐类水解的离子方程式需注意:一般盐类水解程度很小→水解产物很少→气体、沉淀不标“↑”、“↓”,易分解产物不写其分解产物的形式。
课时作业27 盐类的水解时间:45分钟 分值:100分一、选择题(共48分,每小题4分) 1.下列说法中错误的是( )A .在Na2S 溶液中滴入酚酞试液,呈红色B .硫酸铵溶液显酸性C .一切钾盐、钠盐、硝酸盐都不发生水解D .醋酸盐溶于水能发生水解 [答案]C[解析]Na2S 水解使溶液显碱性,滴入酚酞试液,呈红色;硫酸铵是强酸弱碱盐,其水解使溶液显酸性;钾的弱酸盐、钠的弱酸盐、硝酸的弱碱盐都能发生水解;醋酸盐中存在弱酸根离子(CH3COO -),溶于水时能发生水解。
2.下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是( ) A .实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞B .泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫C .厨房中常用碳酸钠溶液洗涤餐具上的油污D .可用碳酸钠与醋酸制取少量二氧化碳 [答案]D[解析]A 项是因为Na2CO3水解显碱性与玻璃中的SiO 2作用生成黏性的Na2SiO 3;B 是因为NaHCO 3与Al 2(SO 4)3相互促进水解:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑;C 是因为CO 2-3水解显碱性,能够除去油污;D 项与盐类的水解无关。
3.在一定条件下,Na2CO3溶液存在水解平衡:CO 2-3+H 2O HCO -3+OH -。
下列说法正确的是( )A .稀释溶液,水解平衡常数增大B .通入CO 2,平衡向正反应方向移动C .升高温度,c HCO -3c CO 2-3减小D .加入NaOH 固体,溶液pH 减小 [答案]B[解析]温度一定,水解平衡常数不变,选项A 错;通入二氧化碳,二氧化碳与OH -反应生成HCO -3,OH -浓度减小,平衡向正反应方向移动,选项B 正确;水解反应是吸热反应,升高温度,平衡向正反应方向移动,HCO -3浓度增大,而CO 2-3浓度减小,故c HCO -3c CO 2-3增大,选项C错误;加入NaOH,NaOH电离,溶液中OH-增大,pH增大,选项D错误。
北京高三化学一轮复习盐类水解的应用(答案不全)一、配制溶液要思索水解1、〔1〕在实验室配制FeCl3溶液时,往往需求向溶液中参与大批的,缘由是。
〔2〕在实验室配制FeCl2溶液时,往往需求向溶液中参与大批的,缘由是。
〔3〕实验室配制CuSO4溶液,经常出现混浊的缘由是可在配制时参与大批防止混浊。
〔4〕假定要将FeCl3固体配制成稀溶液,请简述其操作方法:。
〔5〕从氯化铁溶液妥当氯化铁晶体的操作是:〔6〕从FeCl3·6H2O失掉无水氯化铁固体的方法是:2、BiCl3水解生成BiOCl。
〔1〕写出BiCl3水解反响方程式:。
〔2〕有人把BiCl3叫次氯酸铋,你能否赞同此称号。
〔3〕如何配置BiCl3溶液。
〔4〕把过量固体BiCl3置于浓NaCl溶液中可得廓清溶液,请说出能够的缘由。
答案、〔1〕BiCl 3 + H2O BiOCl + 2HCl;〔2〕不赞同;〔3〕将BiCl3溶于盐酸中;〔4〕增大溶液中c〔Cl-〕能抑制BiCl3的水解二、某些盐的制备要思索到盐的水解。
3、某些盐的制备要思索到盐的水解。
如Al2S3不能在水溶液中制取的缘由是________ ___。
由MgCl2·6H2O制备MgCl2时要在____________ __中加热以防止其水解。
三、某些试剂的贮存要思索到盐的水解4、某些试剂的贮存要思索到盐的水解。
如Na2CO3等溶液,因其水溶液呈____性,试剂瓶就不能用________塞。
盛放NH4F溶液不能用玻璃瓶,是由于____________________。
四、化肥的运用要思索盐类的水解5、以下各组物质能一同混合施用的是 ( )A.铵态氮肥和草木灰(含K2CO3)混合施用B.化肥和农家肥(如绿肥)混合施用C.重钙施入碱性土壤中D.复合肥(如磷酸氢二铵)和生石灰一同施用五、实验室除杂可用盐的水解。
5、〔1〕除去酸性MgCl2溶液中的FeCl3可以参与_______、________、_______等再过滤。
第27讲盐类的水解
A组基础题组
1.物质的量浓度相同的下列溶液中,N浓度最大的是( )
A.NH4Cl溶液
B.CH3COONH4溶液
C.NH4HSO4溶液
D.NH4HCO3溶液
2.下列说法正确的是( )
A.100 ℃时水的离子积常数K W为5.5×10-13,说明水的电离是放热过程
B.配制Fe(NO3)2溶液时,为了防止Fe2+水解可向溶液中加入适量的稀硝酸
C.NaClO溶液中通入少量CO2,ClO-水解程度增大,溶液碱性增强
D.0.1 mol/L CH3COOH溶液加水稀释后,CH3COOH的电离程度和溶液中的c(OH-)都增大
3.常温下,有关 0.1 mol/L NH4Cl 溶液(pH<7)的下列说法不正确
...的是( )
A.根据以上信息,可推断出NH3·H2O为弱电解质
B.加水稀释过程中,c(H+)·c(OH-)的值增大
C.加入K2CO3固体可促进 N的水解
D.相同pH的NH4Cl溶液和CH3COOH溶液,由水电离出的c(H+)前者大
4.常温下,0.1 mol·L-1的NaHB溶液中c(H+)>c(OH-),下列关系或说法一定正确的是( )
A.c(Na+)+c(H+)=c(HB-)+2c(B2-)
B.c(H+)·c(OH-)=10-14
C.c(Na+)=c(B2-)+c(HB-)
D.溶液的pH=1
5.已知0.1 mol·L-1的二元酸H2A溶液的pH=4.0,则下列说法中正确的是( )
A.在Na2A、NaHA两溶液中,离子种类不相同
B.在溶质的物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中一定有:c(Na+)>c(A2-)>c(H+)>c(OH-)
6.经测定某溶液中只含N、Cl-、H+、OH-四种离子,已知这种溶液含有一种或两种溶质。
查资料表明等浓度、等体积的氨水和氯化铵的混合液显碱性,试完成下列问题:
(1)试推测这种溶液中可能的溶质组合:①,②,③,④,⑤(可填满,也可空缺)。
(2)有关这种溶液,下列说法正确的是。
A.若溶液中粒子间满足c(N)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl和NH3·H2O
B.若溶液中粒子间满足c(Cl-)>c(N)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中c(N)=c(Cl-),则该溶液一定显中性
D.若溶液中c(NH3·H2O)>c(Cl-),则溶液一定显碱性
(3)若溶液由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3·H2O)(填
“>”“<”或“=”),简述理由。
(4)水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的盐酸滴定V mL同浓度氨水时得到的滴定曲线,试分析如图所表示滴定过程中的a、b、c、d四点,其中水的电离程度最大的是,理由是。
B组提升题组
7.(2017北京房山一模,12)25 ℃时,四种浓度均为0.1 mol·L-1的溶液,其pH如下表所示:
下列关系的是( )
A.酸性:H2CO3>
B.水电离产生的c(H+):①=②
C.溶液③中:c(HC)+c(C)+c(H2CO3)=0.1 mol·L-1
D.溶液④中:c(Na+)>c()>c(OH-)>c(H+)
8.(2017北京顺义二模,10)表1是元素周期表的一部分:。