实验14-细胞凋亡的诱导和检测
- 格式:doc
- 大小:46.50 KB
- 文档页数:16
线粒体膜电位指示染料线粒体膜电位的下降是细胞凋亡初期的一个标志性事件. 它在凋亡进程中与caspase 活化同时发生并先于磷脂酰丝氨酸(PS)的外翻。
基于以上研究,Biotium 研发了各类的新型的荧光探针用于测量线粒体膜电位。
MitoView ™ 633MitoView ™ 633 是一种新型的用于测量线粒体膜电位的深红染料(激发光/发射光622/648 nm)。
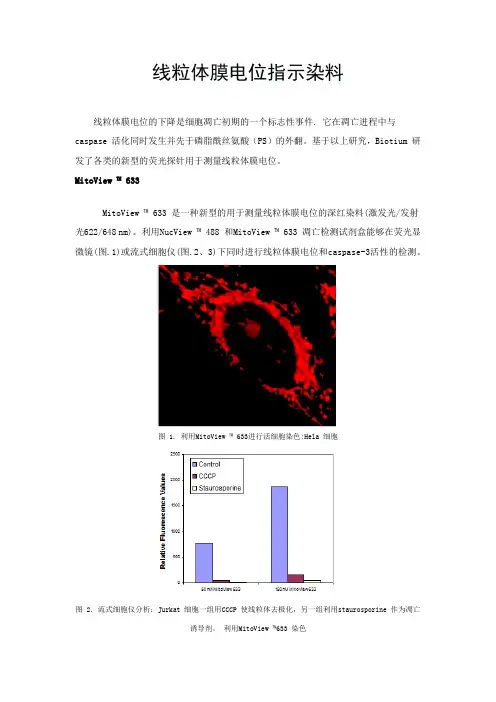
利用NucView ™ 488 和MitoView ™ 633 凋亡检测试剂盒能够在荧光显微镜(图.1)或流式细胞仪(图.2、3)下同时进行线粒体膜电位和caspase-3活性的检测。
图 1. 利用MitoView ™ 633进行活细胞染色:Hela 细胞图 2. 流式细胞仪分析:Jurkat 细胞一组用CCCP 使线粒体去极化,另一组利用staurosporine 作为凋亡诱导剂。
利用MitoView ™633 染色图3. 流式细胞仪分析:对照(A)与经staurosporine 处置(B)的Jurkat 细胞(JC-1 染色). FL1 (x- 轴) 为绿色荧光; FL2 (y-轴) 为红色荧光。
(A 图) 较高的红绿荧光比例说明线粒体膜电位未下降. (B 图)较低的红绿荧光比例说明:由于staurosporine诱导了凋亡的发生,细胞的线粒体膜电位大幅下降。
JC-1 线粒体膜电位检测试剂盒JC-1通常被用于检测细胞中线粒体膜电位的转变。
在健康细胞中,JC-1以聚合体(J-aggregates),的形式存在在线粒体基质中,能够产生红色的荧光(激发光/发射光585/590nm)。
相反,在正在凋亡或坏死的细胞中,JC-1不能聚集在基质中,以单体的形式存在,从而发出绿色的荧光( 激发光/ 发射光510/527nm),如此能够利用流式细胞仪和荧光显微镜、荧光计数仪通过测量荧光颜色的转变来检测线粒体膜电位的转变。
经常使用红绿荧光的相对照例来衡量线粒体去极化的比例。

实验14 细胞凋亡的诱导和检测20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。
细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞容物溢出,细胞坏死常引起炎症反应。
细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。
凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。
凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。
凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。
细胞凋亡时的生化变化特征是核酸切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。
细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。
1.细胞凋亡的检测方法凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。
细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征:(1)DAPI时常用的一种与DNA结合的荧光染料。
借助于DAPI染色,可以观察细胞核的形态变化。
(2)Giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。
(3)吖啶橙(AO)染色,荧光显微镜观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜侧,可见细胞膜呈泡状膨出及凋亡小体。


(完整)常见细胞凋亡检测的方法与注意事项编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)常见细胞凋亡检测的方法与注意事项)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)常见细胞凋亡检测的方法与注意事项的全部内容。
常见细胞凋亡检测的方法与注意事项大家常把细胞凋亡和细胞坏死混淆,其实两者是不同的细胞死亡形式,大家可以在死亡细胞的形态、生化和分子指标上将二者区分开来,细胞凋亡检测的方法不少,这里就总结下几种常用的检测方法.细胞凋亡检测更多详情,点击查看不可不知的细胞检测方法——MTT一、细胞凋亡的形态学检测根据凋亡细胞固有的形态特征,人们已经设计了许多不同的细胞凋亡形态学检测方法。
1 光学显微镜和倒置显微镜(1) 未染色细胞:凋亡细胞的体积变小、变形,细胞膜完整但出现发泡现象,细胞凋亡晚期可见凋亡小体。
贴壁细胞出现皱缩、变圆、脱落.(2)染色细胞:常用姬姆萨染色、瑞氏染色等.凋亡细胞的染色质浓缩、边缘化,核膜裂解、染色质分割成块状和凋亡小体等典型的凋亡形态。
2 荧光显微镜和共聚焦激光扫描显微镜一般以细胞核染色质的形态学改变为指标来评判细胞凋亡的进展情况。
常用的DNA特异性染料有:HO 33342 (Hoechst 33342),HO 33258 (Hoechst 33258), DAPI。
三种染料与DNA的结合是非嵌入式的,主要结合在DNA的A-T碱基区。
紫外光激发时发射明亮的蓝色荧光。
Hoechst是与DNA特异结合的活性染料,储存液用蒸馏水配成1mg/ml的浓度,使用时用PBS稀释成终浓度为2~5mg/ml。
DAPI为半通透性,用于常规固定细胞的染色。

细胞凋亡检测,细胞凋亡实验步骤,检测方法一、定性和定量研究只定性的研究方法:常规琼脂糖凝胶电泳、脉冲场倒转琼脂糖凝胶电泳、形态学观察(普通光学显微镜、透射电镜、荧光显微镜)进行定量或半定量的研究方法:各种流式细胞仪方法、原位末端标记法、ELISA 定量琼脂糖凝胶电泳。
二、区分凋亡和坏死可将二者区分开的方法:琼脂糖凝胶电泳,形态学观察(透射电镜是是区分凋亡和坏死最可靠的方法),Hoechst33342/PI双染色法流式细胞仪检测,3) Telemerase Detection (端粒酶检测)3、生化检测:1)典型的生化特征:DNA 片段化2)检测方法主要有:琼脂糖凝胶电泳、原位末端标记(TUNEL)等3)TUNEL(末端脱氧核苷酸转移酶介导的dUTP缺口末端标记)4)通过DNA末端转移酶将带标记的dNTP (多为dUTP)间接或直接接到DNA 片段的3’-OH端,再通过酶联显色或荧光检测定量分析结果。
可做细胞悬液、福尔马林固定或石蜡处理的组织、细胞培养物等多种样本的检测。
4、LM-PCR Ladder (连接介导的PCR检测)当凋亡细胞比例较小以及检测样品量很少(如活体组织切片)时,直接琼脂糖电泳可能观察不到核DNA的变化。
通过LM-PCR,连上特异性接头,专一性地扩增梯度片段,从而灵敏地检测凋亡时产生梯度片段。
此外,LM-PCR 检测是半定量的,因此相同凋亡程度的不同样品可进行比较。
如果细胞量很少,还可在分离提纯DNA后,用32P-ATP和脱氧核糖核苷酸末端转移酶(TdT)使DNA标记,然后进行电泳和放射自显影,观察凋亡细胞中DNA ladder的形成。
上述两种方法都针对细胞凋亡晚期核DNA断裂这一特征,但细胞受到其它损伤(如机械损伤,紫外线等)也会产生这一现象,因此它对细胞凋亡的检测会受到其它原因的干扰。
需结合其它的方法来检测细胞凋亡。
)境,这可能导致了凋亡早期细胞线粒体膜电位的降低,从而使细胞色素C(三羧酸循环中的重要组分)从线粒体内转移到细胞液中,启动凋亡效应器caspase的级联反应。

细胞生物学实验智慧树知到课后章节答案2023年下宁波大学宁波大学第一章测试1.在单克隆抗体制备过程中,需要使用下列哪项技术?()A:显微操作技术 B:细胞转染 C:细胞核移植 D:细胞融合答案:细胞融合2.团队协作精神体现在下列哪些课堂活动中。
()A:实验视频制作和校对 B:预习实验流程,并进行分工 C:实验结果评估 D:实验期间卫生打扫答案:实验视频制作和校对;预习实验流程,并进行分工;实验结果评估;实验期间卫生打扫3.预习需要完成的任务包括()。
A:观看网上视频 B:小组内讨论实验流程及分工 C:准备实验流程图 D:完成预习习题答案:观看网上视频;小组内讨论实验流程及分工;准备实验流程图;完成预习习题4.下面不属于本课程开设的实验是()。
A:动物细胞培养 B:叶绿体的分离与观察 C:细胞凋亡诱导 D:细胞转染 E:细胞骨架观察 F:细胞融合答案:细胞转染5.期末考核不包括下面哪一项内容。
()A:随堂作业 B:实验报告 C:理论考试 D:操作考试答案:随堂作业第二章测试1.细胞是()过程精巧的结合的综合体。
A:物质(结构) B:遗传 C:能量与信息 D:代谢答案:物质(结构);能量与信息2.细胞()的测量是研究正常的或病理组织细胞的基本方法之一。
A:长度 B:体积 C:周长 D:面积答案:长度;体积;面积3.细胞实际长度按照哪个公示计算。
()A:目镜测微尺的每小格的刻度=(镜台测微尺的格数×10 μm)÷目镜测微尺的格数 B:目镜测微尺的每小格的刻度=(镜台测微尺的格数×10 μm)×目镜测微尺的格数 C:目镜测微尺的每小格的刻度=(10 μm÷镜台测微尺的格数)÷目镜测微尺的格数答案:目镜测微尺的每小格的刻度=(镜台测微尺的格数×10 μm)÷目镜测微尺的格数4.如果是在10×目镜下测定目镜测微尺每小格的实际长度,那么在接下来目标细胞大小可换其他倍镜进行观察。

一、实验背景细胞凋亡,又称程序性细胞死亡,是一种由基因调控的细胞自主性死亡过程。
细胞凋亡在生物体的发育、免疫、代谢等生理过程中具有重要作用。
近年来,细胞凋亡与多种疾病的发生、发展及治疗密切相关,因此,研究细胞凋亡的机制具有重要意义。
本实验旨在通过检测细胞凋亡相关指标,探讨细胞凋亡在特定细胞类型中的作用。
二、实验材料与试剂1. 细胞:实验用细胞为正常细胞系A和肿瘤细胞系B。
2. 试剂:Annexin V-FITC/PI双染试剂盒、RNA提取试剂盒、PCR试剂盒、DNA提取试剂盒、Trizol试剂、DEPC水、无血清培养基、胎牛血清、胰蛋白酶等。
三、实验方法1. 细胞培养:将正常细胞系A和肿瘤细胞系B分别接种于培养瓶中,置于37℃、5%CO2的细胞培养箱中培养。
2. 细胞凋亡检测:将正常细胞系A和肿瘤细胞系B分别分为实验组和对照组。
实验组加入凋亡诱导剂,对照组加入等量无血清培养基。
培养一定时间后,按照Annexin V-FITC/PI双染试剂盒说明书进行细胞凋亡检测。
3. RNA提取:将实验组和对照组细胞收集于离心管中,按照RNA提取试剂盒说明书提取细胞总RNA。
4. PCR检测:将提取的RNA进行逆转录,得到cDNA。
以cDNA为模板,进行凋亡相关基因的PCR扩增。
5. DNA提取:将实验组和对照组细胞收集于离心管中,按照DNA提取试剂盒说明书提取细胞DNA。
6.琼脂糖凝胶电泳:将PCR产物进行琼脂糖凝胶电泳,观察条带。
四、实验结果1. 细胞凋亡检测:实验组细胞凋亡率显著高于对照组(P<0.05),说明凋亡诱导剂成功诱导细胞凋亡。
2. RNA提取:成功提取实验组和对照组细胞总RNA。
3. PCR检测:实验组凋亡相关基因表达水平显著高于对照组(P<0.05),说明凋亡诱导剂上调凋亡相关基因表达。
4. 琼脂糖凝胶电泳:实验组凋亡相关基因PCR产物条带较对照组明显,说明凋亡相关基因在实验组中表达上调。


细胞凋亡实验步骤及注意事项一、实验目的1、掌屋凋亡细胞的形态特征2、学会用荧光探针对细胞进行双标记来检测正常活细胞、凋亡细胞和坏死细胞的方法二、实验原理细胞死亡根据其性质、起源及生物学意义区分为凋亡和坏死两种不同类型。
凋亡普遍存在于生命界,在生物个体和生存中起着非常重要的作用。
它是细胞在一定生理条件下一系列顺序发生事件的组合,是细胞遵循一定规律自己结束生命的自主控制过程。
细胞凋亡具有可鉴别的形态学和生物化学特征。
在形态上可见凋亡细胞与周围细胞脱离接触,细胞变园,细胞膜向内皱缩、胞浆浓缩、内质网扩张、细胞核固缩破裂呈团块状或新月状分布、内质网和细胞膜进一步融合将细胞分成多个完整包裹的凋亡小体,凋亡小体最后被吞噬细胞吞噬消化。
在凋亡过程中细胞内容物并不释放到细胞外,不会影响其它细胞,因而不引起炎症反应。
在生物化学上,多数细胞凋亡的过程中,内源性核酸内切酶活化,活性增加。
核DNA随机地在核小体的连接部位被酶切断,降解为180-200bp或它的整倍数的各种片断。
如果对核DNA进行琼脂糖电泳,可显示以180-200bp为基数的DNA ladder(梯状带纹)的特征。
相比之下,坏死是细胞处于剧烈损伤条件下发生的细胞死亡。
细胞在坏死早期即丧失质膜完整性,各种细胞器膨胀,进而质膜崩解释放出其中的内容物,引起炎症反应,坏死过程中细胞核DNA虽也降解,但由于存在各种长度不等的DNA片断,不能形成梯状带纹,而呈弥散状。
一些温和的损伤刺激及一些抗肿瘤药物可诱导细胞凋亡,通常这些因素在诱导凋亡的同时,也可产生细胞坏死,这取决于损伤的剧烈程度和细胞本身对刺激的敏感程度。
三尖杉酯碱(HT)是我国自行研制的一种对急性粒细胞白血病,急性单核白血病等有良好疗效的抗肿瘤药物。
研究表明HT在0.02~5μg/ml范围内作用2小时,即可诱导HL-60细胞凋亡,并表现出典型的凋亡特征。
本实验用1μg/ml HT在体外诱导培养的HL-60细胞发生凋亡,同时也有少数细胞发生坏死。

实验报告细胞凋亡的诱导与调控机制研究实验报告:细胞凋亡的诱导与调控机制研究一、引言细胞凋亡是一种基本的生物学现象,对于多细胞生物的发育、稳态维持和疾病发生发展具有重要意义。
深入研究细胞凋亡的诱导与调控机制,有助于我们更好地理解生命过程,并为相关疾病的治疗提供新的思路和策略。
二、实验目的本实验旨在探究不同因素对细胞凋亡的诱导作用以及相关的调控机制。
三、实验材料与方法(一)实验材料1、细胞系:选用了人肝癌细胞系 HepG2 和人乳腺癌细胞系 MCF-7。
2、试剂:凋亡诱导剂(如阿霉素、顺铂等)、抗凋亡蛋白抑制剂(如 ZVADFMK)、细胞凋亡检测试剂盒(如 Annexin VFITC/PI 双染试剂盒)、蛋白提取试剂盒、抗体(如 cleaved caspase-3、Bcl-2、Bax 等)。
(二)实验方法1、细胞培养:将 HepG2 和 MCF-7 细胞分别培养在含有 10%胎牛血清、1%双抗的 DMEM 培养基中,置于 37℃、5% CO2 培养箱中培养。
2、药物处理:将处于对数生长期的细胞接种于培养板中,待细胞贴壁后,分别加入不同浓度的凋亡诱导剂和抗凋亡蛋白抑制剂,处理一定时间。
3、细胞凋亡检测:采用 Annexin VFITC/PI 双染法检测细胞凋亡率。
收集处理后的细胞,用 PBS 洗涤两次,然后加入 Annexin VFITC 和 PI 染液,避光孵育 15 分钟,最后通过流式细胞仪检测。
4、蛋白表达检测:采用 Western blotting 法检测相关蛋白的表达水平。
收集处理后的细胞,提取总蛋白,进行 SDSPAGE 电泳,转膜,封闭,然后分别加入相应的一抗和二抗,最后通过化学发光法显影。
四、实验结果(一)凋亡诱导剂对细胞凋亡的影响1、阿霉素处理后,HepG2 和 MCF-7 细胞的凋亡率均呈剂量依赖性增加。
在低浓度(05 μM)时,凋亡率较低;随着浓度的增加(10、20 μM),凋亡率显著升高。
细胞生物学-14(总分:100.00,做题时间:90分钟)一、判断题(总题数:6,分数:6.00)1.蝌蚪发育过程中尾巴的退化涉及细胞的编程性死亡和细胞坏死过程。
(分数:1.00)A.正确B.错误√解析:2.衰老过程中,细胞所有的蛋白质合成速度都下降。
(分数:1.00)A.正确B.错误√解析:3.细胞衰老是生命过程中受自由基随机损伤积累的结果,与细胞自身的基因无关。
(分数:1.00)A.正确B.错误√解析:4.在细胞衰老过程中,端粒和染色体内部的DNA重复序列长度都逐渐减少。
(分数:1.00)A.正确B.错误√解析:5.细胞外基质中透明质酸具备抗张力的作用。
(分数:1.00)A.正确B.错误√解析:6.胞外基质主要用于维持组织结构,对细胞功能的影响不大。
(分数:1.00)A.正确B.错误√解析:二、填空题(总题数:11,分数:11.00)7.有两种酶类的积累可以预示细胞凋亡的发生,这两种酶是 1和 2。
(分数:1.00)解析:Caspase;p53。
8.程序性细胞死亡可分4个阶段 1、 2和 3、 4。
(分数:1.00)解析:凋亡的起始;凋亡小体形成;凋亡小体逐渐为临近细胞吞噬和消化;细胞死亡。
9.哺乳动物的6cl2基因产物在功能上与线虫参与编程性细胞死亡中的 1基因产物相当。
(分数:1.00)解析:Ced-9。
10.细胞形态改变主要表现有下几个方面 1、 2、 3、 4。
(分数:1.00)解析:细胞外形改变;细胞骨架结构紊乱;核异常;质膜结构发生变化。
11.Wright和Hayflick所做的一系列实验证明细胞衰老的表达是由 1决定的。
(分数:1.00)解析:rDNA的变化。
12.整连蛋白质膜外可与 1结合,胞内可与 2结合,从而使细胞锚定在基膜上。
在转化的细胞中,细胞容易转移扩散与细胞中基质中的 3和 4变化有关。
(分数:1.00)解析:细胞外基质;细胞骨架;纤连蛋白;钙黏蛋白。
13.弹性蛋白的肽链之间通过 1相互交联形成网络。
细胞凋亡检测(Annexin-V-FITC 单染法)(Assay of CellApoptosis)2010-05-25 20:06:41 来源:易生物实验浏览次数:197 网友评论0 条细胞凋亡或称程序性细胞死亡(Programmed Cell Death ,PCD)是细胞的生命现象之一,它在机体的胚胎发育、组织修复及自身反应性T淋巴细胞的清除等方面起着十分重要的作用。
细胞凋亡调节的失控可导致临床各种疾病的发生。
如老年性痴呆与神经细胞凋亡过度有关,自身免疫性疾病和肿瘤与细胞凋亡的抑制有关。
细胞凋亡有别于细胞坏死,它有一系列的细胞形态学和生物化学的改变,包括出现染色质浓缩、DNA降解、凋亡小体形成等。
关键词:细胞检测单染法细胞凋亡检测Annexin-V-FITCAssayCellApoptosis一、实验原理细胞凋亡或称程序性细胞死亡(Programmed Cell Death ,PCD)是细胞的生命现象之一,它在机体的胚胎发育、组织修复及自身反应性T淋巴细胞的清除等方面起着十分重要的作用。
细胞凋亡调节的失控可导致临床各种疾病的发生。
如老年性痴呆与神经细胞凋亡过度有关,自身免疫性疾病和肿瘤与细胞凋亡的抑制有关。
细胞凋亡有别于细胞坏死,它有一系列的细胞形态学和生物化学的改变,包括出现染色质浓缩、DNA降解、凋亡小体形成等。
在正常的活细胞,磷脂酰丝氨酸(phosphotidylserine,PS)位于细胞膜的内侧,但在凋亡的细胞,PS 从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中。
Annexin-Ⅴ(膜联蛋白-V)是一种分子量为35-36KD的Ca2+ 依赖性磷脂结合蛋白,能与PS高亲和力结合。
因此将Annexin-Ⅴ进行荧光素(如FITC、PE)或生物素(Biotin)标记,以标记了的Annexin-Ⅴ作为探针,利用流式细胞仪或荧光显微镜可检测细胞凋亡的发生。
二、实验仪器和材料Annexin V-FITC(膜联蛋白-V-FITC)500μl/250μl 20μg/ml标记缓冲液(Binding Buffe)r 40/20 mlPBS(1×)60/30 ml20μl , 200μl , and 1000μl 移液器和吸头微量离心管可调速离心机载玻片(用于荧光显微镜观察)盖玻片(用于荧光显微镜观察)去离子水冰块流式细胞仪或荧光显微镜三、实验方法1.凋亡细胞的制备:小鼠腹腔注射地塞米松25mg/kg体重,10h后解剖取胸腺,分离胸腺细胞。
实验报告细胞凋亡的诱导与调控机制研究实验报告:细胞凋亡的诱导与调控机制研究引言在生物学研究领域,细胞凋亡作为一种重要的细胞死亡方式,一直受到广泛关注。
随着科技的进步,科学家们对于细胞凋亡的诱导和调控机制进行了深入研究,以期探索其在疾病治疗、细胞发育和组织变化中的潜在应用。
本实验旨在研究细胞凋亡的诱导与调控机制,以加深对其原理的理解。
材料与方法1. 细胞培养:使用XXX细胞系培养基,将细胞置于37℃、5% CO2的培养箱中。
2. 实验组设定:将细胞平均分为两组,实验组A和对照组B。
实验组A接受特定诱导剂处理,对照组B不进行任何处理。
3. 细胞凋亡检测:利用TUNEL法检测细胞凋亡程度,使用荧光显微镜观察实验组和对照组下凋亡细胞数量的差异。
4. 分子机制研究:采用Western blot和实时荧光定量PCR技术,检测关键凋亡相关蛋白的表达和基因表达水平。
结果与讨论经过实验,我们观察到以下结果:1. 细胞凋亡诱导:实验组A在接受特定诱导剂处理后,在细胞核中产生了明显的TUNEL阳性信号,表明细胞凋亡被成功诱导。
而对照组B则未出现明显的凋亡相关特征。
2. 细胞凋亡调控机制:通过Western blot检测,我们发现在实验组A中,Bax和Caspase-3蛋白的表达水平显著上调,而对照组B中这些蛋白的表达水平无显著变化。
这表明通过诱导剂的作用,Bax和Caspase-3被激活,并参与细胞凋亡的调控。
另外,实时荧光定量PCR结果显示,实验组A中凋亡相关基因的表达水平明显增加,而对照组B未见明显变化。
这进一步印证了凋亡的调控机制中基因表达的变化重要性。
综合结果分析,我们可以得出以下结论:1. 细胞凋亡可以被特定诱导剂成功激活,从而实现对细胞凋亡的处理。
2. 在细胞凋亡的调控机制中,Bax和Caspase-3等蛋白的上调发挥重要作用。
3. 细胞凋亡的调控还涉及到基因表达的改变,特定诱导剂可以引起相关基因的显著上调。
细胞增殖、凋亡-检测方法汇总1.直接计数法面单粗暴、傻瓜式的检查方法!利用计数板或计数仪得出细该数目•然后对数目逬行比较。
方法需要对不同时间原的细胞分别固定•而后在光疑下计数,可绘制出细胞生长曲线。
而具不足之处在于无法区分壇蓿细胞与非增殖抵胞,下适合样品奴星參和评估特定亚群的情况。
2「H・TdR渗入法OH腺龜碇核百(TdR )是DNA持有的滅基「也是DNA合成的必需物氐用同位素中标记TdR即3H-TdR作为DNA合成的前体渗入DNA合成代谢过程,通过液体闪烁计数器可迴走细胞的放射性强虐,间接放映出细胞增殖情况。
该方法优点在于敏感性高”客观性强,盍每性好.但是爲要一走设备集件,也存在放时性核素污染问题。
3、Brdu/EdU检测法Brdu&EdU均是胸腺嚅睫的衍生物r均可代替胸腺嚅噪在DNA合成期掺入细胞中。
不同的是J Brdu检测法可利用B「du专性抗体和具他細胞标记物对细'进行双重染色,可判断増殖细胞的种类及増殖速度,不仅适用于体外实验也能用于活体实验。
这个方法最大的缺点需要变性DNA才能与抗体结合,破坏了DNA双链结构r导致染色弥散、准确性降低等问题。
EdU检测法则基于EdU与Apollo荧光染料的特异性反应检测DNA复制活性r适用于细胞増殖、细胞标记示踪筈方IEI的研究,尤其适合进行siRNA、miRNA、小分子化合物及其他药物的筛选实验。
EdU检测染料只有BrdU抗体大小的1/500,®田胞内很容易就扩散,无需DNA变性。
rdU与EdU检测优缺点综合比较BrdU EdU 检测分子大很小检测方式免疫反应化学反应影响其他标记是否DNA变性需要不需要实验时间过夜 2.5小时检测灵敏度一般灵敏4、WITT检测法&CCK8检测法MTT检测法反映细胞的能臺代谢「是检测细胞増殖活力的一种简便准确方法°其原理是在活纟田胞生长和增殖过程中,线粒体内的脱氢酶可将黄色的MTT分解为蓝紫色的水不溶性的甲瓒(Formazan ),并沉积在细胞中(死细胞无此功能。
TUNEL法检测细胞凋亡实验实验原理:细胞凋亡是生物体内细胞在特定的内源和外源信号诱导下,其死亡途径被激活,并在有关基因的调控下发生的程序性死亡过程。
细胞凋亡涉及caspase活化、线粒体跨膜电位下降,位于细胞膜脂内层的磷脂酰丝氨酸转位到蛋白表面,DNA呈规律性断裂等。
基于这些特征,多种检测凋亡的方法也迅速发展起来,常用的方法包括形态学检查,分子生物学方法,免疫电泳和细胞学检查。
TUNEL,为原位末端转移酶标记技术。
其原理是:先增加细胞膜通透性,让rTDT和荧光素生物素标记的dUTP进入细胞内,在脱氧核糖核苷酸末端转移酶的辅助下将脱氧核糖核苷酸和荧光素等形成的衍生物标记到DNA的3’末端,从而可进行凋亡细胞的检测。
最终通过计数每张切片上不同视野中TUNEL阳性细胞的比例来判断细胞凋亡发生情况。
实验前准备在开始实验前,确保所用到的试剂都准备到位。
如:0.2% TritonX 100,TUNEL检测试剂盒(包含10× TdT酶浓缩液、荧光素标记的1× dUTP、转化剂POD),DAB试剂盒,3%过氧化氢甲醇,磷酸缓冲液PBS等。
本实验所使用到的仪器和耗材有:芬兰百得公司提供的移液器,赛默飞公司的QSP盒装吸头,湿盒,恒温箱等。
本次TUNEL实验按照以下常规步骤来展开,首先样品处理,封闭内源性过氧化物酶干扰后进行细胞通透化。
滴加TUNEL反应液反应后POD转换,DAB显色后在显微镜下观察并进行结果分析。
样品处理在标有实验组,阳性对照组和阴性对照组的切片上滴加4%不含甲醇的甲醛室温固定10min。
弃去甲醛,用PBS洗两次,每次5min。
封闭用滤纸擦去周围多余的PBS,滴加3%过氧化氢甲醇,室温孵育10min,消除内源性过氧化物酶干扰后,弃去将载玻片用PBS洗2次,每次5min。
细胞通透化去尽PBS后,滴加100μl由PBS配制的0.2% TritonX 100。
于湿盒中室温孵育5min。
实验14-细胞凋亡的诱导和检测实验14 细胞凋亡的诱导和检测20世纪60年代人们注意到细胞存在着两种不同形式的死亡方式:凋亡(apoptosis)和坏死(necrosis)。
细胞坏死指病理情况下细胞的意外死亡,坏死过程细胞膜通透性增高,细胞肿胀,核碎裂,继而溶酶体、细胞膜破坏,细胞内容物溢出,细胞坏死常引起炎症反应。
细胞凋亡apoptosis一词来源于古希腊语,意思是花瓣或树叶凋落,意味着生命走到了尽头,细胞到了一定时期会像树叶那样自然死亡。
凋亡是细胞在一定生理或病理条件下遵守自身程序的主动死亡过程。
凋亡时细胞皱缩,表面微绒毛消失,染色质凝集并呈新月形或块状靠近核膜边缘,继而核裂解,由细胞膜包裹着核碎片或其他细胞器形成小球状凋亡小体凸出于细胞表面,最后凋亡小体脱落被吞噬细胞或邻周细胞吞噬。
凋亡过程中溶酶体及细胞膜保持完整,不引起炎症反应。
细胞凋亡时的生化变化特征是核酸内切酶被激活,染色体DNA被降解,断裂为50~300 kb长的DNA片段,再进一步断裂成180~200bp整倍数的寡核苷酸片断,在琼脂糖凝胶电泳上呈现“梯状”电泳图谱(DNA Ladder)。
细胞凋亡在个体正常发育、紫稳态维持、免疫耐受形成、肿瘤监控和抵御各种外界因素干扰等方面都起着关键性的作用。
1.细胞凋亡的检测方法凋亡细胞具有一些列不同于坏死细胞的形态特征和生化特征,据此可以鉴别细胞的死亡形式。
细胞凋亡的机制十分复杂,一般采用多种方法综合加以判断,同时不同类型细胞的凋亡分析方法有所不同,方法选择依赖于具体的研究体系和研究目的(表?)。
表凋亡的检测方法(引自DL 斯佩克特等,2001)方法细胞类型特点说明形态学/细胞旋转不限简单、快速、低廉、贮存无限制略带主观性,但可靠Hoechst染色不限极快,不能贮存略带主观性,但可靠吖啶橙/溴化乙锭不限极快,不能贮存凋亡初期可用,略带主观性,但可靠FACS/FSC X SSC 非贴壁细胞简单,须及时进行客观,仅能提示凋亡FACS/PI吸收非贴壁细胞简单,需及时进行客观,不能辨别凋亡于坏死;早期凋亡的细胞呈阴性膜联蛋白V(锚定蛋白) 最好非贴壁细胞快速简单;细胞可以被固定并非所有细胞在膜整合损失前受PS影响;测定已知的显著性的反应DNA片段(琼脂糖电泳)不限很快、低廉定性,不能确定凋亡;某些细胞不适用DNA片段(PI染色) 不限很快,低廉定量;用于估计凋亡程度DNA片段(JAM 分析) 循环细胞低廉,可分析多种类混合定量,不能确定凋亡含量;不能用于所有细胞TUNEL 不限昂贵,耗时定量,常被认为可靠(尽管应该结合形态学评价)线粒体膜电位损不限低廉,不能确定凋失快速亡,并非次生坏死前的所有细胞都适用caspase活化(蛋白酶活性) 不限中等花费,很快目前不能确定凋亡,但适用于监测器;不能鉴别特定激活的caspasescaspase活化(caspase免疫印迹) 不限中等花费可以鉴别特定激活的caspases;依赖于抗体的有效性caspase活化(基质免疫印迹) 不限中等花费通过特异切割反应测定caspase活化;如这些反应功能可确定形态学观察方法:利用各种染色法可观察到凋亡细胞的各种形态学特征:(1)DAPI时常用的一种与DNA结合的荧光染料。
借助于DAPI染色,可以观察细胞核的形态变化。
(2)Giemsa染色法可以观察到染色质固缩、趋边、凋亡小体形成等形态。
(3)吖啶橙(AO)染色,荧光显微镜观察,活细胞核呈黄绿色荧光,胞质呈红色荧光。
凋亡细胞核染色质呈黄绿色浓聚在核膜内侧,可见细胞膜呈泡状膨出及凋亡小体。
(4)吖啶橙(A())/溴化乙啶(EB)复染可以更可靠地确定凋亡细胞的变化,AO只进入活细胞,正常细胞及处于凋亡早期的细胞核呈现绿色;EB只进入死细胞,将死细胞及凋亡晚期的细胞的核染成橙红色。
(5)台盼蓝染色对反映细胞膜的完整性,区别坏死细胞有一定的帮助,如果细胞膜不完整、破裂,台盼蓝染料进入细胞,细胞变蓝,即为坏死。
如果细胞膜完整,细胞不为台盼蓝染色,则为正常细胞或凋亡细胞。
使用透射电镜观察,可见凋亡细胞表面微绒毛消失,核染色质固缩、边集,常呈新月形,核膜皱褶,胞质紧实,细胞器集中,胞膜起泡或出“芽”及凋亡小体和凋亡小体被临近巨噬细胞吞噬现象。
(6)苏木精-伊红(HE)染色是经典的显示细胞核、细胞质的染色方法,染色结果清晰。
发生凋亡的细胞经HE染色后,其细胞大小的变化及特征性细胞核的变化:染色质凝集、呈新月形或块状靠近核膜边缘,晚期核裂解、细胞膜包裹着核碎片“出芽”凸出于细胞表面形成凋亡小体等均可明显显示出来。
DNA凝胶电泳:细胞发生凋亡或坏死,其细胞DNA均发生断裂,细胞内小分子质量DNA片段增加,高分子DNA减少,胞质内出现DNA 片段。
但凋亡细胞DNA断裂点均有规律的发生在核小体之间,出现180~200 bp DNA片段,而坏死细胞的DNA断裂点为无特征的杂乱片段,利用此特征可以确定群体细胞的死亡,并可与坏死细胞区别。
酶联免疫吸附法(ELISA)核小体测定:细胞凋亡时,Ca2+、Mg2+依赖的内源性核酸内切酶将双链DNA从各核小体间连接区裂断,产生单或寡核小体,各核小体的DNA与核心组蛋白H2A,H2B,H3,H4形成紧密的复合物而对内源性核酸酶有抵抗使之不被内源性核酸酶裂解。
可通过ELISA进行检测,主要使用单克隆抗DNA 抗体和抗组蛋白抗体直接检测DNA和组蛋白。
该法敏感性高,不需要特殊仪器,可用于人、大鼠、小鼠的凋亡检测。
TUNEL法:细胞凋亡中,染色体DNA双链断裂或单链断裂而产生大量的黏性3’-OH末端,可在脱氧核糖核苷酸末端转移酶(TdT)的作用下,将脱氧核糖核苷酸和荧光素、过氧化物酶、碱性磷酸酶或生物素形成的衍生物标记到DNA的3'-OH末端,从而可进行凋亡细胞的检测,这类方法称为脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(terminal—deoxynucleotidyl transferase mediated nick end labeling,TUNEL)。
由于正常的或正在增殖的细胞几乎没有DNA的断裂,因而没有3’-OH形成,很少能够被染色。
TUNEL对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确地反映细胞凋亡典型的生物化学和形态特征,可用于石蜡包埋组织切片、冰冻组织切片、培养的细胞和从组织中分离的细胞的细胞形态测定,并可检测出极少量的凋亡细胞,因而在细胞凋亡的研究中被广泛采用。
流式细胞仪定量分析:流式细胞术(flow cytometry)是20世纪70年代发展起来的一种利用流式细胞仪对细胞特征及细胞或细胞器的组成进行快速定量分析与分选的一门技术。
流式细胞仪由液流系统(鞘液室、废液箱、鞘液管、样本管、压力系统、流动室或喷嘴)、光学系统(激光光源、透镜、滤片)、电子系统(光电倍增管、信号放大器)、计算机系统以及分选系统等组成。
当经过荧光染色样品悬液注入样品室、不含样品的鞘液注入鞘室后,两种液体被高压推动从喷嘴一起喷出,由于动力学原理,单个样品被鞘液包裹,排列成束并高速运动。
随后样品束与激光器产生的激光束呈90°垂直相遇,激光使样品产生荧光和各个方向的散射光,信号检测器的阻断滤片和双色反射镜可以除去激发光,仅让需要的荧光通过,光电倍增管对荧光进行检测并将荧光转化为电信号。
各种散射光中,前向角散射光(forward light scatter,FSC)(与激光夹角0.5°~2°)和垂直角散射光(side scatter,SSC)(与激光束夹角90°)与样品含有的颗粒数量有关,散射光检测器可以对这两种光进行检测。
每个样品颗粒所产生的荧光和散射光通过检测器时均能被测定,如果对荧光或散射光设定一定分选值,控制系统可以将每一个颗粒所产生的荧光和散射光强度与该值进行比较,并决定对该液滴充以正电荷、负电荷或者不充电。
在高压偏转电场中,带有不同电荷或不带电荷的样品颗粒具有不同的运动轨迹,从而被收集到不同的容器中。
流式细胞仪可在短时间内对成千上万的样品进行分析,分离准确率达到99%以上。
细胞发生凋亡时,其细胞膜的通透性也增加,但是其程度介于正常细胞与坏死细胞之间。
利用这一特点,用荧光素染被检测细胞悬液,利用流式细胞仪测量细胞悬液中细胞荧光强度来区分正常细胞、坏死细胞核凋亡细胞。
如:检测形态学及细胞膜完整性的Hoechs-PI双染色法就是利用Hoechs-PI染色法,正常细胞对染料有抗拒性,荧光染色很浅,凋亡细胞主要摄取Hoechs染料,呈现强蓝色荧光,而坏死细胞主要摄取碘化丙啶(PI)而呈强的红色荧光。
2.细胞凋亡的诱导因素诱导凋亡的因素包括物理因素、化学因素以及生物因素:物理性因子:包括射线(紫外线,γ射线等),较温和的温度刺激(如热激,冷激)等。
化学及生物因子:包括活性氧基团和分子,DNA 和蛋白质合成的抑制剂,激素,细胞生长因子,肿瘤坏死因子a(TNFa),抗Fas/Apo-1/CD95抗体等。
而过氧化氢(H2O2)、醋酸、高渗透压和高盐浓度等均可以诱导酿酒酵母的凋亡,葡萄糖是酿酒酵母生长所必须的重要营养物质之一,但在其他营养元素缺乏的条件下,只用葡萄糖培养也可迅速的诱导酿酒酵母的细胞凋亡。
【实验目的】通过不同诱导物或同一诱导物不同诱导时间对细胞凋亡诱导的影响研究,使学生进一步了解细胞凋亡的机制及生物学意义;了解细胞凋亡的诱导和检测方法;初步掌握实验方案设计、数据整理及结果分析和论文撰写等基本技能。
【实验器材、材料和药品】1.器材超净工作台、离心机、天平、荧光显微镜、振荡培养箱、CO2培养箱、电泳仪、电泳槽、流式细胞仪、注射器、试管等。
2.试剂及其配制MS培养基2,4-D1%DAPI血清DMEM培养基YPD培养基、吖啶橙/溴化乙啶(AO/EB)的PBS溶液Giemsa染液磷酸盐缓冲液(PBS)琼脂糖TAE【实验方法和步骤】1.查阅资料,选题由教师提供课题,学生选定研究课题;或由学生查阅资料、根据细胞生物学理论课所学知识,就以上实验目的以小组为单位,自行命题,报教师审批。
选择诱导凋亡的因素和受体材料。
2.查阅资料,灵活运用所学知识和技能设计实验根据选择的课题,利用图书馆、网络等资源广泛查阅资料,经充分讨论后设计出实验方案,设计实验方案包括确定诱导条件(如诱导剂的浓度、诱导时间等)、确定合适的凋亡检测方法和步骤。
将实验方案交教师审阅、修改、完善,经教师审批后方可实施。
3.实施并完成自行设计的实验根据实验设计技术路线,进行实验前的准备工作,实验用复杂溶液配置可在老师指导下配置,实验过程中要严格遵守操作规程,独立完成。
并做好实验记录,向教师报告实验情况和结果,经教师批准后方可结束实验。