配位化合物
- 格式:doc
- 大小:314.50 KB
- 文档页数:8




什么是配位化合物?络合反应?配位化合物和络合反应是无机化学中的重要概念。
配位化合物是由一个中心金属离子与络合体中化合物中的配体配位形成的化合物。
而络合反应就是配体与金属离子之间的配位过程。
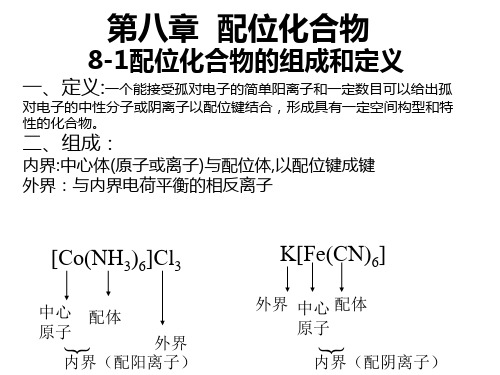
一、配位化合物的定义及特点配位化合物是由一个中心金属离子与一个或多个配体通过均一或均四电子共轭配位键构成的化合物。
配体可以是有机物,也可以是无机物。
配位化合物可以具有很多不同的性质和应用。
1. 配位键配位键是指金属离子与配体之间的化学键。
根据不同的金属离子和配体,配位键可以分为配位共价键、氢键、离子键等。
配位共价键是对称的、电性的、共价性的。
氢键是轻元素或者氢与非金属之间形成的一种特殊化学键。
离子键是由电负性不同的原子或离子之间形成的化学键。
2. 配位度配位度是指配位体中与金属离子形成配位键的配位原子或配位基团的个数。
例如,水为配体的配位度为2,而乙二胺为配体的配位度为2。
3. 配位数配位数是指配位化合物中一个金属离子周围配位体数目的总数。
例如,六配位化合物的配位数为6。
4. 配位子配位子是指形成配位化合物的配体或配体的综合物。
配位子可以是一个原子或一个离子,也可以是一个配体络合物或一个配体的反应物。
二、络合反应的机理及应用络合反应是指金属离子与配体之间形成配位化合物的化学过程。
络合反应可以通过配位键的形成和断裂来实现。
1. 配位键的形成配体通过自旋被阻止以及相互接近的方式与金属离子形成配位键。
配位键的形成过程涉及电子供体与电子受体之间的配体静态效应和动态效应。
2. 配位键的断裂配位键的断裂是指配位体离开金属离子所需的能量。
配位键的断裂通常涉及与其他配体相互作用,或者通过外界条件改变。
3. 应用领域络合反应在无机化学、有机化学、生物化学以及材料科学等领域具有广泛的应用。
在无机化学中,络合反应可用于合成具有特定性质的金属配位聚合物和金属配位材料。
在有机化学中,络合反应可用于合成金属有机化合物,如金属有机催化剂。
在生物化学中,络合反应在生物体内维持金属离子的稳定性和活性。

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
第8章配位化合物习题参考答案1.解:2.解:3.解:(1)KPtCl3(NH3)](2)[Co(NH3)6](ClO4)2(3)[Ni(NH3)6]Cl2(4)NH4[Cr(NCS)4(NH3)2](5)[Cr(OH)9C2O4](H2O)(en)](6)Na2[Fe(CN)5(CO)]4.解:三种配合物的化学式分别为5.解:[Cu(NH3)4]2+[CoF 6]3-[Ru(CN)6]4-[Co(NCS)4]2―6.解:已知:[MnBr 4]2―μ=5.9 B.M ,[Mn(CN)6]3―μ=2.8 B.M 。
由:n n+2μ=():2346 [MnBr ] n=5[Mn(CN)] n=2--⎫⎪⎬⎪⎭中中,与2+3+Mn n=5Mn n=4⎧⎪⎨⎪⎩()()相比较,可推测: [MnBr 4]2―价层电子分布为7. 解: Ag + + 2NH 3·H 2O[Ag(NH 3)2]+ + 2H 2O平衡浓度/(mol·L -1) x 0.30 + 2x 0.10 -xf K ={}{}{}22323 ) O H · (NH ) (Ag)])(NH [Ag ( c c c ++= 1.12⨯107x = 9.9⨯10- 8即 c (Ag +) = 9.9⨯10- 8mol·L -1c ([Ag(NH 3)2]+) = (0.10 - x ) mol·L -1 ≈0.10 mol·L -1 c (NH 3·H 2O) = (0.30 + 2x ) mol·L -1 ≈0.30 mol·L -1 8. 解:Cu 2+ + 4NH 3·H 2O[Cu(NH 3)4]2+ + 4H 2O平衡浓度/(mol·L -1) x 3.0 - 4⨯0.050 + 4x 0.050 -xf K ={}{}{}432243 )(NH )(Cu)])(NH ([Cu c c c ++=4)48.2(050.0x x x+-= 2.09⨯1013 x =3.9⨯10-17若在此溶液中加入0.010 mol NaOH(s),即:c (OH - ) = 0.50 mol·L -1J = {}22)OH ()Cu (-c c ⨯+ = 3.9⨯10-17 ⨯ (0.50)2 = 9.8⨯10-18 > sp K (Cu (OH)2)故有Cu (OH)2沉淀生成。
9.解:AgI(s) + 2NH 3·H 2O[Ag(NH 3)2]+ + I - + 2H 2O平衡浓度/(mol·L -1) 6.0 - 2x x xK={}{}{}{}{})A ()A ( O)H ·(NH)I ()])(NH[Ag ( 223-23+++⨯g c g c c c c= )])(NH [Ag (23f + K ·sp K (AgI) = 9.54⨯10-10x = 1.9⨯10-4同上方法: AgI(s) + 2CN -[Ag(CN)2] - + I -平衡浓度/(mol · L -1) 1.0 - 2yyyK =)](CN) [Ag (2f - K ·sp K (AgI) = (1.26⨯1021) ⨯ (8.52⨯10-17) = 1.07⨯105 y = 0.4910.解:设1.0 L 1.0 mol·L -1氨水可溶解x mol AgBr , AgBr(s) + 2NH 3·H 2O[Ag(NH 3)2]+ + Br - + 2H 2O平衡浓度/(mol·L -1) 6.0 - 2x x xK =)])(NH [Ag (23f + K ·sp K (AgBr)=5.99⨯10-6 22)20.1(x x -= 5.99⨯10-6 x = 2.4⨯10-3 故1.0 L 1.0 mol·L -1 NH 3·H 2O 可溶解1.9⨯10-4 mol AgBr 。
则100mL 1.0 mol·L -1 NH 3·H 2O 只能溶解AgBr 的克数为0.045 g < 0.10 g 即0.10 g AgBr 不能完全溶解于100mL 1.00 mol·L -1的氨水中。
11.解:混合冲稀后:c (NH 3·H 2O) = 2.99 mol · L -1,c (Ag +) = 0.0500 mol · L -1 (1) Ag + + 2NH 3·H 2O[Ag(NH 3)2]+ + 2H 2O平衡浓度/(mol·L -1) x 2.99 - 0.100 +2x 0.0500 -xf K=)()(1211L · mol L · 2.89mol L · 0.0500mol ---x = 1.12⨯107x = 5.35⨯10-10即c (Ag +) = 5.35⨯10-10 mol·L -1, c ([Ag(NH 3)2]+) = 0.0500 mol·L -1c (NH 3·H 2O) = 2.89 mol·L -1(2)c (Cl -) = 0.0100 mol·L -1 , J = 5.35⨯10-12<sp K (AgCl)=1.77⨯10-10故无AgCl 沉淀形成。
欲阻止AgCl 沉淀形成,c (Ag +) ≤c cc K /)Cl (AgCl)(sp - =1.77⨯10-8 mol·L -1 c (NH 3·H 2O) ≥c 781012.11077.10500.0⨯⨯⨯- = 0.502 mol·L -1(3)c (Br -) = 0.120 g ÷ 119.00 g·mol -1 ÷ 0.1 L = 0.0101 mol·L -1J = 5.40⨯10-12 >sp K (AgBr) = 5.35⨯10-13故有AgBr 沉淀形成。
欲阻止AgBr 沉淀形成,c (Ag +) ≤c cc K ⨯-/)Br (AgBr)(sp = 5.30⨯10-11 mol·L -1 c (NH 3·H 2O) ≥c 7111012.11030.50500.0⨯⨯⨯- = 9.18 mol·L -1 由(2)、(3)计算结果看出,AgCl 能溶于稀NH 3·H 2O ,而AgBr 须用浓NH 3·H 2O 才能溶解。
12.解:(1)[HgCl 4]2- + 4 I -[HgI 4]2- + 4Cl -K =)]HgCl ([)]HgI ([24f 24f -- K K = 5.78 ⨯10 14K 很大,故反应向右进行。
(2)[Cu(CN)2]- + 2NH 3·H 2O [Cu(NH 3)2]+ + 2CN - + 2H 2OK =)][Cu(CN)()])[Cu(NH (2f 23f -+ K K = 7.24⨯10-14(3)[Fe(NCS)2]+ + 6F -[FeF 6]3- + 2SCN -K = )](NCS) [Fe ()][FeF (2f 36f +-K K = 3141029.21004.2⨯⨯ = 8.91⨯10 10 K 很大,故该反应向右进行。
*13.解:(1)[Ni(CN)4]2- + 2e -Ni + 4CN - 对于电极反应:Ni 2+ + 2e -NiE (Ni 2+/Ni) = E (Ni 2+/Ni) + (0.0592 V / 2) lg {}c c /)Ni (2+Ni 2+ + 4CN -[Ni(CN)4]2-f K={}4224)CN ( )Ni () ]) (CN ([Ni -+-c c c = 1.99⨯1031)Ni (2+c = c / f K ([Ni(CN)4]2-) = 5.03⨯1032 mol·L -1因此 E ([Ni(CN)4]2-/Ni)=E (Ni 2+/Ni) = E (Ni 2+/Ni) + 2V0.0592lg )]HgI ([124f - K = -0.0295 V*14.解:对于电极反应:Cu 2+ + 2e -CuE (Cu 2+/Cu) = E (Cu 2+/Cu) +)}(Cu lg{2V0592.02+c 其中Cu 2+ 浓度可由下列平衡式求得: Cu 2+ + 4NH 3·H 2O[Cu(NH 3)4]2+ + 4H 2O据题意:配离子和配体的浓度均为1.0 mol·L -1,则)(Cu 2+c = c / f K ([Cu(NH 3)4]2+) = 4.8⨯10-14 mol·L -1E ([Cu(NH 3)4]2+/Cu) = E (Cu 2+/Cu)= E (Cu 2+/Cu) +)}(Cu lg{2V0592.02+c = -0.054 V 在c (NH 3·H 2O) = 1.0 mol·L -1 的溶液中: NH 3·H 2O+4NH + OH -平衡浓度/(mol·L -1) 1.0 -x x xK (NH 3 ·H 2O) = xx -0.12= 1.8⨯10-5 x = 4.2⨯10-3 即c (OH - ) = 4.2⨯10-3 mol·L -1对于电极反应: O 2 + 2H 2O + 4 e - 4OH -E (O 2/OH -) =E (O 2/OH -) +42)}(OH {)/(O lg 4V0592.0-⨯c p p = 0.542 VE (O 2/OH -) >> E ([Cu(NH 3)4]2+/Cu)。
*15. 解:由电极反应:Ag + + e -Ag 可以写出:E (Ag +/Ag) = E (Ag +/Ag) + 0.0592 V )}(Ag lg{+c 可导出:E ([Ag(NH 3)2]+/Ag) = E (Ag +/Ag) + 0.0592 V ⨯)])(NH ([Ag 1lg+23f KE ([Ag(CN)2]-/Ag) = E (Ag +/Ag) + 0.0592 V ⨯) ] (CN) ([Ag 1lg2f - K因 f K ([Ag(NH 3)2]+) << f K ([Ag(CN)2]-) 故 E ([Ag(NH 3)2]+/Ag) > E ([Ag(CN)2]-/Ag)*16.解:现将半电池反应:Fe 3+ + e -Fe 2+ 与[Fe(CN)6]3- + e -[Fe(CN)6]4-组成原电池反应,令该原电池的电动势等于0,即E ( Fe 3+/ Fe 2+) =E ([Fe(CN)6]3-/ [Fe(CN)6]4-)则E ( Fe 3+/ Fe 2+) + 0.0592 V ⨯ 3+θ2+θ(Fe )/lg(Fe )/c cc c =E ([Fe(CN)6]3-/ [Fe(CN)6]4-)+ 0.0592 V ⨯ 3-θ64-θ6([Fe (CN)])/lg ([Fe (CN)])/c c c c E [Fe(CN)6]3-/ [Fe(CN)6]4-)=3+θ4-θ-θ662+θ3-θ-θ66{(Fe )/}{([Fe (CN)])/}{(CN))/}lg {(Fe )/}{([Fe (CN)])/} {(CN )/}c c c c c c c c c c c c ⎫⎧⋅⎪⨯⎨⎬⋅⎪⎩⎭=0.361V得 f K ([Fe(CN)6]3-)=8.4⨯1041*17. 解:由题意知: E 1 = E ([Cu(NH 3)4]2+/Cu) - E (Zn 2+/Zn) = 0.7083 VE ( Cu 2+/Cu) =0.340V, E (Zn 2+/Zn) = -0.7626 VE ([Cu(NH 3)4]2+/Cu) = -0.0543 V而 E ([Cu(NH 3)4]2+/Cu) = E ( Cu 2+/Cu) + 20.0592 Vlg{(Cu )/}2c c +⨯-0.0543 V = 0.340V+20.0592 Vlg{(Cu )/}2c c +⨯, 得: c (Cu 2+) = 4.78⨯10-14 mol·L -1。