氢原子光谱-南京大学解读
- 格式:docx
- 大小:179.61 KB
- 文档页数:8



氢原子光谱解析玻尔的原子理论是建立在三个基本假设的基础上:(1)原子系统只能具有一系列的不连续的能量状态,在这些状态中,电子虽然作加速运动但不辐射电磁能量。
这些状态叫做原子的定态,相应的能量分别为E1,E2,E3……(E1<E2<E3<……)这就是所谓的定态假设。
(2)当原子从一个具有较大能量E2的定态跃迁到另一个能量较低的定态E1时,它辐射出具有一定频率的光子,光子的能量为hv=E2—E1这一假设确定了原子发光的频率——它就是频率假设。
(3)原子的不同能量状态和电子沿不同的圆形轨道绕核运动相对应,电子的可能轨道的分布也是不连续的,只有当轨道的半径r与电子的动量P的乘积(即为动量矩)等于h/2π的整数倍,轨道才是可能的。
即根据玻尔的第二个假设,原子系统中电子从较高能级Wn ,跃迁到较低能级Wk时,发出单色光,其频率为其波数为电子在量子数为n的轨道上运动时,其原子系统的总能量Wn等于电子的动因为与能级Wk 和Wn相应的量子数分别为k和n所以有由玻尔假设而推出的上式,当k为2时,与氢原子光谱巴耳末系的里德伯公式完全相同,且R的理论值可由式算出,结果R=1.097373×107〔米〕-1,此值与经验公式中的R的实验值十分符合。
故上式也为里德伯恒量提供了理论解释。
根据玻尔理论,氢原子光谱的产生可解释如下:由式可知,n越大,原子系统Wn的绝对值越小,但代数值越大,亦即电子离核越远,原子能量越大。
电子在第一轨道亦即最内层轨道(n=1)时,能量最小,原子最为稳定,这种状态便是基态。
量子数n大于1的各个状态,其能量均大于基态能量,这些状态都是激发态。
当原子由基态跃迁到受激态时,原子必须吸收一定的能量。
例如原子受到辐射的照射或高能粒子的撞击等,这时电子可由第一轨道跃迁到量子数较高的轨道上运动。
处于受激状态的原子一般在10-8秒内自发地跃迁到能量较低的受激态或基态,在跃迁过程中,将发射一个一定频率的光子,其波数由决定。

氢原子光谱课件引言氢原子光谱是量子力学和原子物理学领域的基础内容,对于理解原子结构、光谱现象以及化学键的形成具有重要意义。
本课件旨在介绍氢原子光谱的基本原理、实验观测和理论解释,帮助读者深入理解氢原子的能级结构和光谱特性。
一、氢原子的基本结构1.1电子轨道和量子数氢原子由一个质子和一个电子组成,电子围绕质子旋转。
根据量子力学的原理,电子在氢原子中只能存在于特定的轨道上,这些轨道被称为能级。
每个能级由主量子数n来描述,n的取值为正整数。
1.2能级和能级跃迁氢原子的能级可以用公式E_n=-13.6eV/n^2来表示,其中E_n 是第n能级的能量,单位为电子伏特(eV)。
当电子从一个能级跃迁到另一个能级时,会吸收或发射一定频率的光子,这个频率与能级之间的能量差有关。
二、氢原子光谱的实验观测2.1光谱仪和光谱图氢原子光谱可以通过光谱仪进行观测。
光谱仪将入射光分解成不同频率的光谱线,并将这些光谱线投射到感光材料上,形成光谱图。
通过观察光谱图,可以得知氢原子的能级结构和光谱特性。
2.2巴尔末公式实验观测到的氢原子光谱线可以通过巴尔末公式来描述,公式为1/λ=R_H(1/n1^21/n2^2),其中λ是光谱线的波长,R_H是里德伯常数,n1和n2是两个能级的主量子数。
巴尔末公式可以准确地预测氢原子光谱线的位置。
三、氢原子光谱的理论解释3.1玻尔模型1913年,尼尔斯·玻尔提出了氢原子的量子理论模型,即玻尔模型。
该模型假设电子在氢原子中只能存在于特定的轨道上,每个轨道对应一个能级。
当电子从一个能级跃迁到另一个能级时,会吸收或发射一定频率的光子。
3.2量子力学解释1925年,海森堡、薛定谔和狄拉克等人发展了量子力学理论,为氢原子光谱提供了更为精确的解释。
量子力学认为,电子在氢原子中的状态可以用波函数来描述,波函数的平方表示电子在空间中的概率分布。
通过解薛定谔方程,可以得到氢原子的能级和波函数。
四、结论氢原子光谱是量子力学和原子物理学的基础内容,对于理解原子结构、光谱现象以及化学键的形成具有重要意义。

氢(氘)原子光谱侯建强(南京大学匡亚明学院理科强化部2010级,学号:101242015)1.引言光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法。
1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。
1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。
通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原子理论可靠性的标准和测量其他基本物理常数的依据。
2.实验目的(1)熟悉光栅光谱仪的性能和用法;(2)用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数。
3.实验原理1.氢原子光谱氢原子光谱是最简单、最典型的原子光谱。
用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。
瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式4220-=n n H λλ (1)式中λH 为氢原子谱线在真空中的波长。
λ0=364.57nm是一经验常数。
n取3,4,5等整数。
若用波数表示,则上式变为⎪⎭⎫ ⎝⎛-==221211~n R v H H H λ (2)式中RH 称为氢的里德伯常数。
根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得)/1()4(2320242M m ch z me R z +=πεπ (3)式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空介电常数,z 为原子序数。
当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)320242)4(2ch z me R πεπ=∞ (4)所以错误!未找到引用源。
(5) 对于氢,有)/1(H H M m R R +=∞(6)这里MH 是氢原子核的质量。




18.3 氢原子光谱学习目标1.了解光谱的定义与分类。
2.理解氢原子光谱的实验规律,知道何为巴耳末系。
3.了解经典原子理论的困难。
重点:1.氢原子光谱的实验规律。
2.光谱分析的概念和特点。
难点:氢原子光谱的实验规律。
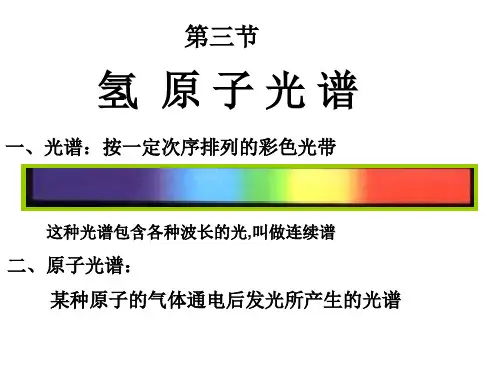
知识点一、光谱1.概念:用光栅或棱镜可以把各种颜色的光按波长展开,获得光的波长(频率)和强度分布的记录,即光谱。
2.光谱是电磁辐射(不论是在可见光区域还是在不可见光区域)的波长成分和强度分布的记录。
有时只是波长成分的记录。
3.分类(1)发射光谱:物体发光直接产生的光谱叫做发射光谱。
1①发射光谱可分为两类:连续光谱和明线光谱。
②连续分布的包含有从红光到紫光各种色光的光谱叫做连续光谱。
只含有一些不连续的亮线的光谱叫做明线光谱。
明线光谱中的亮线叫谱线,各条谱线对应不同波长的光。
a、炽热的固体、液体和高压气体的发射光谱是连续光谱。
例如白炽灯丝发出的光、烛焰、炽热的钢水发出的光都形成连续光谱。
如图。
b、稀薄气体或金属的蒸气的发射光谱是明线光谱。
明线光谱是由游离状态的原子发射的,所以也叫原子的光谱。
实践证明,原子不同,发射的明线光谱也不同,每种原子只能发出具有本身特征的某些波长的光,因此明线光谱的谱线也叫原子的特征谱线。
如图所示。
(2)吸收光谱:高温物体发出的白光(其中包含连续分布的一切波长的光)通过物质时,某些波长的光被物质吸收后产生的光谱,叫做吸收光谱。
各种原子的吸收光谱中的每一条暗线都跟该种原子的原子的发射光谱中的一条明线相对应。
这表明,低温气体原子吸收的光,恰好就是这种原子在高温时发出的光。
因此吸收光谱中的暗谱线,也是原子的特征谱线。
太阳的光谱是吸收光谱。
氢、钠的光谱、太阳光谱。
(3)太阳光谱①太阳光谱的特点:在连续谱的背景上出现一些不连续的暗线,是一种吸收光谱。
②对太阳光谱的解释:阳光中含有各种颜色的光,但当阳光透过太阳的高层大气射向地球时,太阳高层大气中含有的元素会吸收它自己特征谱线的光,然后再向四面八方发射出去,到达地球的这些谱线看起来就暗了,这就形成了连续谱背景下的暗线。

氢原子光谱-南京大学解读氢原子光谱一、实验目的1、熟悉光栅光谱仪的性能和用法;2、用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数。
二、实验原理1、氢原子光谱氢原子光谱是最简单、最典型的原子光谱。
用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。
瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式(1)式中为氢原子谱线在真空中的波长。
=364.57nm 是一经验常数。
n取3,4,5等整数。
若用波数表示,则(1)式变为(2)式中称为氢的里德伯常数。
根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得(3)式中为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,为真空介电常数,z 为原子序数。
当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)(4)所以(5)对于氢,有(6)这里是氢原子核的质量。
由此可知,通过实验测得氢的巴尔末线系的前几条谱线的波长,借助(6)式可求得氢的里德伯常数。
里德伯常数是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为=10973731.568549(83) 。
4220-=n n H λλ??? ??-==221211~n R v H H H λ)/1()4(2320242M m ch z me R z +=πεπ320242)4(2ch z me R πεπ=∞)/1(H H M m R R +=∞表1为氢的巴尔末线系的波长表。
表1 氢的巴尔末线系波长值得注意的是,计算和时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。
即真空=空气+,氢巴尔末线系前6条谱线的修正值如表2所示。
2、同位素位移同一元素的不同同位素具有不同的核质量和电荷分布,由此引起原子光谱波长的微笑差别称为“同位素位移”。
一般来说,元素光谱线同位素位移的定量关系是很复杂的,只有像氢原子这样的系统,同位素位移才可以用简单的公式计算。
氢原子光谱一、实验目的1、熟悉光栅光谱仪的性能和用法;2、用光栅光谱仪测量氢原子光谱巴尔末系数的波长,求里德伯常数。
二、实验原理1、氢原子光谱氢原子光谱是最简单、最典型的原子光谱。
用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可得到线状氢原子光谱。
瑞士物理学家巴尔末根据实验结果给出氢原子光谱在可见光区域的经验公式(1)式中λH 为氢原子谱线在真空中的波长。
λ0=364.57nm 是一经验常数。
n取3,4,5等整数。
若用波数表示,则(1)式变为(2)式中R H 称为氢的里德伯常数。
根据玻尔理论,对氢和类氢原子的里德伯常数的计算,得(3)式中M 为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空介电常数,z 为原子序数。
当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)(4)所以(5)对于氢,有(6)这里M H 是氢原子核的质量。
由此可知,通过实验测得氢的巴尔末线系的前几条谱线的波长,借助(6)式可求得氢的里德伯常数。
里德伯常数R ∞是重要的基本物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为R ∞=10973731.568549(83)m −1。
4220-=n n H λλ⎪⎭⎫ ⎝⎛-==221211~n R v H H H λ)/1()4(2320242M m ch z me R z +=πεπ320242)4(2ch z me R πεπ=∞)/1(H H M m R R +=∞表1为氢的巴尔末线系的波长表。
表1 氢的巴尔末线系波长值得注意的是,计算R H 和R ∞时,应该用氢谱线在真空中的波长,而实验是在空气中进行的,所以应将空气中的波长转换成真空中的波长。
即λ真空=λ空气+∆λ,氢巴尔末线系前6条谱线的修正值如表2所示。
2、同位素位移同一元素的不同同位素具有不同的核质量和电荷分布,由此引起原子光谱波长的微笑差别称为“同位素位移”。
一般来说,元素光谱线同位素位移的定量关系是很复杂的,只有像氢原子这样的系统,同位素位移才可以用简单的公式计算。
经原子核是一个质子,其质量为,氘核比氢核多一个中子,其质量为。
由可知氘原子的里德伯常数为1/2D DR R m M ∞=+ (7)由(7)式和(6)式可知氘原子核的质量比11DD HH H D H R M R M M Rm R =⎛⎫-- ⎪⎝⎭(8)对于巴尔末系,氢和氘的谱线计算公式分别为221112H H H R n υλ⎛⎫==- ⎪⎝⎭ (9) 221112D D D R n υλ⎛⎫==- ⎪⎝⎭ (10) 对于相同的n ,由上二式可得氢和氘的同位素位移为∆λ=λH −λD =λH m M H (1−M H M D )(1+m M D)(11)H λ和D λ是能够直接测量的量,测出H λ和D λ,就可以计算出氢和氘原子核的质量比。
三、实验仪器实验中用的仪器室WGD-3型组合式多功能光栅光谱仪,其主要由光栅单色仪、接收单元、扫描系统、电子放大器、A/D 采集单元、计算机组成。
其光学原理图如图1所示,入射狭缝、出射狭缝均为直狭缝,宽度范围0~2.5mm 连续可调,光源发出的光束进入入射狭缝S 1,S 2位于反射式准光镜M 2的焦面上,通过S 1入射的光束经M 2反射成平行光束投向平面光栅G 上,衍射后的平行光束经物镜M 3成像在S 2上和S 3上,通过S 3可以观察光的衍射情况,以便调节光栅;光通过S 2后用光电倍增管接收,送入计算机进行分析。
图1光栅光谱仪光学原理图图2闪耀光栅示意图在光栅光谱仪中常使用反射式闪耀光栅。
如图2所示,锯齿形是光栅刻痕形状。
现考虑相邻刻槽的相应点上反射的光线。
PQ 和P’Q’是以I角入射的光线。
QR 和Q’R’是以I’角衍射的两条光线。
PQR 和P’Q’R’两条光线之间的光程差是b(sinI +sinI’),其中b 是相邻刻槽间的距离,称为光栅常数。
当光程差满足光栅方程b (sinI +sinI’)=kλ, k =0,±1,±2,…时,光强有一极大值,或者说将出现一亮的光谱线。
对同一k ,根据I,I’可以确定衍射光的波长λ,这就是光栅测量光谱的原理。
闪耀光栅将同一波长的衍射光集中到某一特定的级k 上。
为了对光谱扫描,将光栅安装在转盘上,转盘由电机驱动,转动转盘,可以改变入射角I ,改变波长范围,实现较大波长范围的扫描,软件中的初始化工作,就是改变I 的大小,改变测试波长范围。
四、实验内容1、实验准备(1)接通电源,打开WGD-3型组合式多功能光栅光谱仪开关,接通电箱电源,并将电压调到500-900V 。
(2) 狭缝调整。
根据光源等实际情况,调节123,,S S S 狭缝。
顺时针旋转为狭缝宽度加大,反之减小。
每旋转一周狭缝宽度变化0.5nm 。
为保护狭缝,最大不超过。
不要使狭缝刀口相接触。
用力要轻。
(3) 开启计算机。
启动WGD-3型组合式光栅光谱仪控制处理软件。
(4) 初始化。
屏幕上显示工作界面后,弹出对话框,让操作者确认当前的波长位置是否有效,是否重新初始化。
如果选择取消,则初始化,波长位置回到200nm 处。
2、 氢原子发射光谱的测量(1) 利用氦原子发射光谱修正仪器的系统误差由于计算机处理软件存在系统误差,即测得的原子光谱有整体偏移,初始值不为零,在仪器上选择氦原子谱的测量,在“读取数据”项下对曲线进行寻峰,读出波长,和定标光源的已知谱线波长相比较,对波长进行修正,调整系统误差。
实验的具体方法如下:选定光谱光源为氦光源,打开放电管电源。
将光源对准光谱仪入射狭缝,通过螺旋测微器调节狭缝宽度。
必要时可在光源前加聚光镜,移动聚光镜,均匀照亮入射狭缝。
为了防止外界光源干扰,应用布盖住光谱仪。
待初始化完毕,用鼠标点击文件→新建,并点击工具栏中的“单程”扫描,开始显示图像。
如果在扫描过程中发现峰值超出最高标度,可点击“停止”。
然后寻找最高峰对应的波长,进行定波长扫描(在“工作”菜单内)。
同时调节倍增管前面的狭缝宽度,将峰值调到合适位置。
调节完毕,选择合适的波长范围,重新初始化,再单程扫描。
扫描完毕,保存文件。
测量氦原子的发射光谱,并与标准值对照,用以修正仪器的系统误差。
(2) 氢原子发射光谱的测量将光源换成氢灯,测量氢光谱的谱线。
注意,换光源前,先关闭先前光源,选择待测光源,再开启电源。
进行单程扫描,获得氢光谱的谱线,通过“寻峰”或“读取谱线数据”求出巴尔末线系前条谱线的波长。
注意测得的氢原子巴尔末线系前4条谱线的波长需要经过校正。
可使用软件进行校正,也可手工校正。
这样获得的光谱数据为氢原子巴尔末线系前4条谱线在空气中的值。
五、实验结果与分析首先测量氦原子光谱,实验测得的光谱如图3所示:图3 He的原子光谱图经过寻峰与标准氦谱线对比(见表3),误差在0.03%以内(舍去Heγ),因此可以认为表3氦原子光谱波长对比1、测量氢原子光谱,测得的光谱如图4所示:图4 氢的原子光谱图经过寻峰,可以得到峰值数据,将所得数据与与标准氢谱线峰值对比,结果见表4:表4 原子光谱波长对比从表三中可以看到,实验结果与标准相差很小,绝对误差小于0.1%,基本可以认为是相等的。
对数据进行一次直线拟合,结果如下图5所示:图5 氢原子光谱拟合图计算得真实波长λ与实测波长λ的关系为:相关系数r=,非常接近于1,可以认为实验准确的测到了氢原子的光谱图。
表5 氢原子光谱实测波长3、计算氢原子光谱各谱线的里德堡常数R H本实验测得的光谱波长为空气中波长,利用实验原理中提供的氢原子巴尔末线系前4条谱线的修正值对波长进行修正。
将修正后的波长代入公式:221112H H H R n υλ⎛⎫==- ⎪⎝⎭计算普适里德堡常数:R H=R∞1+m M H⁄=m=9.109×10−31kg, M H=1.673×10−27kg, R∞的推荐值为10973731.568549(83)/m 相对误差为:η=六、思考题1、氢光谱巴尔末线系的极限波长是多少?答:氢原子光谱在可见光区域的经验公式为2024Hnnλλ=-,式中Hλ为氢原子谱线在真空中的波长,0364.57nmλ=。
当n→∞时,取到极限波长=0364.57nmλ=。
2、谱线计算值具有唯一的波长,但实测谱线有一定宽度,其主要原因是什么?答:任何实测谱线都有一定的宽度,主要是由以下原因造成的:1.同一元素的不同同位素具有不同的核质量和电荷分布,这就导致了原子光谱波长的微小差别,这样的差别称为“同位素位移”。
显示在实验结果中,即谱线会有一定的宽度。
2.由海森伯不确定原理,有∆E∆t>h,由于测量时间是有限的,所以能量有一定的波动范围,所以测得的能级有一定展宽。
读书的好处1、行万里路,读万卷书。
2、书山有路勤为径,学海无涯苦作舟。
3、读书破万卷,下笔如有神。
4、我所学到的任何有价值的知识都是由自学中得来的。
——达尔文5、少壮不努力,老大徒悲伤。
6、黑发不知勤学早,白首方悔读书迟。
——颜真卿7、宝剑锋从磨砺出,梅花香自苦寒来。
8、读书要三到:心到、眼到、口到9、玉不琢、不成器,人不学、不知义。
10、一日无书,百事荒废。
——陈寿11、书是人类进步的阶梯。
12、一日不读口生,一日不写手生。
13、我扑在书上,就像饥饿的人扑在面包上。
——高尔基14、书到用时方恨少、事非经过不知难。
——陆游15、读一本好书,就如同和一个高尚的人在交谈——歌德16、读一切好书,就是和许多高尚的人谈话。
——笛卡儿17、学习永远不晚。
——高尔基18、少而好学,如日出之阳;壮而好学,如日中之光;志而好学,如炳烛之光。
——刘向19、学而不思则惘,思而不学则殆。
——孔子20、读书给人以快乐、给人以光彩、给人以才干。
——培根。