KFeCN的电极反应研究循环伏安法-PPT精选文档
- 格式:ppt
- 大小:414.50 KB
- 文档页数:23
[实验目的]1) 学习固体电极表面的处理方法。
2) 掌握循环伏安仪的使用技术。
3) 了解扫描速率和浓度对循环伏安图的影响。
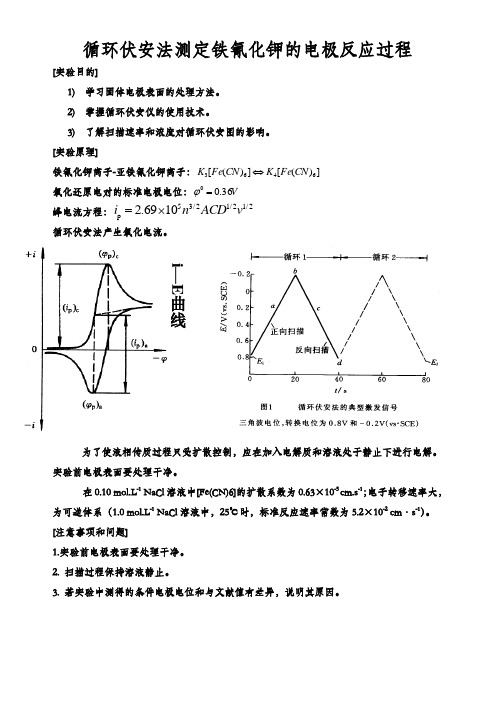
[实验原理]铁氰化钾离子-亚铁氰化钾离子:])([])([6463CN Fe K CN Fe K ⇔氧化还原电对的标准电极电位:V 36.00=ϕ峰电流方程: 循环伏安法产生氧化电流。
为了使液相传质过程只受扩散控制,应在加入电解质和溶液处于静止下进行电解。
实验前电极表面要处理干净。
在0.10 mol.L -1 NaCl 溶液中[Fe(CN)6]的扩散系数为0.63×10-5 cm.s -1;电子转移速率大,为可逆体系(1.0 mol.L -1 NaCl 溶液中,25℃时,标准反应速率常数为5.2×10-2 cm ·s -1)。
[注意事项和问题]1.实验前电极表面要处理干净。
2. 扫描过程保持溶液静止。
3. 若实验中测得的条件电极电位和与文献值有差异,说明其原因。
53/21/21/2p 2.6910i n ACD v =⨯i —E 曲线[实验步骤]1. 指示电极的预处理铂电极用Al 2O 3粉末(粒径0.05 µm)将电极表面抛光,然后用蒸馏水超声清洗3min.。
2.配制溶液配制2⨯10-2、2⨯10-3 、8⨯10-4、2⨯10-4 mol ·L -1的K 3[Fe(CN)6]溶液。
3. 不同扫描速率K 3[Fe(CN)6]溶液的循环伏安图先对10-3mol·L -1K 3 [Fe(CN)6]溶液(含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )以20mV/s 在+0.8至-0.2V 电位范围内扫描循环伏安图。
再对上述溶液以10、40、60、80、100、200mV/s ,在+0.8至-0.2V 电位范围内扫描,分别记录循环伏安图。
4. 不同浓度K 3[Fe(CN)6]溶液的循环伏安图在10-4、4⨯10-4、10-2 mol·L -1 K 3[Fe(CN)6]溶液(均含支持电解质KNO 3浓度为0.50 mol·L -1, 通氮气除氧5min )中,以20mV/s ,在-0.2至+0.8V 电位范围内扫描,分别记录循环伏安图。




