离子所带电荷数越多,阴、阳离子半径越小 , 离子键越强,熔沸点越高 。
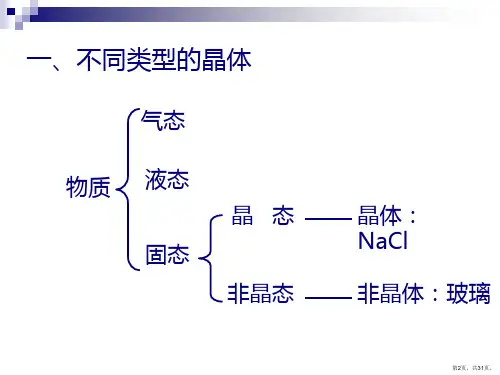
4、物质类别: 大部分的盐、可溶性强碱、某些金属氧化
物都形成离子晶体(离子化合物)。
[问题2]:干冰晶体中存在哪些微粒?如何结合 成晶体的?
[小结]:在CO2晶体中, 存在(填存在或不存
在)分子, 存在许多
, CO2分子
以 分子间作相用结力合, CO2表示的含义
小结2:晶体熔沸点高低的判断
⑴不同晶体类型的熔沸点比较 一般:原子晶体>离子晶体>分子晶体(有例外)
⑵同种晶体类型物质的熔沸点比较 ①离子晶体: 组成类似的离子晶体
阴、阳离子半径和越小
熔沸点越高
②原子晶体:
原子半径越小→键长越短→键能越大 熔沸点越高 ③分子晶体: 组成和结构类似的分子晶体
相对分子质量越大
化合物中有无金属阳离子或者铵根离子?(有:离 子晶体)
是否属于“四种原子晶体”? 以上皆否定,则多数是分子晶体。
晶体的导电性:
离子晶体固态时不导电,水溶液中或熔融状 态下导电; 分子晶体不导电,但有些分子晶体溶于水后 导电; 原子晶体不导电;金属晶体任何状态都导电。
稀有气体的特殊性:
稀有气体是单原子分子,构成分子晶体,晶 体中不存在化学键,只存在分子间作用力。
是 一个二氧化碳分子由一个碳原。子和两个氧原子构成。
二、分子晶体 1、概念:
分子间以分子间作用力相结合的晶体。
2、结构特点: (1)在晶体中存在单个分子 (2)分子有规则地排列 (3)分子间作用力较弱
3、共同的物理性质: 一般都是绝缘体,熔融状 态也不导电。一般硬度较小,具有较低的熔点和 沸点,并有较大的挥发性。
石墨为层状结构,各层之间是分子间作用力结合, 容易滑动,所以石墨很软。