分子动理论2(玻耳兹曼分布 范氏 自由程)
- 格式:ppt
- 大小:773.50 KB
- 文档页数:33

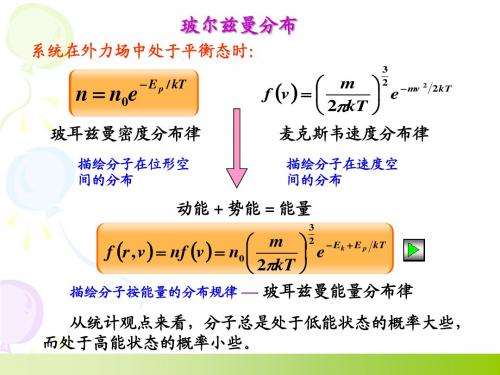

玻尔兹曼分布玻尔兹曼分布律是一种覆盖系统各种状态的概率分布、概率测量或者频率分布。
当有保守外力(如重力场、电场等)作用时,气体分子的空间位置就不再均匀分布了,不同位置处分子数密度不同。
玻尔兹曼分布律是描述理想气体在受保守外力作用、或保守外力场的作用不可忽略时,处于热平衡态下的气体分子按能量的分布规律玻尔兹曼(L.E.Boltzmann)将麦克斯韦分布律推广到有外力场作用的情况。
在等宽的区间内,若E1>E2,则能量大的粒子数dN1小于能量小的粒子数dN2,状态即粒子优先占据能量小的,这是玻尔兹曼分布律的一个重要结果。
经过将近一个世纪的传播,物理学界、化学界渐渐接受了道尔顿的“原子—分子模型”,但原子、分子的确凿证据迟迟没有找到。
恰恰此时,一股更强大的科学成就——热力学第一、第二定律出现了。
热力学原则上解决了一切化学平衡的问题。
1892年,物理化学家奥斯特瓦尔德试图在此基础上证明,将物理学和化学问题还原为原子或分子之间的力学关系是多余的。
他试图将“能量”赋以实物一样的地位,甚至要把物质还原为能量。
他提出“世界上的一切现象仅仅是由于处于空间和时间中的能量变化构成的”。
在统计学中,麦克斯韦- 玻尔兹曼分布是一种特殊的概率分布,以詹姆斯·克拉克·麦克斯韦和路德维希·玻尔兹曼的名字命名。
它一开始在物理中定义并使用是为了描述(特别是统计力学中描述理想气体)在理想气体中粒子自由移动的在一个固定容器内与其它粒子无相互作用的粒子速度,除了它们相互或与它们的热环境交换能量与动量所产生的非常短暂的碰撞。
在这种情况下粒子指的是气态粒子(原子或分子),并且粒子系统被假定达到热力学平衡。
在这种分布最初从麦斯威尔1960年的启发性的基础上衍生出来时,玻尔兹曼之后对这种分布的物理起源进行了大量重要调查粒子速度概率分布指出哪一种速度更具有可能性:粒子将具有从分布中随机选择的速度,并且比其它选择方法更可能在速度范围内。



理想气体的状态方程和分子动理论理想气体是指分子之间不存在相互作用力,分子体积可以忽略不计的气体。
它是研究气体行为和性质的理想化模型。
在研究理想气体时,我们通常采用状态方程和分子动理论来描述其性质和行为。
一、状态方程理想气体的状态方程描述了气体的压强、体积和温度之间的关系。
根据研究者的不同,有多种不同形式的理想气体状态方程。
其中最常用的是以下三个状态方程:理想气体状态方程、范德瓦尔斯方程和麦克斯韦-玻尔兹曼分布方程。
1. 理想气体状态方程理想气体状态方程由理想气体的压强、体积和温度三个物理量之间的关系构成。
它可以表示为:PV = nRT其中,P表示气体的压强,V表示气体的体积,n表示气体的物质的量,R为气体常数,T表示气体的温度。
2. 范德瓦尔斯方程范德瓦尔斯方程是对理想气体状态方程的修正,考虑了分子之间存在的相互作用力和分子体积,可表示为:(P + an^2/V^2)(V - nb) = nRT其中,a和b为范德瓦尔斯方程的修正参数,能够更精确地描述气体的行为。
3. 麦克斯韦-玻尔兹曼分布方程麦克斯韦-玻尔兹曼分布方程描述了气体分子的速率分布。
根据该方程,气体分子的速率服从麦克斯韦-玻尔兹曼速率分布律,可表示为:f(v) = 4π((m/(2πKT))^3/2) * v^2 * exp(-mv^2/(2KT))其中,f(v)表示分子的速率分布函数,m为分子的质量,K为玻尔兹曼常数,T为气体的温度。
二、分子动理论分子动理论是研究气体分子运动及其性质的理论。
它基于分子的运动理论,解释了气体的压强、温度和体积等宏观性质。
1. 分子速率和平均速度根据分子动理论,气体分子的速率是不同的,呈速率分布。
根据麦克斯韦-玻尔兹曼分布方程,可以计算出气体分子的平均速度。
平均速度与气体的温度相关。
2. 分子碰撞和压强分子动理论认为,气体分子之间发生的碰撞会产生压强。
气体的压强由分子的碰撞频率和平均碰撞力决定。
根据分子动理论,压强与气体分子的速率和密度有关。