FMO理论对周环反应的几点解释
- 格式:pdf
- 大小:289.35 KB
- 文档页数:3



第十七章 周环反应我们学过了离子型反应、游离基反应。
这些反应过程是分步进行的,首先形成正离子、负·或游离基。
然后再完成反应。
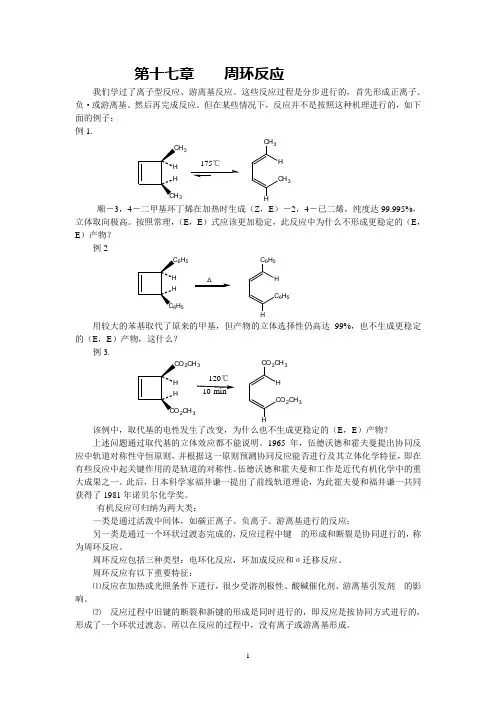
但在某些情况下,反应并不是按照这种机理进行的,如下面的例子: 例1.33175℃CH 3H CH 3H顺-3,4-二甲基环丁烯在加热时生成(Z ,E )-2,4-已二烯,纯度达99.995%,立体取向极高。
按照常理,(E ,E )式应该更加稳定,此反应中为什么不形成更稳定的(E ,E )产物?例2△C 6H 5H C 6H 5H 6H 5H 5用较大的苯基取代了原来的甲基,但产物的立体选择性仍高达99%,也不生成更稳定的(E ,E )产物,这什么?例3.2CH 32CH 3CO 2CH 3H CO 2CH 3H 120℃10min该例中,取代基的电性发生了改变,为什么也不生成更稳定的(E ,E )产物?上述问题通过取代基的立体效应都不能说明。
1965年,伍德沃德和霍夫曼提出协同反应中轨道对称性守恒原则,并根据这一原则预测协同反应能否进行及其立体化学特征,即在有些反应中起关键作用的是轨道的对称性。
伍德沃德和霍夫曼和工作是近代有机化学中的重大成果之一。
此后,日本科学家福井谦一提出了前线轨道理论,为此霍夫曼和福井谦一共同获得了1981年诺贝尔化学奖。
有机反应可归纳为两大类:一类是通过活泼中间体,如碳正离子、负离子、游离基进行的反应; 另一类是通过一个环状过渡态完成的,反应过程中键 的形成和断裂是协同进行的,称为周环反应。
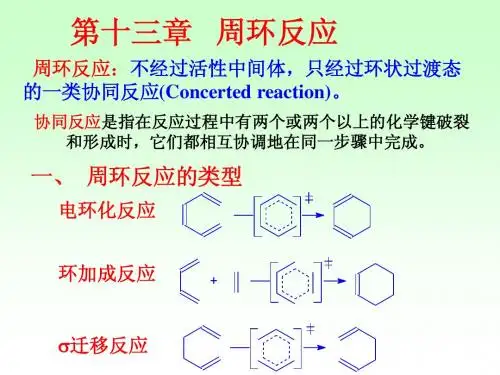
周环反应包括三种类型:电环化反应,环加成反应和σ迁移反应。
周环反应有以下重要特征:⑴反应在加热或光照条件下进行,很少受溶剂极性、酸碱催化剂、游离基引发剂 的影响。
⑵ 反应过程中旧键的断裂和新键的形成是同时进行的,即反应是按协同方式进行的,形成了一个环状过渡态。
所以在反应的过程中,没有离子或游离基形成。
⑶ 反应常 具有高度的立体选择性。
第一节 电环化反应在线形共轭体系的两端,由两个π电子生成一个新的σ键 其逆反应都称为电环化反应。





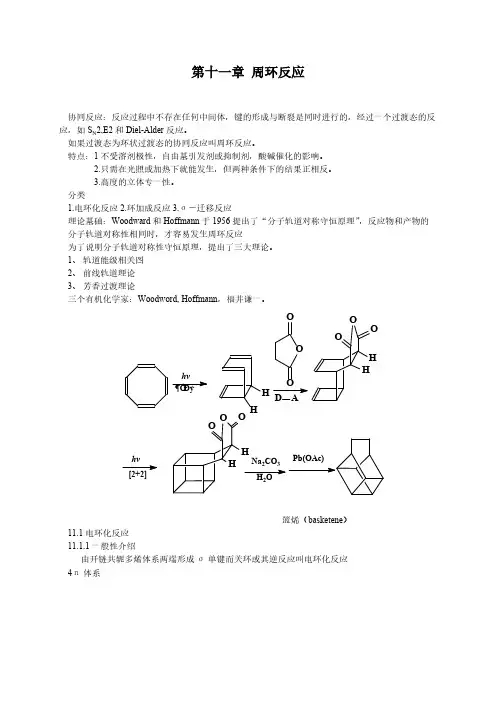
周环反应主要内容 一、引言二、周环反应的分类及理论解释 分类:1.电环化反应(electrocyclic reactions)2.环加成反应(cycloaddition reactions)3.σ-键迁移反应(sigmatropic rearrangement)理论解释:1.前线轨道理论2.分子轨道对称性守恒3.芳香过渡态理论三、总结 引言在本科学习过两类反应:离子反应:通过键的异裂而产生的C +、C -为中间体 自由基反应:通过键的均裂而产生的C .为中间体 但是,有没有其它类型的反应呢?1912年 Claisen 重排等1928年 Diels-Alder 反应,研究相当深入,应用广泛+OOH但这类反应没有检测到反应中间体,不服从上述两种反应机理,不受溶剂极性影响,不被酸碱催化,也不受自由基引发剂或淬灭剂的影响,是一类很特殊的有机反应,一度认为是没有机理的反应,困惑化学界50多年(从1912年Claisen 反应起)。
1958年Vogel 报道了一个有趣的反应:而得不到更稳定的:或者不稳定的:1961年荷兰Leiden 大学Prof.Haringa 研究己三烯关环时,得到的是CH 3—、H —反式的关环产物。
该校Oosterhoff 教授认为,加热和光照所引起的化学反应的立体化学不同可能是由于受到其他因素(如共轭己三烯的轨道对称性)的影响,并进一步提出是受最高占据轨道和节点数控制的。
这一见解Haringa 作为脚注发表在四面体上。
这已经接近了分子轨道对称性守恒大门,可以说已经踏入了一只脚。
CO 2Me2Metrans-tranH CO 2MeHCO 2Me△120℃CO 2MeCO 2Mecis-trans与此同时,美国Woodward和Eschenmoser正领导全世界来自19个国家的100位科学家进行V12全合成工作,历时12年,于1972年宣告完成,轰动一时,是B有机合成的杰作,传为佳话。
17--周环反应一周环反应1.定义:在最近的五十年里,有机化学家研究有机化学机理,主要有两种。
一种是游离基型反应,一种是离子型反应,它们都生成稳定或不稳定的中间体。
离子型或游离基型反应:反应物→中间体→产物另一种机理是,在反应中不形成离子或游离基的中间体,而认为是有电子重新组织经过四或六中心环的过渡态而进行的。
这类反应不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对反应有什么关系。
这类反应似乎表明化学键的断裂和生成是同时发生的。
这种一步完成的多种心反应叫周环反应。
周环反应:反应物→产物2.周环反应的特征:①反应进行的动力,是加热或光照。
②反应进行时,有两个以上的键同时断裂或形成,是多中心一步反应。
③反应时作用物的变化有突出的立体选择性。
④在反应过渡态中原子排列是高度有序的。
二. 分子轨道理论几个原子轨道线性组合,形成几个分子轨道,比原子轨道能量低的为成键轨道,比原子轨道能量高的为反键轨道。
其电子填充符合Pauli原理和Hund规则。
σ轨道:Л轨道:丁二烯的分子轨道:镜面节面直链共轭多烯烃分子轨道特点:①节面数:若共轭多烯烃有几个原子,它的n个轨道就有n-1个节面。
②轨道的节面越多,能量越高。
③高一能级的轨道和低一能级的轨道的对称性是相反的。
④图中的共轭多烯烃的对称性都是指类顺型(像顺型)的。
三.前线轨道福井认为最高的已占分子轨道(HOMO)上的电子被束缚得最松弛,最容易激发到能量最低的空轨道(LUMO)中去。
这些轨道是处于前线轨道(FMO),前线轨道理论认为:化学键的形成主要是由FMO的相互作用决定的。
分子的HOMO与LUMO 能量接近,容易组成新轨道。
§1.电环化反应1.定义:在n个Л电子的线型共轭体系中,在其两端点之间生成一个单键的反应及其逆过程称为电环化反应。
电环化反应中,多烯烃的一个Л键变成环烯烃里的一个σ键。
如:(Z,E)2,4-己二烯根据微观可逆性原则,正反应和逆反应所经过的途径是相同的。