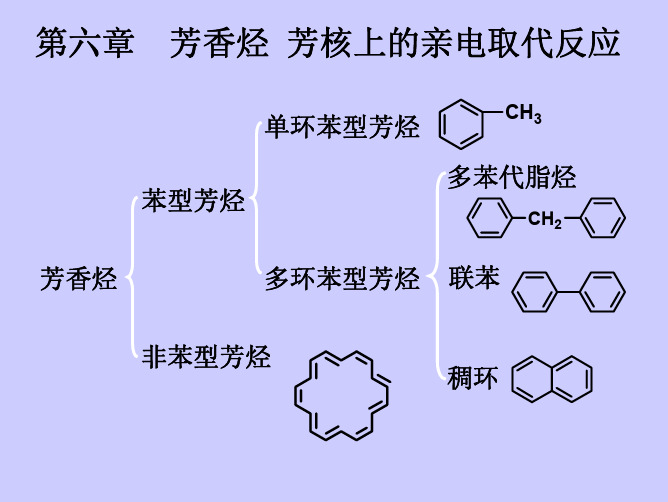
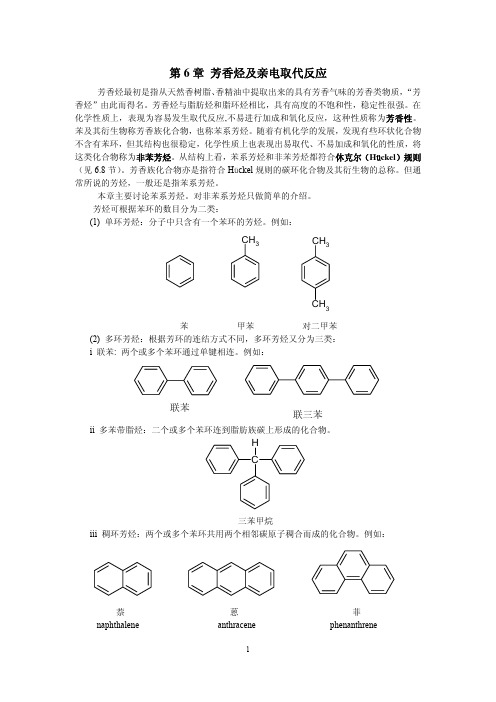
芳香烃 亲电取代反应
- 格式:ppt
- 大小:2.41 MB
- 文档页数:94

傅克反应傅-克反应傅里德-克拉夫茨反应,简称傅-克反应,是一类芳香族亲电取代反应,1877年由法国化学家查尔斯·傅里德(Friedel C)和美国化学家詹姆斯·克拉夫茨(Crafts J)共同发现。
该反应主要分为两类:烷基化反应和酰基化反应。
傅-克反应:(1)傅-克烷基化反应;(2)傅-克酰基化反应傅-克烷基化反应傅-克烷基化反应在强路易斯酸的催化下使用卤代烃对一个芳环进行烷基化。
假设使用无水氯化铁作为催化剂,在氯化铁的作用下,卤代物产生碳正离子,碳正离子进攻苯环并取代环上的氢,最后产生烷基芳香族化合物和氯化氢。
总反应式如下:傅-克烷基化机理这类反应有个严重缺点:由于烷基侧链的供电性,反应产物比起原料具有更高的亲核性,于是产物苯环上的另一个氢继续被烷基所取代,导致了过烷基化现象而形成了众多副产物。
由于这类反应是可逆的,还可能出现烷基被其他基团所取代的副产物(例如被氢取代时,也称为傅-克脱烷基化反应);另外长时间的反应也会导致基团的移位,通常是转移至空间位阻较小、热力学稳定的间位产物。
另外如果氯不是处于三级碳原子(叔碳原子)上,还有可能发生碳正离子重排反应,而这取决于碳正离子的稳定性:即三级碳>二级碳>一级碳。
空间位阻效应可以被利用于限制烷基化的数量,比如1,4-二甲氧基苯的叔丁基化反应。
1,4-二甲氧基苯的叔丁基化烷基化的底物并不局限于卤代烃类,傅-克烷基化可以使用任何的碳正离子中间体参与反应,如一些烯烃,质子酸,路易斯酸,烯酮,环氧化合物的衍生物。
如合成1-氯-2-甲基-2-苯基丙烷就可以从苯与3-氯-2-甲基丙烯进行反应:1-氯-2-甲基-2-苯基丙烷的合成曾有研究实例表明亲电试剂还能选用由烯烃和NBS生成的溴离子。
通过烯烃的傅-克烷基化在这个反应中三氟甲磺酸钐被认为在卤离子形成中活化了NBS的供卤素能力。
傅-克去烷基化反应傅-克烷基化是一个可逆反应。
在逆向傅-克反应或者称之为傅-克去烷基化反应当中烷基可以在质子或者路易斯酸的存在下去除。



高二化学芳香烃知识点1、亲电取代反应芳香烃图册主要包含五个方面:卤代:与卤素及铁粉或相应的三卤化铁存在的条件下,可以发生苯环上的h被取代的反应。
卤素的反应活性为:f>cl>br>i不同的苯的衍生物发生的活性是:烷基苯>苯>苯环上有吸电子基的衍生物。
烷基苯出现卤代的时候,如果就是上述催化剂,可以出现苯环上h替代的反应;例如在光照条件下,可以出现侧链上的h被替代的反应。
应用:鉴别。
溴水或溴的四氯化碳溶液如:鉴别:苯、己烷、苯乙烯。
答案:step1:溴水;step2:溴水、fe粉。
硝化:与浓硫酸及浓硝酸混酸存有的条件下,在水浴温度为55摄氏度至60摄氏度范围内,可以向苯环上导入硝基,分解成硝基苯。
相同化合物出现硝化的速度同上。
磺化:与浓硫酸发生的反应,可向苯环引入磺酸基。
该反应是个可逆的反应。
在酸性水溶液中,磺酸基可脱离,故可用于基团的保护。
烷基苯的磺化产物随温度变化:高温时主要得到对位的产物,低温时主要得到邻位的产物。
f-c烷基化:条件就是浓硫酸alx3等lewis酸存有的情况下,苯及衍生物可以与rx、烯烃、醇出现烷基化反应,向苯环中导入烷基。
这就是个可逆反应,常分解成多元替代物,并且在反应的过程中可以出现c正离子的重排,常常不能获得须要的产物。
该反应当苯环上相连接存有喷电子基团时无法展开。
例如:由苯制备甲苯、乙苯、异丙苯。
f-c酰基化:条件同上。
苯及衍生物可与rcox、酸酐等发生反应,将rco-基团引入苯环上。
此反应不会重排,但苯环上连接有吸电子基团时也不能发生。
如:苯合成正丙苯、苯乙酮。
亲电取代反应活性小结:相连接给电子基的苯替代物反应速度大于苯,且相连接的给电子基越多,活性越大;恰好相反,相连接喷电子基的苯替代物反应速度大于苯,且相连接的喷电子基越多,活性越大。
2、加成反应与h2:在催化剂pt、pd、ni等存有条件下,可以与氢气出现加成反应,最终分解成环己烷。
与cl2:在光照条件下,可以出现自由基加成反应,最终分解成六六六。