常见的金属和盐
- 格式:doc
- 大小:28.00 KB
- 文档页数:2

第六单元 常用的金属和盐第一节 奇光异彩的金属1、金属的物理性质:(1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)(3)高熔点、沸点,有良好的导热性、导电性、延展性2、金属之最:(1)铝:地壳中含量最多的金属元素(2)钙:人体中含量最多的金属元素(3)铁:目前世界年产量最多的金属(铁>铝>铜)(4)银:导电、导热性最好的金属(银>铜>金>铝)(5)铬:硬度最高的金属 (6)钨:熔点最高的金属(7)汞:熔点最低的金属 (8)锇:密度最大的金属(9)锂 :密度最小的金属3、金属分类⎪⎪⎩⎪⎪⎨⎧⎩⎨⎧⎪⎩⎪⎨⎧>ρ<ρ外的所有金属有色金属:除黑色金属黑色金属:铁、铬、锰)(重金属:轻金属:)(2cm /g 5.4cm /g 5.41334、置换反应:由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应(是基本反应类型的一种)。
A+BC→B+ACZn + 2HCl −→−ZnCl 2 + H 2↑ 5、氧化还原反应:在化学反应过程中有元素化合价升降的化学反应叫做氧化还原反应。
有氧参加的反应中:得氧还、失氧氧(反应后等到氧的物质是还原剂,反应后失去氧的物质是氧化剂)无氧参加的反应中:● 所含元素化合价升高的物质被氧化,发生氧化反应,对应产物是氧化产物,自身是还原剂。
● 所含元素化合价降低的物质被还原,发生还原反应,对应产物是还原产物,自身是氧化剂。
20H + O Cu 2+ −→−△ 0Cu + O H 21+ 还原剂 氧化剂 还原产物 氧化产物6、常见金属的性质(1)、大多数金属可与氧气的反应 :①铁:纯净的铁具有银白色金属光泽,质软,有良好的延展性,密度是7.86g/cm 3,熔点1535℃,沸点2750℃,是电和热的导体。
A :在氧气中燃烧3Fe + 2O 2 −−→−点燃Fe 3O 4 现象:剧烈燃烧,火星四射,放出大量的热,生成黑色固体B :铁在潮湿空气中容易发生缓慢氧化,生锈(铁锈主要成分Fe 2O 3·XH 2O ):条件是水 ,氧气(空气)2Mg + O 2 −−→−点燃2MgO 现象:放出热量,发出耀眼白光,生成白色固体 3Mg + N 2 −−→−点燃Mg 3N 2 现象:放出热量,发出耀眼白光,生成白色固体 2Mg + CO 2 −−→−点燃2MgO + C 现象:发出耀眼白光,生成白色(是氧化镁)和黑色(为碳单质)固体③铜铜在空气中加热 2Cu + O 2 −→−△2CuO 现象:红色固体逐渐变为红色 (2)常见金属活动性顺序:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au第二节 盐和化肥定义:金属或铵根和酸根组成的化合物。

金属和盐溶液反应金属和盐溶液是化学中一种常见的反应。
在日常生活中,我们可以通过这种反应制备出许多有用的物质,例如工业生产中的金属材料和化肥。
本文将从三个方面来探讨金属和盐溶液的反应:反应机理、常见金属和盐溶液反应、及应用。
一、反应机理金属和盐溶液的反应机理通常是离子交换。
金属一般为电负性较低、易失去电子的元素,如铁、铜、镁等。
而盐溶液中的化合物则是由阳离子和阴离子组成的,例如氯化钠(NaCl)中有Na+和Cl-离子。
当金属和盐溶液接触时,金属的电子会转移给阳离子,形成金属离子和阴离子。
例如,铁和氯化铜溶液反应时,铁上的两个电子会转移到Cu2+离子上,生成Fe2+离子和Cu金属,化学方程式为Fe + CuCl2 → FeCl2 + Cu。
二、常见金属和盐溶液反应1. 镁和盐酸反应当固态的镁和盐酸溶液接触时,会立刻产生水溶性的氯化镁和氢气。
这是因为镁是一种活泼的金属,在接触到酸性物质时,会立即释放出氢气。
化学方程式为Mg + 2HCl → MgCl2 + H2。
2. 铁和硫酸反应铁和硫酸反应是制备铁盐的一种常见方法。
当铁和浓硫酸发生反应时,会产生水溶性的硫酸铁和氢气。
化学方程式为Fe + H2SO4 → FeSO4 + H2。
3. 铝和氢氧化钠反应铝和氢氧化钠反应产生的是一个强碱性的氢氧化铝。
化学方程式为2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2。
三、应用金属和盐溶液反应在实际应用中有广泛的用途。
以下是一些常见的应用:1. 制备金属材料:金属和盐溶液反应可以用来制备很多种金属材料,例如铜、锌、镍等。
2. 制备化肥:许多农业生产中使用的化肥都是通过金属和盐溶液反应制备而成的,例如硝酸铵(NH4NO3)。
3. 污水处理:金属和盐溶液反应可以用来处理污水,将污水中的有机物质和重金属离子转化为无毒、无害的物质。
总之,金属和盐溶液反应是一种很常见的化学反应。
通过了解其反应机理和应用,我们可以更好地掌握化学知识并应用于实践中。


盐的复习一、几种常见的盐1、氯化钠:化学式——NaCl俗称食盐无色晶体易溶于水,有咸味。
重要的化工原料——广泛用于制取氯气、盐酸、火碱、纯碱等工业方面;并在塑料、橡胶、合成纤维、医药、农药等工业方面有广泛的应用,也是日常生活重要的调味品。
2、碳酸钠:化学式——Na2CO3,俗称:纯碱白色粉末,易溶于水成无色溶液。
实验事实:无色碳酸钠溶液能使无色酚酞试液变红。
说明:碳酸钠的水溶液呈碱性。
一般情况下:碳酸盐如碳酸钠,碳酸钾(K2CO3)等均能与盐酸发生剧烈反应,有无色气体产生——该气体能使澄清的石灰水变浑浊,即生成CO2。
Na2CO3+2HCl→2NaCl+H2O+CO2↑K2CO3+2HCl→2KCl+H2O+CO2↑主要用途:重要的化工原料——玻璃、造纸、纺织、制药、精炼石油等方面用途显著。
3、硫酸铜:化学式——CuSO4无水硫酸铜为白色粉末,易溶于水,其水溶液为蓝色。
硫酸铜晶体含五个结晶水,为蓝色、因此俗称蓝矾或胆矾,化学式为——CuSO4·5H2O。
主要用途:是制农药波尔多液的重要原料,也广泛应用于印染,电镀等工业方面。
二、盐溶液的导电性——盐的定义1、盐溶液的导电性:实验事实证明:可溶性盐的水溶液,均具有导电性。
说明: 盐溶液中存在着自由移动的阴、阳离子,在电场作用下,自由移动的离子定向移动而形成电流,——导电。
可溶性盐在溶液里的电离: 以食盐、碳酸钾、硫酸铵等为例,其水溶液中的电离方程式为:2、盐的定义:由金属(或铵根)离子与酸根离子相结合而组成的化合物,叫盐。
三、盐的分类:1、从盐的组成上分(1)正盐: 只由金属(或铵根)离子及酸根离子组成,例:NaCl 、Na 2SO 4、NH 4NO 3、MgCl 2、K 2CO 3等。
(2)酸式盐:组成当中,除金属(或铵根)离子与酸根离子外,还有氢离子。
以碳酸氢铵,碳酸氢钠为例看酸式盐在其水溶液中的电离:NH 4HCO 3→NH 4++H ++CO 32-NaHCO 3→Na ++H ++CO 32- 电离出来的阳离子除H +外,还有其它阳离子——NH 4+、Na +,因此上述二者是盐而不是酸。

食盐中金属元素的名称。
食盐是我们日常生活中不可缺少的调味品,它不仅能使食物更加美味,还具有调节体内水分和电解质平衡的作用。
然而,你知道吗?食盐中还含有一些金属元素,这些元素在人体中也有很重要的作用。
首先,我们来了解一下食盐中主要含有哪些金属元素。
根据科学研究,食盐中主要含有钠(Na)、氯(Cl)、钙(Ca)、镁(Mg)、钾(K)和铁(Fe)等元素。
这些金属元素在食盐中的含量不同,其中钠和氯的含量最高,而钙、镁、钾和铁的含量相对较低。
钠是我们日常生活中最常见的金属元素之一,它具有调节体内电解质平衡、维持血压和神经传导的作用。
但是,当我们摄取过多的钠时,就会导致水分潴留、血压升高等不良反应。
因此,我们应该注意适量摄入钠。
氯也是一种重要的金属元素,在人体中主要存在于血液和细胞外液中,它能够维持体内电解质平衡,同时还具有排泄废物和维护酸碱平衡的作用。
钙和镁是人体需要的微量元素之一,它们在骨骼和牙齿的形成、神经传导、心脏和肌肉的正常功能等方面都起着重要的作用。
此外,钙还能够调节血液凝固、维持血压稳定等功能。
而镁则能够维持心脏和神经肌肉的正常功能。
钾在人体中主要存在于细胞内,它能够维持体内电解质平衡、调节心跳和神经传导等功能。
当人体缺乏钾时,会出现乏力、肌肉无力、心跳不齐等症状。
铁是人体中必需的微量元素之一,它能够促进血红蛋白的合成,参与氧的运输和利用,同时还能够增强免疫力和促进生长发育。
综上所述,食盐中含有的金属元素对于人体健康具有重要的作用。
但是,我们应该注意适量摄入,以避免出现不良反应。
因此,建议大家在日常生活中,尽量选择无添加剂的天然食盐,以保证健康饮食。
O2- OH- Cl- SO4 2- NO3- CO32-NH4+NH4OH或NH3·H20 无色有强刺激气味液体35.28%的氨水密度为0.88g/mlNH3·H20是氨存在于水溶液中的主要成分氨水有弱碱性、挥发性、弱腐蚀性、络合性NH4Cl白色晶体密度1.53g/cm3,350℃升华溶于水和甘油、液氨,微溶于乙醇易潮解。
水溶液为酸性,对铁、铜等有腐蚀(NH4)2SO4纯品无色斜方晶体密度1.769g/cm3,熔点513±2℃(密封管中)溶于水,不溶于乙醇。
水溶液带有辛辣咸味工业品是白色或带微黄色的小晶粒NH4NO3 无色斜方或单斜晶体溶于水、乙醇、甲醇密度1.725g/cm3,熔点169.6℃210℃分解为水和N2O(加热过猛会引起爆炸)(NH4)2CO3 纯品是无色或白色晶体常温下是固体溶于水,遇热水分解。
不溶于乙醇和CS2在58℃分解为氨、二氧化碳、水Ag+ Ag2O 褐色立方晶体密度7.143g/cm3易溶于硝酸、氨水,难溶于水和乙醇在300℃迅速分解,日光中逐渐分解为银和氧AgOH 白色固体常温下是固体遇水会分解成黄褐色氧化银沉淀在空气中缓慢分解AgCl 白色立方晶体密度5.56g/cm3,熔点455℃,沸点1550℃难溶于水、乙醇或稀酸,溶于氰化钾溶液等露光变黑,还溶于氨水等,微溶于盐酸Ag2SO4 白色斜方晶体,见光变灰色密度5.45g/cm3,熔点652℃溶于氨水、硝酸、硫酸和热水,不溶于乙醇在1085℃分解AgNO3 无色透明斜方晶体密度4.352g/cm3,熔点212℃,沸点444℃易溶于水,极易溶于氨水,略溶于乙醚纯净空气中露光不变色,有机物存在时变Ag2CO3 新制为浅黄色粉未,久置色变暗密度6.077g/cm3溶于氨水、稀硝酸、KCN、硫代硫酸钠溶液不溶于水和醇,感光性很强Cu2+CuO 黑色密度立方体6.40g/cm3,三斜晶体6.45g/cm3不溶于水和乙醇,溶于稀酸、氰化钾溶液还溶于碳酸铵溶液,在氨水中缓慢溶解Cu(OH)2 结晶物呈天蓝色片状或针状密度3.368g/cm3不溶于水,溶于酸一般沉淀在70-90℃发黑,并分解为CuO和水CuCl2 棕黄结晶粉末,二水物绿斜方晶体密度3.054(二水2.38)g/cm3,熔点498℃溶于水、甲醇、乙醇等二水物有潮解性,110℃失去结晶水,有毒CuSO4 无水绿白色粉末,五水蓝三斜晶体密度3.606(五水2.286)g/cm3,熔点220℃溶于水和氨水,不溶于无水乙醇、液氨误食后会急性中毒,650℃分解成CuO和SO3Cu(NO3)2 六水物蓝色斜方晶体六水物密度2.074g/cm3、熔点114.5℃极易溶于水和乙醇六水物易潮解,加热时分解为氧化铜常为Cu2(OH)2CO3浅绿细粒的无定形粉末密度4.0g/cm3不溶于水和醇,溶于酸形成相应的铜盐有孔雀石矿物,200℃分解成黑色的氧化铜Al3+Al2O3 白色粉末密度3.9-4.0g/cm3,熔点2050℃沸点2980℃不溶于水,能渐渐溶于浓硫酸又称矾土,自然界有刚玉Al(OH)3 无臭无味的白色单斜晶体密度2.42g/cm3不溶于水和乙醇;溶于热盐酸、硫酸和碱类典型的两性氢氧化物。
常见物质的颜色物质的俗名总汇一、硫酸盐类:1.皓矾:ZnSO4·7H2O2.钡餐、重晶石:BaSO43.绿矾、皂矾、青矾:FeSO4·7H2O 4.芒硝、朴硝、皮硝:Na2SO4·10H2O 5.明矾:KAl(SO4)2·12H2O 6.生石膏:CaSO4·2H2O7.熟石膏:2CaSO4·H2O8.胆矾、蓝矾:CuSO4·5H2O 9.莫尔盐:(NH4)2SO4·FeSO4·6H2O二、气体类:1.高炉煤气:CO,CO2等混合气体2.水煤气:CO,H2混合气体3.天然气(沼气):CH44.液化石油气:C3H8,C4H10为主5.焦炉气:CH4,CO,H2,C2H4为主6.裂解气:C2H4为主7.爆鸣气:H2和O28.笑气:N2O1.莹石:CaF22.光卤石:KCl·MgCl2·6H2O 3.黄铜矿:CuFeS24.矾土:Al2O3·H2O、Al2O3·3H2O 和少量Fe2O3、SiO25.磁铁矿石:Fe3O46.赤铁矿石:Fe2O37.褐铁矿石:2Fe2O3·3H2O8.菱铁矿石:Fe2CO39.镁铁矿石:Mg2SiO410.苏口铁:碳以片状石墨形式存在11.白口铁:碳以FeC3形式存在12.高岭石:(Al2O3·2SiO2·2H2O) 13.正长石:KAlSi3O814.石英:SiO215.硼砂:Na2B4O7·10H2O 16.脉石:SiO217.刚玉(蓝宝石、红宝石):天然产的无色氧化铝晶体18.黄铁矿(愚人金):FeS2 19.炉甘石:ZnCO320.智利硝石:NaNO321.滑石:3MgO·4SiO2·H2O 22.大理石(方解石、石灰石):CaCO3 23.孔雀石:CuCO3·Cu(OH)2 24.白云石:MgCO3·CaCO3 25.冰晶石:Na3AlF626.高岭土:Al2O3·2SiO2·2H2O 27.锡石:SnO228.辉铜矿:Cu2S29.黄铜矿:CuFeS230.冰晶石:Na3AlF6四、有机类:1.福尔马林(蚁醛):HCHO2.蚁酸:HCOOH3.尿素:(NH4CNO)或 CO(NH2)2 4.氯仿:CCl45.木精(工业酒精):CH3OH 6.甘油:CH2OH-CHOH- CH2OH 7.硬脂酸:C17H35COOH8.软脂酸:C15H31COOH9.油酸:C17H33OH10.肥皂:C17H35COONa11.银氨溶液:[Ag(NH3)2]OH 12.乳酸:CH3-CHOH-COOH 13.葡萄糖:C6H12O614.蔗糖:C12H22O1115.核糖:CH2OH-(CHOH)3-CHO 16.脱氧核糖:CH2OH-(CHOH)2-CH2-CHO 17.淀粉:(C6H10O5)n18.火棉、胶棉:主要成份都是[(C6H7O2)-(ONO2)3]n前者含N量高19.尿素:CO(NH2)2[NH4CNO为氰酸铵(与尿素互为同分异构体)]20.氯仿:CHCl321.油酸:C17H33COOH五、其他类:1.白垩:CaCO32.石灰乳、熟石灰、消石灰:Ca(OH)2 3.苛性钠、烧碱、火碱:NaOH 4.足球烯:C605.铜绿:Cu2(OH)2CO36.纯碱(碱面): Na2CO37.王水:HCl,HNO3(3∶1混合)8.水玻璃(泡火碱):Na2SiO39.小苏打:NaHCO310.苏打:Na2CO311.大苏打(海波):Na2S2O3 12.盐卤:MgCl2·6H2O 13.雌黄:As2S314.雄黄:As4S415.朱砂:HgS16.石棉:CaO·3MgO·4SiO2离子反应方程式是最基本和最重要的化学用语之一。
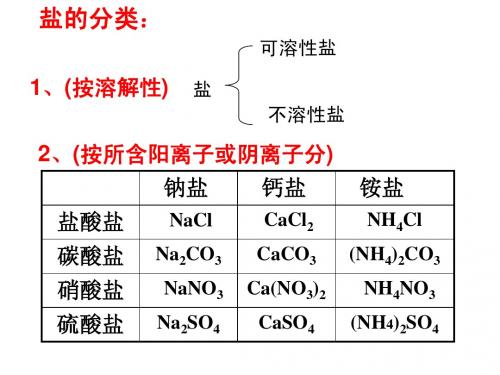
2020年中考化学知识点之盐的分类
盐的定义:由金属离子和酸根离子组成的化合物。
盐的分类:
根据阳离子的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。
根据阴离子的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。
常见的盐:
氯化钠(NaCl)
氯化钠是我们常说的盐,在自然界中分布很广泛。
碳酸钠(Na2CO3)
俗名:纯碱、苏打
水溶液呈碱性,主要原因是在水中会生成氢氧化钠用途:玻璃、造纸、纺织
可以和酸反应生成二氧化碳
碳酸氢钠(NaHCO3)
俗名:小苏打
用途:烘焙、治疗胃酸
碳酸钙(CaCO3)
大理石、石灰石、贝壳、珍珠、水垢的主要成分用途:建筑材料、补钙剂
使用酸来除去水垢。
碳酸盐的检验:
a:向待测溶解中加入稀HCl后会有气体二氧化碳产生,将生成的气体通过澄清的石灰水,此时澄清的石灰水变浑浊,说明里面有碳酸根离子,否则没有碳酸根离子
b:向待测溶液中加入氯化钡溶液,有白色沉淀(碳酸钡)产生,在此沉淀中加入稀盐酸,若有气体产生并且沉淀消失,则溶液中存在碳酸根离子
需要注意的一点是:上面举的这些盐可以很盐酸发生反应来制取二氧化碳。
《常见的金属和盐》 一、金属的物理性质: (1)常温下一般为固态(汞为液态),有金属光泽。
(2)大多数呈银白色(铜为紫红色,金为黄色)
(3)有良好的导热性、导电性、延展性
二、金属的化学性质
1、大多数金属可与氧气的反应
2、金属 + 酸 → 盐 + H 2↑
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
Fe + CuSO 4 == Cu + FeSO 4 (“湿法冶金”原理)
三、常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H )Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
在金属活动性顺序里:
(1)金属的位置越靠前,它的活动性就越强
(2)位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)
(3)位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来。
(除K 、Ca 、Na 、Ba )
四、常见的盐
1.定义:
2、精盐提纯——去除不溶性杂质,得到的精盐中还含有氯化镁、氯化钙等可溶性杂质。
1、 实验步骤:溶解、过滤、蒸发
2、 实验仪器
3、盐的化学性质
1、 盐(可溶)+ 金属1 → 金属2 + 新盐(金属1比金属2活泼,K 、Ca 、Na 除外)
2、 盐 + 酸 → 新盐 + 新酸
3、 盐 + 碱 → 新盐 + 新碱(反应物需都可溶,且满足复分解反应的条件)
4、 盐 + 盐 → 两种新盐(反应物需都可溶,且满足复分解反应的条件)
物质 俗称 物理性质 用途 氯化钠 食盐 白色粉末, 水溶液有咸味, 溶解度受温度 影响不大 (1)作调味品(2)作防腐剂
(3)消除积雪(降低雪的熔点) (4)农业上用NaCl 溶液来选种 (5)制生理盐水(0.9% NaCl 溶液)
Na + 维持细胞内外的水分分布,
促进细胞内外物质交换
Cl - 促生盐酸、帮助消化,增进食欲
碳酸钠 Na 2CO 3 纯碱(因水溶液呈碱性) 苏打 白色粉末状固体,易溶于水 用于玻璃、造纸、纺织、洗涤、食品工业等
碳酸氢钠 NaHCO 3 小苏打 白色晶体, 易溶于水 制糕点所用的发酵粉
医疗上,治疗胃酸过多
备注 (1)粗盐中由于含有氯化镁、氯化钙等杂质,易吸收空气中的水分而潮解。
(无水氯化钙可用作干燥剂)
(2)碳酸钠从溶液中析出时,会结合一定数目的水分子,化学式为Na 2CO 3·10H 2O 。
碳酸钠晶体Na 2CO 3·10H 2O (纯净物),俗称天然碱、石碱、口碱。
风化:常温时在空气中放置一段时间后,失去结晶水而变成粉末。
(化学变化)
(3)2Na H CO 3 △ Na 2CO 3+ H 2O+ CO 2↑ NaHCO 3+HCl===NaCl+ H 2O+ CO 2↑
实验步骤 实验仪器 其中玻璃棒的作用 溶解 烧杯、玻璃棒 加速溶解 过滤 铁架台(带铁圈)、漏斗、烧杯、玻璃棒 引流
蒸发 铁架台(带铁圈)蒸发皿、酒精灯、玻璃棒 使液体受热均匀,防止液体飞溅
4、酸、碱、盐的溶解性
1、酸:大多数都可溶
2、碱:只有氨水、氢氧化钠、氢氧化钾、氢氧化钡和氢氧化钙可溶于水,其余均为沉
淀
3、盐:钾盐、钠盐、铵盐、硝酸盐都可溶;
氯化物除AgCl难溶外,其余多数均可溶;
硫酸盐除BaSO4难溶,Ag2SO4、CaSO4微溶外,其余多数可溶;
碳酸盐除碳酸钾、碳酸钠、碳酸铵可溶,其余都难溶。
注:BaSO4、、AgCl 不溶于水,也不溶于酸
五、化学反应类型
1、四种基本反应类型
①化合反应:由两种或两种以上物质生成另一种物质的反应
②分解反应:由一种反应物生成两种或两种以上其他物质的反应
③置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物的反应
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应
2、氧化还原反应
氧化反应:物质得到氧的反应氧化剂:提供氧的物质
还原反应:物质失去氧的反应还原剂:夺取氧的物质(常见:H2、C、CO)
3、中和反应:酸与碱作用生成盐和水的反应
六、化学肥料
1.农家肥料:营养元素含量少,肥效慢而持久、价廉、能改良土壤结构
2、化学肥料(氮肥、钾肥、磷肥)
1)氮肥作用:促进植物茎、叶生长茂盛、叶色浓绿(促苗)。
缺氮:叶黄
a、常用氮肥
尿素CO(NH2)2:含氮量最高的氮肥(有机物)46.7%
b、NH4+的检验
试剂:碱(NaOH、Ca(OH)2等)、湿润的红色石蕊试纸
NH4NO3 + NaOH=NaNO3 +NH3↑+H2O
(2)钾肥作用:促使作物生长健壮、茎杆粗硬,抗倒伏(壮秆)。
缺钾:叶尖发黄常用钾肥 KCl
草木灰:农村最常用钾肥(主要成分为K2CO3),呈碱性
K2SO4:长期使用会使土壤酸化、板结
(3)磷肥作用:促进植物根系发达,穗粒增多,饱满(催果)
缺磷:生长迟缓,产量降低,根系不发达
常用磷肥磷矿粉 Ca3(PO4)2
钙镁磷肥(钙和镁的磷酸盐)
过磷酸钙 Ca(H2PO4)2和CaSO4 不能与碱性物质混合施用。
重过磷酸钙 Ca(H2PO4)2 如草木灰、熟石灰
4、复合肥:含N、P、K中的两种或三种
KNO3
NH4H2PO4
(NH4)2HPO4 不能与碱性物质混合施用。