盐溶液呈现不同酸碱性的原因水溶液的酸碱性的取决于什么
- 格式:ppt
- 大小:1.56 MB
- 文档页数:10

3-3-1盐溶液呈现不同酸碱性的原因一、选择题(每小题有1个或2个选项符合题意)1.下列各物质的溶液显酸性的是()A.NaHCO3B.(NH4)2SO4C.NaCl D.CH3COOK【解析】(NH4)2SO4为强酸弱碱盐,其溶液显酸性。
【答案】 B2.(2011·大连高二检测)将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO-3、⑧NH+4分别加入H2O中,基本上不影响水的电离平衡的是()A.①③⑤⑦⑧B.②④⑦C.①⑥D.②④⑥⑧【解析】H+、OH-抑制水的电离,Al3+、S2-、NH+4能发生水解而促进水的电离,Cl-、K+、NO-3对水的电离无影响。
【答案】 B3.下列物质在常温下发生水解时,对应的水解方程式正确的是()A.Na2CO3:CO2-3+H2O2OH-+CO2↑B.NH4NO3:NH+4+H2O NH3·H2O+H+C.CuSO4:Cu2++2H2O Cu(OH)2↓+2H+D.KF:F-+H2O===HF+OH-【解析】A项,CO2-3水解不会有CO2生成,错误;C项,不能生成Cu(OH)2沉淀,不用标“↓”符号;D项,应用“”。
【答案】 B4.在医院里,为酸中毒病人输液一定不能采用()A.0.9%氯化铵溶液B.0.9%氯化钠溶液C.1.25%碳酸氢钠溶液D.5%葡萄糖溶液【解析】酸中毒不应再输入酸性液体,而A项NH4Cl溶液显酸性。
【答案】 A5.下列物质的水溶液中,除了水分子外,不存在其他分子的是()A.HCl B.NH4NO3C.Na2S D.HClO【解析】A项HCl完全电离;B项NH+4水解,NH+4+H2O NH3·H2O+H+,有NH3·H2O分子;C项S2-水解,产生H2S分子;D项HClO是弱电解质,不完全电离,有HClO分子。
【答案】 A6.pH=4的醋酸和氯化铵溶液中,前者与后者比较,水的电离程度的关系是()A.大于B.小于C.等于D.无法确定【解析】醋酸抑制水的电离,而NH4Cl水解促进水的电离。




【盐类的水解知识大复习】一、探究盐溶液的酸碱性结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
二、盐溶液呈现不同酸碱性的原因三、盐的水解原理1.泄义:在溶液中,盐电离出来的阴离子或阳离子与水所电离出来的H+或0H结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件a.盐必须溶于水中b.生成盐的酸或碱是弱酸或弱碱(有弱才水解,无弱不水解,都弱双水解)4.水解特征水解是微弱、可逆的,用可逆符号“=”【小结】水解规律:有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性5盐溶液中水的电离规律【例题】1、pH=3的HC1和pH=ll的NaOH溶液中由水电离出来的c(H+)*2、pH=3的NHQ 和pH=ll的CH3COONa溶液中由水电离出来的c(H+)水【小结】盐溶液中水的电离有如下规律:a.在强酸弱碱盐溶液中,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离)中水的电离程度大。
b.在酸或碱溶液中,c(HJ、c(OH)中小的那一个表示水的电离:在盐溶液中,c(H+)、c(OH) 中大的那一个反映了水的电离程度。
四、水解方程式的书写(1)判断能否水解;(2)水解是微弱的,用可逆符号表示。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“丨"或“ f ",也不把生成物(如H2CO3、NH)・FhO等)写成其分解产物的形式:(3)多元弱酸的盐分步水解,以第一步为主。
(4)多元弱碱盐的水解视为一步完成。
(5)双水解一一不完全双水解与完全双水解不完全水解用可逆符号,完全水解用等号表示。
五、盐类水解的影响因素1•内因——越弱越水解〔越热越水解,越稀越水解)以醋酸钠为例:CH3COO+H2O CHsCOOH+OH- K hK _ c(CH.COOH) c(OH ) _ c(CH.COOH) ・c(OH) • c(H ) »c(CH,COO ) c(CHCOO ) c(H )KA弱酸或弱碱的电离常数越(越弱),其所生成的盐水解的程度就越大。

盐类的水解【学法指导】1.从组成盐的离子成分角度分析盐类水解的本质。
2.以动态平衡的观点分析盐类水解对水电离平衡的影响,掌握盐类水解的规律。
3.以离子方程式的形式,表达盐类水解。
【基础梳理】一、探究盐溶液的酸碱性归纳总结强酸强碱盐:。
强酸弱碱盐:。
强碱弱酸盐:。
【典例1】正误判断。
(1) 盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡( )(2) NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)( )(3) 在CH3COONa溶液中,由水电离出的c(OH-)≠c(H+) ( )(4) 水电离出的H+(或OH-)与盐电离出的弱酸阴离子(或弱碱阳离子)结合,使盐溶液呈碱性(或酸性)( )答案:√×√√二、溶液呈现酸碱性不同的原因用生成弱电解质c(H+)和c(OH-)的相对大小结论盐溶液的酸碱性,与盐在水中电离出来的离子和水电离出来H+或OH-能否结合生成弱电解质有关。
(1)强酸弱碱盐的水解(NH4Cl溶液)理论解释平衡时溶液的酸碱性离子方程式(2)强碱弱酸盐的水解(CH3COONa溶液)理论解释平衡时溶液的酸碱性离子方程式试分析NaCl 溶液呈中性的原因: ☂名师点拨Na 2CO 3的水解分两步进行:第一步:Na 2CO 3在水溶液中电离出来的CO 32-与水电离出来的H+结合生成HCO 3-2323CO H OHCO OH ---++第二步:生成HCO 3-继续与水电离出来的H+结合成弱电解质H 2CO 33223HCO H OH CO OH --++Na 2CO 3在水溶液中电离出来的CO 32-与水电离出来的H+结合生成HCO 3-,HCO 3-又与水电离出来的H+结合生成H 2CO 3,促进水继续电离,溶液中c(H +)<c(OH -),溶液显碱性。
Na 2CO 3第二步水解的程度比第一步小得多,平衡时溶液中H 2CO 3的浓度很小,不会放出CO 2气体。
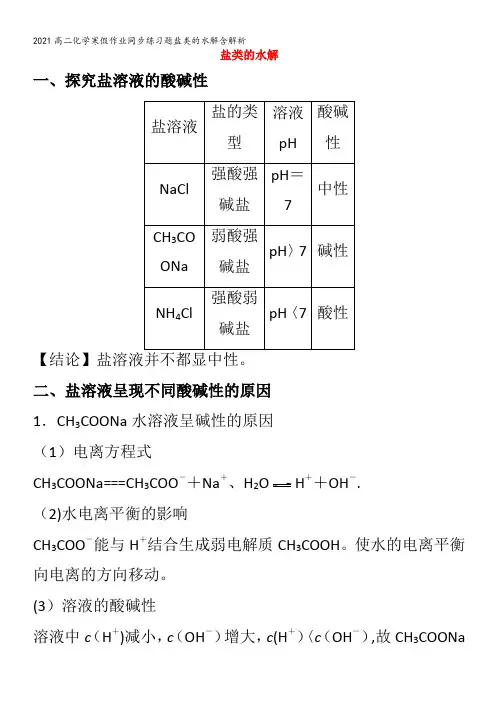
盐类的水解一、探究盐溶液的酸碱性【结论】盐溶液并不都显中性。
二、盐溶液呈现不同酸碱性的原因1.CH3COONa水溶液呈碱性的原因(1)电离方程式CH3COONa===CH3COO-+Na+、H2O H++OH-.(2)水电离平衡的影响CH3COO-能与H+结合生成弱电解质CH3COOH。
使水的电离平衡向电离的方向移动。
(3)溶液的酸碱性溶液中c(H+)减小,c(OH-)增大,c(H+)〈c(OH-),故CH3COONa溶液呈碱性.(4)水解方程式化学方程式:CH3COONa+H2O CH3COOH+NaOH。
离子方程式:CH3COO-+H2O CH3COOH+OH-。
2.NH4Cl溶液呈酸性的原因(1)电离方程式NH4Cl=NH错误!+Cl-、H2O H++OH-。
(2)水电离平衡的影响NH+4与OH-结合生成弱电解质NH3·H2O,使水的电离平衡向电离的方向移动。
(3)溶液的酸碱性溶液中c(OH-)减小,c(H+)增大,c(H+)〉c(OH-),故NH4Cl 溶液呈酸性。
(4)水解方程式化学方程式:NH4Cl+H2O NH3·H2O+HCl。
离子方程式:NH+,4+H2O NH3·H2O+H+.3.NaCl溶液呈中性的原因NaCl溶于水后电离产生Na+和Cl-,不能与水电离出的OH-、H +结合成难电离的物质,水的电离平衡不发生移动,c(H+)=c(OH -),溶液呈中性.4.盐类水解(1)盐类水解的实质在溶液中盐电离出来的离子(弱碱的阳离子或弱酸的阴离子)结合水电离出的OH-或H+生成弱电解质,破坏了水的电离平衡,促进了水的电离,使溶液显酸性、碱性或中性。
(2)盐类水解的规律在可溶性盐溶液中:有弱才水解,无弱不水解,越弱越水解,都弱都水解,谁强显谁性。
常见的“弱"离子弱碱阳离子:NH错误!、Al3+、Mg2+、Zn2+、Fe3+、Cu2+等。
弱酸根离子:CO错误!、SiO错误!、HCO错误!、AlO错误!、SO错误!、S2-、HS-、ClO-、CH3COO-、F-等。


【人教版】选修4知识点总结:第三章水溶液中的离子平衡一、弱电解质的电离课标要求1、了解电解质和非电解质、强电解质和弱电解质的概念2、掌握弱电解质的电离平衡3、熟练掌握外界条件对电离平衡的影响要点精讲1、强弱电解质(1)电解质和非电解质电解质是指溶于水或熔融状态下能够导电的化合物;非电解质是指溶于水和熔融状态下都不导电的化合物。
注:①单质、混合物既不是电解质,也不是非电解质。
②化合物中属于电解质的有:活泼金属的氧化物、水、酸、碱和盐;于非电解质的有:非金属的氧化物。
(2)强电解质和弱电解质①强电解质:在水溶液中能完全电离的电解质称为强电解质(如强酸、强碱和大部分的盐)②弱电解质:在水溶液里只有部分电离为离子(如:弱酸、弱碱和少量盐)。
注:弱电解质特征:存在电离平衡,平衡时离子和电解质分子共存,而且大部分以分子形式存在。
(3)强电解质、弱电解质及非电解的判断2、弱电解质的电离(1)弱电解质电离平衡的建立(弱电解质的电离是一种可逆过程)(2)电离平衡的特点弱电解质的电离平衡和化学平衡一样,同样具有“逆、等、动、定、变”的特征。
①逆:弱电解质的电离过程是可逆的。
②等:达电离平衡时,分子电离成离子的速率和离子结合成分子的速率相等③动:动态平衡,即达电离平衡时分子电离成离子和离子结合成分子的反应并没有停止。
④定:一定条件下达到电离平衡状态时,溶液中的离子浓度和分子浓度保持不变,溶液里既有离子存在,也有电解质分子存在。
且分子多,离子少。
⑤变:指电离平衡是一定条件下的平衡,外界条件改变,电离平衡会发生移动。
(3)电离常数①概念:在一定条件下,弱电解质在达到电离平衡时,溶液中电离所生成的各种离子浓度的乘积跟溶液中未电离的分子浓度的比是一个常数。
这个常数叫做电离平衡常数,简称电离常数,用K来表示。
舅达我二对一元開隈HAJI\H”②忒皆)•OH2UO3[T对■丿亡刃为at BOH:B<Hi--u*on②意义:K值越大,表示该弱电解质越易电离,所对应的弱酸或弱碱相对较强。


第三节盐类的水解(课时1、2)一、盐溶液的酸碱性2.任何一种盐都可以看作是和反应的产物,按生成盐的酸和碱的强弱可以把盐分为:水溶液呈性水溶液呈性水溶液呈性弱酸弱碱盐水溶液的酸碱性要看弱酸和弱碱的相对强弱。
(谁强显谁性)要求:能够根据化学式判断盐的种类,进而推出前三种盐溶液的酸碱性(1)常见的强酸有、、、、、。
(1)常见的强碱有、、、。
(另第IA族的铷、铯, 第IIA族的锶对应的碱) 例题:实验室有下列试剂:①NaOH溶液②水玻璃③Na2S溶液④NH4Cl溶液⑤浓H2SO4,其中必须用带橡胶塞的试剂瓶保存的是()A、①④⑤B、①②③C、①②④D、②④⑤二、盐溶液呈现不同酸碱性的原因溶液呈酸、碱性取决于.强酸强碱盐溶液中没有任何因素使c(H+)和c(OH—)不相等,因此强酸强碱盐溶液呈性.任何水溶液中都存在水的电离平衡.强酸弱碱盐在水溶液中完全电离,电离出阳离子和阴离子,则强酸弱碱盐电离出来的离子和水电离出来的离子结合成使H2O的电离平衡向方向移动,到达新平衡时c(H+) c(OH—),溶液呈性.例:NH4Cl溶液: 水微弱电离,电离出和NH4Cl在水溶液中完全电离,电离出和NH4Cl电离出的和水电离出的结合生成, 使H2O的电离平衡向方向移动,到达新平衡时c(H+) c(OH—),溶液呈性.化学方程式离子方程式NH4Cl水溶液存在的微粒有种,分别是.强碱弱酸盐在水溶液中完全电离,电离出阳离子和阴离子,则强碱弱酸盐电离出来的离子和水电离出来的离子结合成(或)使H2O的电离平衡向方向移动,到达新平衡时c(H+) c(OH—),溶液呈性.例: CH3COONa在水溶液中完全电离,电离出和CH3COONa电离出的和水电离出的结合生成, 使H2O的电离平衡向方向移动,到达新平衡时c(H+) c(OH—),溶液呈性. 化学方程式离子方程式CH3COONa水溶液存在的微粒有种,分别是.三、盐类的水解:在中电离出来的离子跟水所电离出来的或结合生成的反应..1、必须在中,不溶于水的部分不考虑.2、生成弱酸或弱碱(难电离微粒)3、实质:复分解反应盐+水酸+碱(中和反应的逆反应)中和反应热,所以水解热.中和反应程度,所以水解程度(较大、较小),书写水解方程式时要用可逆符号.由于程度较小一般不标明气体,沉淀符号.另:多元弱酸根离子分步水解,以为主(除SiO32-外),都要分步写.要求:能够判断是否是水解反应,要能够书写水解的化学方程式和离子方程式1.下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是()(A)CH3COONa (B)Na2SO4 (C)NH4Cl (D)H2SO42.下列式子属于水解反应,且溶液呈酸性是( )(A)HCO3—+H2O H3O++CO32—(B)Fe3++3H2O Fe(OH)3+3H+(C)HS—+H2O H2S+OH—(D)NH4++H2O NH3·H2O+H+3.按要求写出下列水溶液中水解的化学方程式和离子方程式,并判断溶液的酸碱性, (1)硫酸铁:(2)明矾(3)硝酸铵(4)硫酸铜(5)氯化镁(6)硅酸钠(7)碳酸钾(8) 碳酸氢钡(9)偏铝酸钠(10)次氯酸钠(11)硫化钠(12)NaCN(13)K2C2O4(草酸钾、乙二酸钾)(14)磷酸钠水溶液呈酸性的是水溶液呈碱性的是4.写出离子方程式(1)将NH4Cl加入到重水中。
盐类的水解(第1课时)高中化学选择性必修1第三章第三单元1.通过测定一组盐溶液的pH,发现盐溶液的酸碱性不同,认识盐的类型与溶液酸碱性之间的规律性联系;2.通过水的电离平衡及弱电解质电离平衡规律的综合应用,认识盐类水解的微观原理;3.能够用化学用语正确表示盐类的水解反应,理解盐类水解反应的特点。
我们知道,Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用于中和酸,也常用于油污的清洗等。
为什么Na2CO3可被当作“碱”使用呢?复习必修阶段一个实验,向Na2CO3溶液中滴加酚酞溶液,可观察到什么现象?滴加酚酞溶液后,碳酸钠溶液变红了。
通过实验说明,Na2CO3溶液是呈碱性的,这就是为什么Na2CO3可以当作“碱”使用的原因。
【任务一】探究盐类组成与其溶液酸碱性的关系【任务二】探究盐溶液呈现不同酸碱性的原因【任务三】正确书写盐类水解的离子方程式【任务一】探究盐类组成与其溶液酸碱性的关系1.盐溶液的酸碱性学习目标情境导入学习任务学习活动【活动设计】【提出问题】酸溶液呈酸性,碱溶液呈碱性。
那么,盐溶液的酸碱性如何呢?与盐的类型之间有什么关系?【实验探究】选择合适的方法测试下表所列盐溶液的酸碱性。
盐溶液NaCl Na2CO3NH4Cl KNO3CH3COONa(NH4)2SO4酸碱性1.测试溶液酸碱性的方法酸碱指示剂法pH试纸法pH计法2.通过pH计测得不同盐溶液的pH3.测试结果盐溶液NaCl Na2CO3NH4Cl KNO3CH3COONa(NH4)2SO4酸碱性中性碱性酸性中性碱性酸性【结果分析】分析上述实验结果,同学们能归纳出盐溶液的酸碱性有什么规律吗?强酸弱碱盐溶液呈酸性,强碱弱酸盐溶液呈碱性,强酸强碱盐呈中性。
盐溶液的酸碱性是与生成盐的酸和碱的强弱有关。
【设计意图】实验设计是探究活动非常重要的一个环节,让学生主动参与实验的设计并给出实验方案,有利于发展学生的实验观。
通过pH计测定并记录不同盐溶液的pH,结合对盐的类型进行分析,引导学生归纳出盐溶液的酸碱性与盐的类型之间的关系。
盐类的水解及其应用第1课时【学习目标】通过实验归纳盐溶液的酸碱性与其类型之间的关系,并进一步探究盐溶液呈现不同酸碱性的原因,总结其规律【学习重难点】盐类水解的原理一、探究盐溶液的酸碱性及原因教学过程【引入】通过学习我们知道,酸溶液呈酸性,是因为酸电离出H+,破坏了水的电离平衡,使[H+]>[OH-];碱溶液呈碱性,是因为碱电离出OH-,破坏了水的电离平衡,使[H+]<[O H-];盐不能电离出H+或OH-,盐溶液是否显中性?水溶液的酸碱性是由溶液中氢离子和氢氧根离子浓度的相对大小决定的。
[H+] =[OH—],溶液呈中性[H+] >[OH—],溶液呈酸性,且[H+]越大酸性越强[H+]< [OH—],溶液呈碱性,且[OH—]越大酸性越强酸溶液中酸也电离出H+,从而使得[H+] >[OH—],溶液呈酸性,碱溶液中碱也电离出OH—,从而使得[H+] < [OH—],溶液呈碱性,一、自探设疑请同学们阅读鲁科版课本,以小组为单位提出本节课你想了解的内容,归纳形成自探提纲。
根据自探提纲,独立自探,初步解决相关问题。
教师预设的自探提纲:1.盐类水解的定义;2.盐类水解的条件;3.盐类水解的实质;4.水解的表示方法。
二、解疑合探小组内讨论,对你学习的内容进行补充完善,并准备展示、评价。
1.书面展示工整、规范、条理清晰,要体现小组内的最高智慧;2.非展示同学继续讨论,在同学点评时及时提出自己的疑问或补充;3.评价同学先打分,不够满分,说出扣分依据(先评书写,再评对错,后简述知识点)。
教师点拨、补充、讲解:【实验探究一】盐溶液的酸碱性实验:鲁科版教材82面活动探究测0.1mol/L溶液的PH 【设疑自探一】若按中和反应生成盐的酸、碱的强弱对盐进行分类,可将盐分为四类,如Na2SO4属于“强酸强碱盐”,将82面活动探究中的盐进行分类,填入下表。
并归纳出盐的二者关系?谁强显谁性【解疑合探一】盐类水解的原理纯水中加入CH3COONa晶体使之成为0.1mol/l的醋酸钠溶液。
《盐类的水解》导学案一、学习目标1、理解盐类水解的概念,能判断盐溶液的酸碱性。
2、掌握盐类水解的实质和规律。
3、学会书写盐类水解的离子方程式。
二、知识回顾1、酸和碱在水溶液中会发生电离,酸电离出_____和_____,碱电离出_____和_____。
2、溶液的酸碱性取决于溶液中_____和_____的相对大小。
当_____>_____时,溶液呈酸性;当_____<_____时,溶液呈碱性;当_____=_____时,溶液呈中性。
三、盐类水解的概念1、定义:在溶液中盐电离出来的_____(或_____)跟水电离出来的_____或_____结合生成_____的反应,叫做盐类的水解。
2、实质:盐类的水解破坏了水的电离平衡,促进了水的电离。
四、盐类水解的规律1、有弱才水解(1)强酸强碱盐(如 NaCl、KNO₃等)不水解,溶液呈_____性。
(2)强酸弱碱盐(如NH₄Cl、CuSO₄等)水解,溶液呈_____性。
(3)强碱弱酸盐(如 CH₃COONa、Na₂CO₃等)水解,溶液呈_____性。
(4)弱酸弱碱盐(如 CH₃COONH₄等)水解,溶液的酸碱性取决于_____相对强弱。
2、谁弱谁水解(1)相同浓度的 NH₄Cl 和(NH₄)₂SO₄溶液,_____溶液中的NH₄⁺水解程度更大。
(2)相同浓度的 CH₃COONa 和 NaHCO₃溶液,_____溶液中的阴离子水解程度更大。
3、越弱越水解(1)相同浓度的 Na₂CO₃和 NaHCO₃溶液,_____溶液的碱性更强,因为_____的酸性更弱。
(2)相同浓度的 CH₃COONH₄和 NH₄HCO₃溶液,_____溶液中的 NH₄⁺水解程度更大,因为_____的酸性更弱。
4、都弱双水解(1)当两种离子水解相互促进程度较大时,水解反应可以进行到底。
例如:Al³⁺与 HCO₃⁻在溶液中发生双水解反应生成_____和_____。
(2)常见的能发生双水解反应的离子组合有:Al³⁺与_____、_____;Fe³⁺与_____、_____等。